肽酰亚胺类农药多克隆抗体的制备与鉴定
王松,王骏,宫萍,高建国,刘润珠,王亚恩,辛学谦,王建华
(1.中国水产科学研究院黄海水产研究所,山东青岛266071;2.山东出入境检验检疫局食品农产品中心,山东青岛266002)
克菌丹、灭菌丹和敌菌丹是一类多作用点的广谱保护性杀菌剂,同属于酞酰亚胺类。可与大多数常规农药混用,主要用于防治果树、蔬菜和经济作物上多种病害。但这些农药均对人体有生物毒性,一经摄入会严重影响人体健康。国家农药残留标准中已严格规定其在粮食和蔬菜中的限量(0.01 mg/kg)[1],但违禁使用现象仍较严重,需建立快速、灵敏的检测方法,对其加强监测,故开展本研究对保障人民身体健康与保护环境具有重要意义。目前酞酰亚胺类农药残留检测方法主要有液相色谱法[2]、气相色谱法或气质联用法[3]。这些方法前处理过程复杂,检测时间长,费用高,操作人员易接触有毒有机溶剂和化学试剂。而液相柱后衍生不好掌握,这两种分析方法都存在一定的局限性。近年来,酶免疫测定法(Enzyme-linked Immunosorbent assay,ELISA)受到广泛重视,此检测法灵敏度高,特异性强,仪器设备要求低和样本前处理相对简单等优点,适于现场监控和大量样本筛查。
1 材料与方法
1.1 材料和仪器
1.1.1 供试药品和试验动物
克菌丹(纯度=98)、敌菌丹(纯度=98.5%)、灭菌丹(纯度=98.5%):德国Dr;牛血清白蛋白:BSA;N 一经基唬泊酞亚胺:NHS;水溶性碳化二亚胺:EDC;弗氏完全佐剂、弗氏不完全佐剂、酶标二抗等:Sigma 公司;酶联免疫吸附测定中所用的试剂均为国产分析纯试剂,按照文献[11]自配。实验动物为健康雄性新西兰大白兔:中科院基因研究所动物实验中心。
1.1.2 仪器
台式高速冷冻离心机:日立公司;酶标仪、紫外可见分光光度计:岛津公司;二氧化碳培养箱、Nexus 670型傅立叶变换红外光谱仪:Nieolet 公司。
1.2 方法
1.2.1 人工抗原制备
1.2.1.1 半抗原活化
取3.0 g TPHI 钾盐溶于15 mL 含1.1 g KOH 乙醇中,旋转蒸发,加入3.6 g 5-溴戊酸。加入4 mL DMF(N-甲酰二胺)索氏提取16 h。将反应混合物转移至分液漏斗,加入45 mL 稀HCL,再用60 mL 二氯甲烷进行萃取。取有机相加入30 mL 5%NaHCO3进行提取,稀HCL 酸化,再加入30 mL 二氯甲烷,重复二次后,干燥,产物采用薄层层析鉴定。原理如图1。
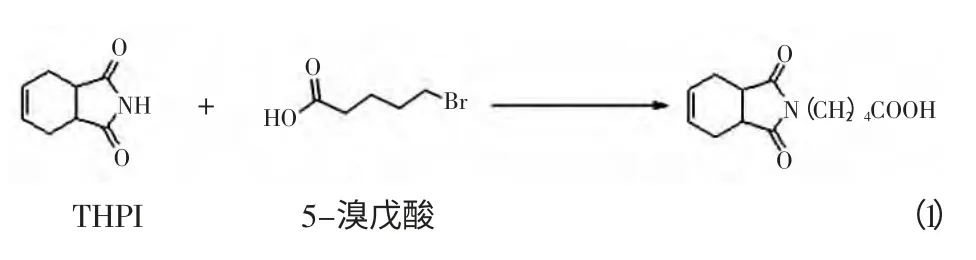
图1 半抗原活化Fig.1 Activation of Hapten
1.2.1.2 与载体蛋白偶联
采用EDC 方法(碳二亚胺)将半抗原与与载体蛋白相偶联[12],称取40 μmoL 的THPI 衍生物,溶于1.0 mL 0.05 mol/L PB PH7.0,加入100 mg EDC,再1.5 mL 28 mg BSA(牛血清白蛋白),4 ℃搅拌反应18 h~24 h。见图2。
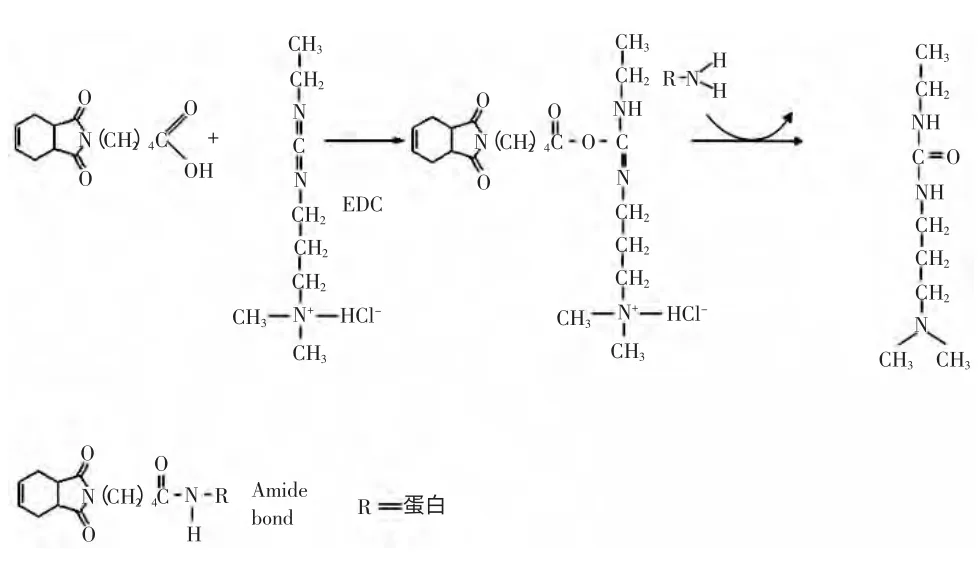
图2 半抗原与载体蛋白偶联Fig.2 Hapten conjugated with bovine seraalbumin(BSA)
1.2.2 动物免疫
取3 mg 蛋白与弗氏完全佐剂(Sigma)混匀乳化,取体重2 kg 大耳白兔,背部皮下多点注射抗原。两周后,取1.5 mg 蛋白溶液与弗氏不完全佐剂(Sigma)混匀乳化,进行皮下第二次免疫。以后每隔4 周,进行第三、四次免疫,耳静脉采血。
1.2.3 抗体检测
1)抗血清采用正辛酸一硫酸铵二步法[13]沉淀纯化。
2)间接法检测抗体效价[13]。
3)制作农药标准品标准曲线[13]。
1.3 竞争法ELISA[14]检测农药
1.4 3 种农药多抗交叉反应测定[14]
将3 种酞酰亚胺类农药和其他结构农药配制成质量浓度为1 g/L 的储备溶液,然后取少量用PBS 10倍比稀释成不同质量浓度溶液,每个质量浓度取50 μI与50 μI 工作浓度的多抗血清混合,加到按1.2.3.2 项方法包被封闭好的酶标板内,37 ℃反应l h;然后按1.2.3 中2)项步骤加羊抗兔IgG—HRP、加底物、终止反应并测定OD450值等进行;同时设阴性对照和空白对照孔。通过计箅得出多抗与其他类农药的交叉反应率,按以下公式计算:
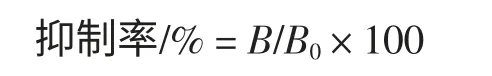
式中:B0为不含农药标准品孔(0 mg/L)的吸光值减去含最大浓度农药准品孔(100 mg/L)吸光值;B为其余质量浓度农药标准品孔的吸光值减去含最大质量浓度农药标准品孔的吸光值。以C 为横坐标(C 为农药标准品的质量浓度),抑制率为纵半标,建立检测农药的标准曲线;根据标准曲线的线性方程,计算产生20 %抑制率(B/B=80 %)时所需的农药的质量浓度(IC20值),以IC20值为最小检测限。其他类农药的标准曲线建立方法与农药的标准曲线方法相同。根据相应的标准曲线回归方程计算对应的其他类农药产生50 %的抑制率时所需要的相应农药的浓度(IC50值)。
1.5 抗体特异性检测[14]
取3 种酞酰亚胺类农药标准品敌菌丹、克菌丹、灭菌丹和3 种有机磷类农药以及三氯杀螨醇、百菌清、莠去津等稀释成系列质量浓度梯度(10-1mg/mL),进行交叉反应实验,以此评价抗体特异性。
1.6 添加回收率的测定
称取10 g 苹果,按0.025 mg/kg~5.0 mg/kg 分别添加敌菌丹、克菌丹及灭菌丹,每个浓度设6 个重复,用间接ELISA 法对样品进行分析,上样量为50 μL,测定样品的吸光值,由平均吸光值计算抑制率,再利用标准曲线计算农药残留浓度。计算该方法的回收率和变异系数。
2 结果与分析
2.1 抗体效价测定
抗体效价血清效价定为(P/N)2.1,结果显示,当包被原浓度为1.0 mmol/L 时,TPHI-BSA 抗血清效价达2.56×104,抗体纯化后冻干粉的效价则达5.12×104。这说明免疫原的合成是成功的,而且纯化后抗体的效价有所提高。
2.2 间接竞争法ELISA 检测农药
2.2.1 ELISA 工作条件的确定
用系列浓度的包被抗原包被酶标板,将抗血清作梯度稀释,同时在酶标板上用方阵滴定法进行测定。选择OD 值在1.0 左右,且抗原抗体用量最少的抗原包被物浓度和抗血清的稀释度为最适工作浓度。结果确定本试验中包被抗原最适工作浓度为10.0 μg/mL,抗血清最适稀释度为1 ∶8 000。
2.2.2 THPI 衍生物抗血清与农药免疫反应
以农药作为竞争抑制抗原,间接竞争ELISA 法检测不同浓度敌菌丹对抗体的抑制情况。包被浓度为0.12 μg/mL,抗体稀释度为8000。以农药浓度的值(ng/mL)为横坐标,以OD450为纵坐标,绘制敌菌丹抑制率曲线,对曲线进行线性回归,结果表明THPI 衍生物抗血清对敌菌丹抑制率得到回归方程为y=-35.801 LnX+73.279,R2=0.990 3,IC50约为250 ng/mL,检测限为30 ng/mL。如图3。

图3 THPI 抗血清ELISA 竞争法检测敌菌丹抑制曲线图Fig.3 Inhibition curve of captafol by indirect ELISA for immunized THPI antisera
THPI 衍生物抗血清对克菌丹(captan)抑制率得到回归方程为y=-41.424Lnx+88.94,R2=0.989 2,IC50约为200 ng/mL,检测限为15.0 ng/mL。如图4。
2.3 3 种农药多抗交叉反应及两种抗血清特异性检测
2.3.1 TPHI 衍生物抗血清特异性检测
间接竞争ELISA 法检测结果显示TPHI 抗血清对克菌丹、敌菌丹IC50值为0.2 μg/mL~0.3 μg/mL 之间,灭菌丹IC50为0.588 μg/mL,与克菌丹交叉反应率大于90%,与灭菌丹交叉反应率大于50%;与其他类型农药反应IC50值均大于100 μg/mL 交叉反应率小于1.26%。

图4 THPI 衍生物抗血清ELISA 竞争法检测克菌丹抑制曲线图Fig.4 Inhibition curve of captan by indirect ELISA for immunized THPI antisera
2.4 TPHI 衍生物抗血清添加回收检测
检测结果显示当农药添加浓度在0.25 μg/mg~5.0 μg/mg 之间时TPHI 衍生物分别对苹果样品中的3种农药的平均回收率在80%~100%之间,变异系数在2%~10 %之间。
3 讨论
合成有效的半抗原是获得小分子物质特异性单克隆抗体的前提,半抗原分子的结构决定了抗体的特异性与亲和性。因此免疫半抗原的分子设计是建立小分子免疫化学分析的关键。由于酞酰亚胺类农药是芳香环结构的小分子化合物,其本身不能作为免疫原。为了使该化合物具有免疫原性,需先合成带有活性基团常用为羧基与氨基,也可为巯基,再通过这些基团连接到载体蛋白如BSA,这样免疫动物才能产生特异抗体。由于与酞酰亚胺类农药的芳香环部分相近似,因此从THPI(Tetrahydrophthalimide)出发合成酞酰亚胺类农药半抗原,由此进行免疫动物获得酞酰亚胺类农药广谱特异性抗体。
1)本实验通过经5-溴戊酸活化THPI 与BSA 构建半抗原,同时保持了酞酰亚胺类农药原有的分子结构特性,通过试验证明获得的多克隆抗体可以特异性识别THPI 半抗原而不识别BSA,说明该免疫原免疫动物后可以获得特异性的多克隆抗体。
2)检测结果显示THPI 抗体检测克菌丹的IC50约为0.217μg/mL,检测敌菌丹的IC50约为0.250 μg/mL,灵敏度达到30 ng/mL 左右,而与灭菌丹反应IC50约为0.588 μg/mL,表明THPI 衍生物产生的抗体对敌菌丹、克菌丹识别相对于灭菌丹有一定差异,但特异性不十分显著。推测可能由于敌菌丹、克菌丹末端为环己烯结构而灭菌丹为苯环结构,两种结构均为具有一定刚性平面结构化合物,属于较易引起特异性免疫识别结构,由此可能产生免疫识别特异性。说明该实验获得的多克隆抗体具备较高特异性的。可以完成对酞酰亚胺类农药较为准确的检测。
3)添加回收率试验评价3 种酞酰亚胺类农药ELISA 方法的准确度和精密度。添加浓度为0.1 μg/mg~5.0 μg/mg 时,该方法苹果中的添加回收率和变异系数分别为83.2%~109.6%和2%~9.2%,准确度和精密度均符合农药残留分析的要求。均达到国家相关农药检测标准检测低限。
[1] 全国文献工作标准化技术委员会.GB2763-2012 食品中农药残留最大限量[S].北京:中国标准出版社,2012:178
[2] 王淑菊,于彦彬,谭培公,等.固相萃取一高效液相色谱法同时测定苹果中残留的克菌丹和灭菌丹[J].色谱,2007,25(2):226-229
[3] 周艳明,关丽.气相色谱法测定马铃薯、番茄中克菌丹、灭菌丹、敌菌丹残留量的研究[J].食品工业科技,2009(7):11-15
[4] 赵肃清,孙远明,乐学义,等. 农药人工抗原合成的研究进展[J].农药2002,41(3):9-11
[5] 万圣,吕延成.有机磷及氨基甲酸酯类农药残留检测研究进展[J].广东农业科学,2009(3):25-23
[6] 梁颖,刘媛,祝金凤,等.甲氧基有机磷广谱多抗的制备[J].分析化学,2008,36(5):647-652
[7] 殷祥刚,尹丽梅,胥传来.有机磷农药多残留免疫分析方法研究进展[J].食品科学,2008,29(10):684-688
[8] Gendloff E H, Casale W L, Ram B P, et al. Hapten-proteinconjugates prepared by the mixed anhydride method cross-reactiveantibodies in heterologous anti-sera[J]. J Immuno Meth, 1986, 92(1) :15-20
[9] Wolter T H, Hanks W, William T J, et al. Syntheses of haptencontainning dioxaphosphorinan methoxyacetic organphospharepesticides[J].Bioconjugate chemistry,1997,8(3):257-266
[10] Abad A, Moreno M J, Montoya A. Development of monoclonalantibody based immuno assays to the N-methylcarbamate pesticide Carbofuran[J].Agricultura Food Chem,1999(47):2475-2485
[11] Pablo R,Betsabet S,Rodrigo O,et al.Screening anddetermination of pesticides in soil using continuous subcritical waterextraction and gas chromatography-mass spectrometry[J]. Journal of chromatography A,2003,994:169-177
[12] Antonio Abad, Maria J, Moreno, et al. A monoclonal immunoassay for carbofuran and its application to the analysis offruit juices[J].Analytica Chimica Acta,1997(347):103-110
[13] 董志伟.抗体工程[M].北京:北京医科大学中国协和医科大学联合出版社,1997,1-63
[14] Spinks CA,Wang B,Mills EN,et al.Development of an ELISA for paraquat:improvement of antibody characteristics by mversed affinity chromatrography[J].Analyst,1999,124(6):847-850

