木质素降解菌的筛选及产漆酶培养条件的优化
张安龙, 王桂秋, 杜 飞, 龚国利
(1.陕西科技大学 轻工与能源学院, 陕西 西安 710021; 2.陕西科技大学 生命科学与工程学院, 陕西 西安 710021)
0 引言
木质素(Lignin)是植物组织的主要成分之一,是自然界中仅次于纤维素的第二大有机物.它广泛存在于高等植物细胞中,是针叶木、阔叶木和草类植物的基本化学组成,约占其化学组成的15%~30%[1].木质素的分子结构非常复杂,主要由苯丙烷单元通过醚键和碳键等多种共价链连接而成,是一种无规则的、非水溶性的、三维网状的芳香族高分子聚合物[2].由于木质素分子结构的复杂性,不规则性和含有多种稳定的键型结构,导致其很难降解.此外,木质素与半纤维素包裹在纤维素的周围,从而影响了对纤维素的降解及分离.
白腐菌是一类具有使木质纤维素产生白色腐烂功能的丝状真菌的总称,是木腐真菌(wood rotting fungi)中对木质素的降解能力最强的成员,是已知的能在纯培养条件中,将木质素彻底降解为CO2和H2O的唯一一类生物[3].白腐菌对木质素的降解是由其产生的胞外酶,木质素过氧化物酶,锰过氧化物酶及漆酶来实现的,其降解过程是以自由基为基础的链反应过程,具有高度的非特异性和立体选择性[4].由于白腐菌对木质素及芳香族类难降解化合物的独特的降解作用,近些年已成为国内外研究的热点,但长期以来,人们对白腐菌的研究仅局限于黄孢原毛平革菌,变色栓菌等少数菌属,在这些菌属的应用研究中,往往无法满足白腐菌对木质素降解的理想培养条件,而且不同菌属的白腐菌对木质素的降解效率,产酶的种类和活性,以及环境条件的要求,也因菌种的不同而有很大的差异.因此,从自然环境中分离获得更丰富的白腐菌菌种,筛选得到在较宽泛环境条件下对木质素具有高降解效率的白腐菌,对白腐菌在实践中的应用,具有重大的现实意义.
本文通过对采集的菌种分离纯化,综合愈创木酚平板和鞣酸平板的变色反应筛选得到降解木质素能力强的菌株.通过菌丝形态的显微镜观察,初步确认该菌株为白腐菌.然后经过对菌株液体培养条件进行优化,从而得到该菌株液体培养产漆酶的最佳培养条件.
1 材料和方法
1.1 菌种
待筛选的菌株均采集于西安市未央湖公园,城市运动公园,及陕西科技大学校园内,从腐败的树枝,带有白色菌点的树皮上获取目标菌种.
1.2 培养基及溶液
基础培养基:马铃薯浸出液200 g,KH2PO43 g,MgSO4·7H2O 1.5 g,葡萄糖20 g,琼脂20 g,加自来水至1 000 mL.
分离纯化培养基:麦芽膏粉5 g,蛋白胨2 g,葡萄糖20 g,邻苯基苯酚0.01 g,琼脂20 g,加自来水至1 000 mL.
保藏培养基:马铃薯浸出液200 g,葡萄糖20 g,琼脂20 g,加自来水至1 000 mL.
初筛培养基:愈创木酚0.1 g,葡萄糖10 g,酒石酸铵0.2 g,蛋白胨2 g,MgSO4·7H2O 0.5 g, KH2PO41.5 g,琼脂20 g,加自来水至1 000 mL.
鞣酸变色培养基:马铃薯浸出液100 g,葡萄糖10 g,酒石酸铵0.5 g,鞣酸0.5 g,琼脂20 g,加自来水至1 000 mL.
苯胺蓝变色培养基:苯胺蓝0.1 g,其他成分同鞣酸变色培养基.
液体培养基:马铃薯土豆浸出液200 g,葡萄糖10 g,蛋白胨2 g,酒石酸铵0.2 g,KH2PO43 g,MgSO4·7H2O 1.5 g, CaCl20.1 g,维生素B11 mg,加自来水至1 000 mL.
缓冲液:将4.5 g丁二酸加入800 mL蒸馏水中,用NaOH溶液调其pH至4.5,用蒸馏水定容至1 L.
1.3 菌种的分离和纯化
将采集的带有目标菌种的树枝,树皮首先切成小段或小块,然后在蒸馏水中漂洗2~3次,然后用无菌的滤纸擦干.将基础培养基于121 ℃灭菌锅中灭菌20 min,然后在超净工作台中酒精灯火焰旁倒平板,待基础培养基冷凝后,将树枝或树皮接种到培养基中,每个培养基接种2~3块.接种后的平板至于28 ℃的恒温培养箱中培养3~4天,然后用接种环挑取白色的绒状或絮状的菌丝在分离纯化培养基倒成的平板上反复划线培养,直至获得纯菌株.
1.4 菌种的初筛和复筛
将获得的纯菌株接种到初筛培养基倒成的平板上,置于28 ℃的恒温培养箱中培养,每天观察菌丝的生长情况和培养基变色的情况.培养一段时间后挑选出变色圈在菌丝圈之外形成的且产生橙红色变色圈较明显的菌株,将其接种到复筛培养基,同样置于28 ℃的恒温培养箱中培养,并观察培养基的变色情况.
1.5 菌种的保藏
在复筛培养基中挑选变色反应明显的菌株将其接种到保藏培养基的斜面试管中,并置于28 ℃的恒温培养箱中培养2~3天,然后放到4 ℃的冰箱中保存备用.
1.6 菌种液体培养及漆酶酶活的测定
取50 mL的液体培养基装到250 mL的锥形瓶中,然后放到灭菌锅中,121 ℃灭菌20 min,冷却后接种经活化培养6 d的直径1 cm的菌块3~4块,并用纱布塞住瓶口,再用报纸包住,用绳子绑扎好,以免染菌.再将其放到恒温振荡器中培养.
1.7 漆酶酶活的测定
粗酶液的制备:菌种自在液体培养基中培养的第三天起,取适量的液体培养基,4 000 r·min-1在离心机中离心10 min,取上清液进行漆酶酶活的测定.
漆酶酶活的测定[5]:取0.5 mmol·L-1的愈创木酚溶液(用pH为4.5的缓冲溶液配制)2 mL于试管中,加入1 mL粗酶液,混合均匀后于30 ℃水浴反应30 min,测OD465在5 min内的变化值.对照管中加2 mL上述缓冲液和1 mL酶液.1个酶活力单位(U)是指每分钟氧化1μmoL的底物所需的酶量.
2 结果与讨论
2.1 菌种的分离和初筛
菌株的初始培养采用营养丰富的PDA综合培养基,菌丝容易在这种平板上生长扩增,培养7~8 d后菌丝就能布满整个平板.菌种的分离培养基中含有的0.1%浓度的邻苯基苯酚,可以有效地抑制树枝和树皮中的霉菌的生长,使其在培养基中仅可能形成有限的菌落.菌种经过在分离培养基的几次纯化就可以获得纯菌株.初筛的目的是获取能够降解木质素的菌株.Nishida等[6]通过研究认为,如果某种微生物能使愈创木酚的平板产生变色反应,则这种微生物具有降解木质素的能力.然而这种变色反应一般有两种情况,一种是变色圈在菌丝圈的外圈形成,另一种是变色圈在菌丝圈的内圈形成,当变色圈在菌丝圈的外圈形成时,该菌株能够降解木质素,反之则优先降解纤维素[7].根据这一结论,本实验在产生变色反应的平板中挑选变色圈在菌丝圈外圈形成的菌株.
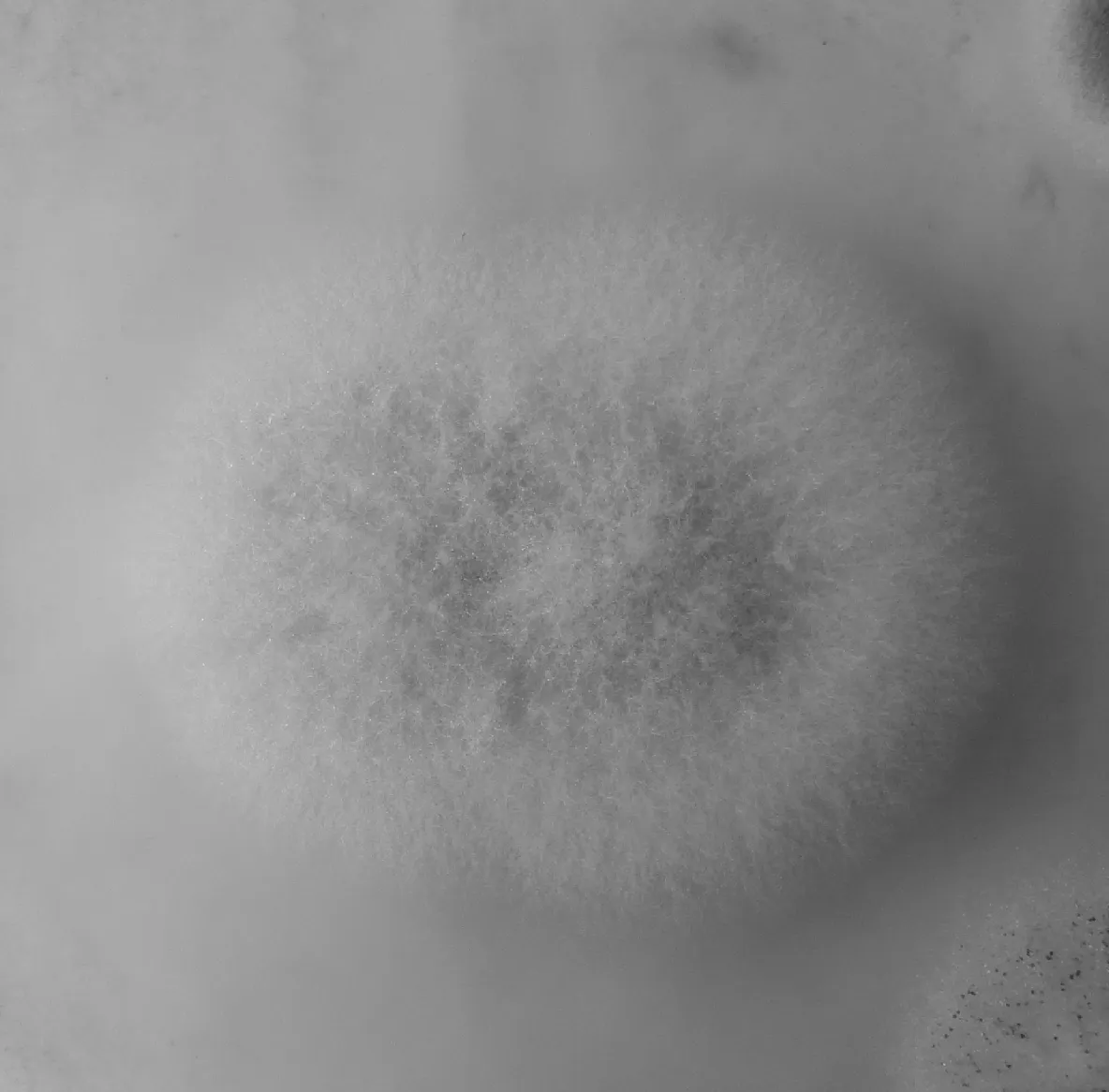
图1 愈创木酚平板变色反应
由图1所示,本实验条件下,挑选的这些菌株变色圈直径均大于菌丝圈,而且变色圈无一例外是在菌丝圈颜色较深呈红色,在菌丝外圈颜色较浅,呈橙色.
2.2 菌种的复筛
通过菌种的复筛,可以得到产酶能力强的菌株.鞣酸能利用木质素降解菌株产生的漆酶使酚类化合物聚合,从而在菌落周围形成棕褐色的氧化带,呈现阳性反应[8].根据变色圈直径的大小和产生的时间先后可以判定菌株产漆酶能力的强弱.染料苯胺蓝平板是利用木质素降解菌株产生的木质素过氧化物酶和锰过氧化物酶对苯胺蓝的脱色反应来反映这两种酶的产生.根据平板上菌落周围脱色圈的大小和脱色速度的快慢可以衡量菌株产木质素过氧化物酶和锰过氧化物酶的能力[9].
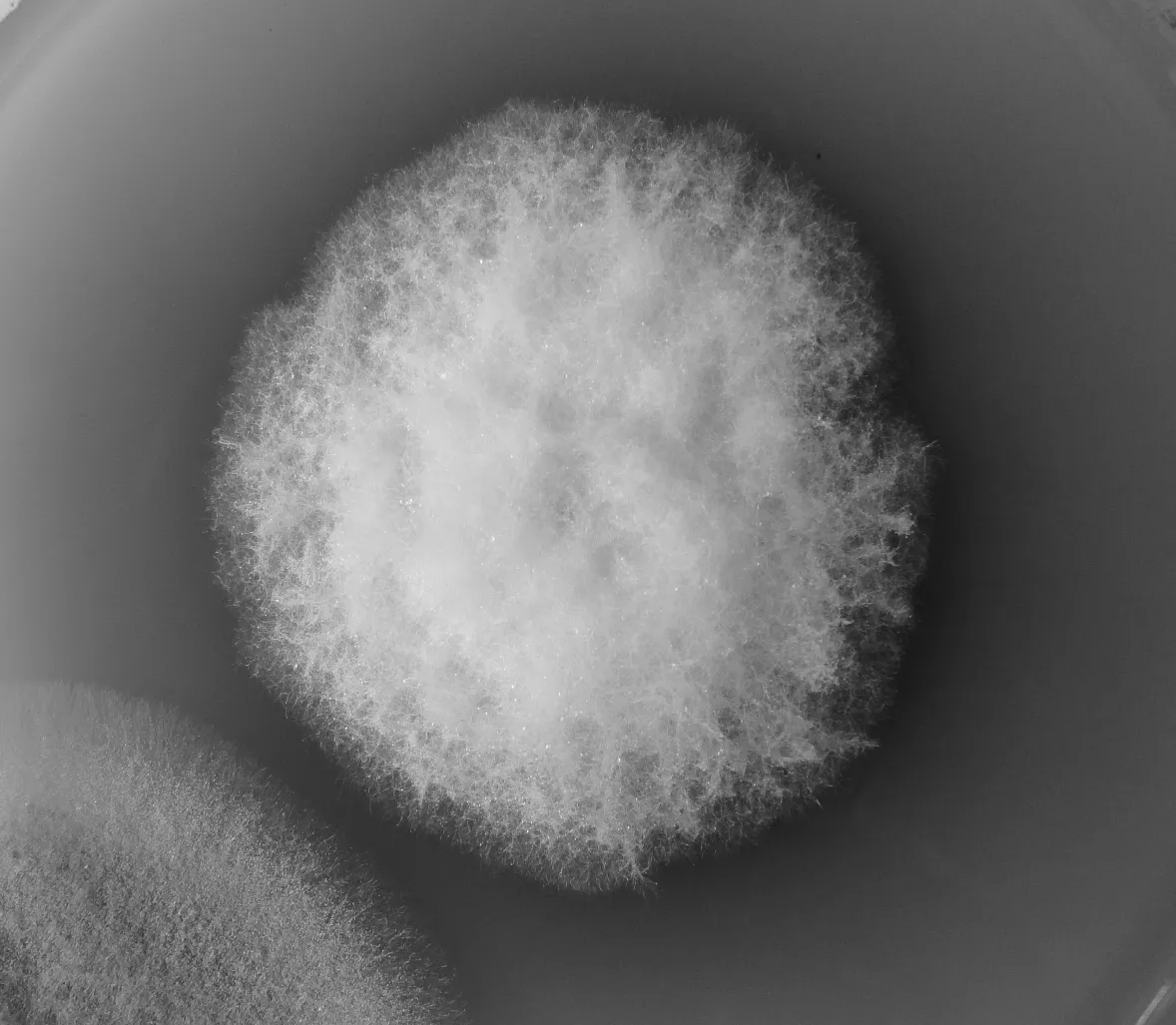
图2 鞣酸平板变色反应
从图2可以看出,本实验经过复筛的菌株培养5~6 d后鞣酸平板即产生了较明显的变色反应,变色圈直径较大且颜色极为明显,说明该菌株有较强的产漆酶能力.苯胺蓝平板在菌株培养过程中菌落周围未见明显的脱色反应.由于白腐菌对木质素的降解是依靠自身产生的多种胞外酶的作用,所以一般白腐菌不会单一的只产一种胞外酶.原因可能是采用的培养基底物的种类、性质、浓度等不利于该菌株产过氧化物酶,导致其产过氧化物酶效率很低;也有可能是菌株本身产过氧化物酶能力很弱,所以苯胺蓝平板上未见脱色的阳性反应.
2.3 菌丝的形态观察
从显色反应明显的鞣酸平板上取少量菌丝,用0.1%的亚甲基蓝染色之后用普通的光学显微镜观察.从图3可以看出,菌丝透明,无分支,菌丝内有多个细胞核,有节状隔膜,但数量较少,无锁状联合,菌丝间有大量的厚垣孢子出现.因此,由菌丝的上述特征,可以初步确认,筛选获得的菌株为白腐菌.

图3 菌丝的形态观察
2.4 产漆酶液体培养条件的优化
2.4.1 培养方式的影响
白腐菌是严格好氧的微生物,实验室规模的培养主要是通过锥形瓶口的棉塞与外界环境进行气体交换和氧气的补充.白腐菌的液体培养分为静止培养和振荡培养.据报道[10]大多数白腐菌在振荡培养时对产漆酶有利,部分白腐菌在静止培养时有利于漆酶的产生.本实验中,自筛的白腐菌在静止培养和振荡培养条件下产酶能力差别很大,结果如图4所示.

图4 培养方式对产漆酶的影响
从图4中可以看出,在静止培养时,白腐菌在培养的第13天达到产漆酶的高峰,酶活达到32 U·mL-1.振荡培养时.在培养的第11 d即达到酶活的高峰,酶活高达67 U·mL-1.静止培养时菌丝相互交织成网,最后形成了几乎布满锥形瓶底的菌丝垫.菌丝垫上层的菌丝可以在培养基和锥形瓶内空气的界面获得充足的氧气,而大部分下层的菌丝由于氧气向菌垫内部传递相对比较困难,所以下层的菌丝不能获得充足的氧气来利用培养基中的碳源和氮源进行生长代谢,所以进入次生代谢的阶段较慢.振荡培养条件下菌丝缠绕成团,形成白色小球.小球和液体培养基的接触面积相对菌垫来说较大,另外小球在锥形瓶内不停的运动,这样氧气在菌丝中有很好的传递和传质效果,因此小球在生长代谢过程中有充足的氧气利用,培养基中营养物质被利用的较充分,所以进入次生代谢的阶段不但快,而且由于营养物质的大量消耗,次生代谢的条件较理想,因此达到酶活高峰的时间短而且酶活较高.
2.4.2 温度的影响
白腐菌的生长和扩增所需的温度范围一般在28~39 ℃,实际上对温度的限制并不十分严格[3].从图5也可以看出,不同的培养温度对菌株产漆酶的影响并不十分显著,但28~35 ℃是比较合适的温度范围,在这个温度范围,白腐菌在11天达到漆酶酶活的高峰,比其他温度下培养达到酶活高峰要早1~2 d,因此28~35 ℃可以作为白腐菌培养的最佳温度范围.
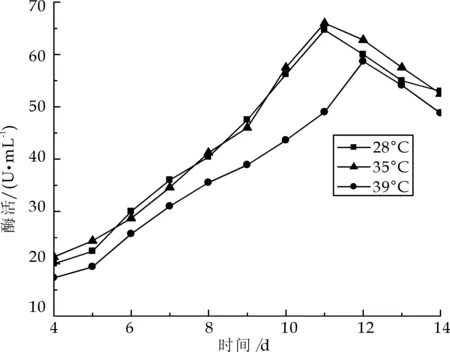
图5 温度对产漆酶的影响
2.4.3 转速的影响
在300 mL的锥形瓶中加入50 mL的液体培养基,接种白腐菌后,置于28 ℃的恒温振荡器中培养.从培养的第四天开始测漆酶的酶活.从图6可以看出,当恒温振荡器转速为140 r·min-1菌的漆酶酶活达到最大值.转速过大或过小都不利于白腐菌对漆酶的合成和分泌.原因是白腐菌是严格好氧的微生物,它的生长和代谢活动需要充足的氧气供应,较高的转速虽然能增大氧气在培养基中的传质效果,但是白腐菌产的漆酶是一种胞外酶,这种胞外酶对机械剪切力特别敏感,过高的机械剪切力容易造成漆酶结构的破坏和酶活性的丧失.

图6 恒温振荡器转速对产漆酶的影响
2.4.4 初始pH的影响
漆酶的合成和表达受环境pH的影响比较显著,因此培养基初始的pH直接影响白腐菌生长和产酶的代谢活动.由图7可知,当液体培养基初始pH为5时,白腐菌的产漆酶的活性最高,高于或低于5,白腐菌产漆酶的活性均受到不同程度的影响,尤其是低于5时,白腐菌不但生长扩增速度较慢,而且产酶活性较低.

图7 初始pH对产漆酶的影响
2.4.5 CuSO4加入量的影响
漆酶是一种含铜的多酚氧化酶,它的结构中有四个铜原子[11].Cu2+的加入对漆酶合成和活性有很强的诱导作用,其中CuSO4是使用最多的,诱导效果最好的重金属诱导剂[12].

图8 Cu2+浓度对产漆酶的影响
从图8可以看出,随着CuSO4浓度的增加白腐菌分泌漆酶的活性也随之升高,在0.5 mmol·L-1时达到最高,约是无Cu时的3倍,所以此CuSO4浓度下对白腐菌产漆酶的诱导效果最好,这是由于Cu2+不但促进了漆酶的合成,同时也增强了漆酶这种胞外酶在细胞外环境中的稳定性.
3 结束语
(1)通过对野外采集的菌种进行初始培养,分离纯化后获得纯菌株.将纯菌株在初筛的愈创木酚平板中培养,挑选出变色反应明显,且变色圈大于菌丝圈的菌株.对初筛获得的菌株经过复筛,得到产漆酶能力较强的菌株.通过对菌丝形态的显微镜观察,可以初步认为筛选得到的菌株为白腐菌.
(2)对菌株进行液体培养发现,振荡培养对菌株产漆酶要优于静止培养,当温度为28~35 ℃,转速为140 r·min-1,培养基础初始pH为5,诱导剂CuSO4加入量为0.5 mmol·L-1最有利于菌株产漆酶,可以作为液体培养的最佳条件.
[1] 李海涛,姚 开,贾冬英,等.木质素含量的检测方法[J].皮革科学与工程,2011,21(2):31-34.
[2] 王宜磊,孙 旭,邓振旭.木素生物降解研究进展[J].微生物学杂志,1998,18(1):48-51.
[3] 李慧蓉.白腐真菌生物学和生物技术[M].北京:化学工业出版社,2005.
[4] Kishi K,Hildebrand D.P.,Kusters-van Someren M.,et al.Site-directed mutations at phenylalanine -190 of manganese peroxidase: Effects on stability,function and coordination[J].Biochemistry,1997,36(14):4 268-4 277.
[5] 郭仁妹.漆酶及其固定化[D].上海:东华大学,2009.
[6] Nishida T,Kashino Y,Mimura A,et al.Lignin biodegra-dation by wood rottingfungi,I screening of lignin-de-grading fungi[J].Mokuzai Gakkaishi,1988,34(6):530-536.
[7] Ander P,Eriksson K E.Bacterial degradation of lignin[J].J of General Microbiol,1976,109:1-8.
[8] 龚国利,陈志萱,陈 松,等.高产漆酶白腐真菌的分离和鉴别[J].陕西科技大学学报,2012,30(6):79-83.
[9] Cai L,Yin J F,Yang L P,et al.Several qualitative methods for the screening of fungi to decompose lignin[J].Microbiology,2002,29(1):67-69.
[10] Edens W A,G T Q,Dooley D,et al. Purification and characterization of a secreted laccase of Gaeumannomyces graminis Var.tritici[J].Appl Environ Microbiol,1999,65(7):3 701-3 704.
[11] Alexandre G,Zhulin I B.Laccase are widespread in bacteria[J].Trends in Biotechnology,2000,18(2):41-42.
[12] Baldrain P,Gabriel J.Gopperand cadmium increase laccase activity in peurotus ostreatus[J].Fems Microbiol Lett, 2002,206(1):69-75.

