左氧氟沙星的超声/H2O2联合降解研究
魏 红 ,李 娟 ,李克斌 ,胡 妲
(1.西安理工大学西北水资源与环境生态教育部重点实验室,陕西 西安710048;2.西北大学化学与材料科学学院/合成与天然功能分子化学教育部重点实验室,陕西 西安 710069)
近年来环境中抗生素类药物的残留受到学术界的高度关注.欧美国家对水体中抗生素的检测表明,环境样品中抗生素的检出率和检出种类呈增加的趋势,有专家估计抗生素等药物对环境的危害己接近于农药[1].研究表明,污水处理厂是抗生素污染的主要受纳体,即使污水处理设施十分完善的发达国家,污水处理厂对抗生素类药物的去除率仍较低[2-3].如美国 4家污水厂中,氧氟沙星和诺氟沙星的平均质量浓度分别为470ng/L和 400ng/L,最高达到 1000ng/L.陈涛等[4]对广州污水厂抗生素的污染特征研究表明,某些抗生素存在负去除现象.因此研究抗生素污染水体的治理新技术具有重要意义.
氟喹诺酮类抗生素(FQs)因抗菌谱广、使用方便等特点,广泛用于人类医疗及集约化畜牧养殖[5].由于分子中喹诺酮环较强的化学稳定性,因此氟喹诺酮类抗生素成为水环境中常常被检出的新兴污染物[6-10].高级氧化技术(AOPs)是处理顽固性有机污染物的有效手段,是水污染控制工程领域的研究热点.超声辐射是一种相对较新的AOPs水处理技术.研究表明超声化学对废水中某些有毒难降解有机污染物有显著的降解作用[11-12],但对亲水性、难挥发物质的降解效率极低[13].有学者尝试将超声与氧化剂结合来提高污染物的降解效率[14], 如超声/臭氧、超声/Fenton's试剂等.目前超声降解抗生素类新型污染物的研究国内外少见报道[15].本文以左氧氟沙星为研究对象,考察超声/H2O2对左氧氟沙星的催化降解效果,探讨反应的影响因素,并对超声降解产物进行一定分析,为新型污染物的去除提供参考.
1 材料与方法
1.1 实验材料
30% H2O2(分析纯,天津市天力化学试剂有限公司);氢氧化钠,盐酸(分析纯,天津傲然精细化工研究所);乙腈(色谱纯);超纯水.左氧氟沙星(新昌制药厂,纯度大于 99%),分子式: C18H20FN3O4,分子量为361.37.
1.2 实验仪器
pHs-25数显酸度计(上海虹益仪器仪表有限公司)配E-201-C-9型pH复合电极(上海罗素科技);JY92-Ⅱ超声波细胞粉碎机(配备直径8mm的钛探头,上海比朗仪器有限公司);Aglient1200液相色谱仪,配备G1311A四元泵,柱温箱30℃,G1314C XL可变波长紫外检测器.
1.3 实验方法
1.3.1 左旋氧氟沙星的超声降解实验 准确移取一定体积浓度为 250mg/L的左氧氟沙星溶液至100mL容量瓶,加入一定量H2O2,用1mol/L的NaOH 或 H2SO4溶液调节 pH 值,定容,转移到250mL烧杯(d=80mm)中. 然后,将钛探针插入溶液,探针浸泡深度约 1cm,钛脉冲(on/off)为 1s/1s,在标准大气压和避光下超声处理,每隔一定时间取样,用HPLC分析溶液中左氧氟沙星的浓度.左氧氟沙星的降解率按照式(1)计算:
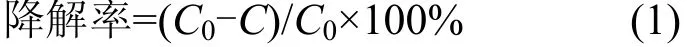
式中:C0和C分别为0和t时刻左氧氟沙星的浓度, mg/L.
1.3.2 左氧氟沙星的 HPLC分析 左氧氟沙星浓度通过Agilent l200高效液相色谱仪分析,采用外标法定量.色谱分离条件为色谱柱:Eclipse XDB-C18(150mm×4.6mm,5µm);流动相为乙腈:甲酸水溶液(0.2 %)=20:80;检测波长 290nm;流速为0.2mL/min;进样量为10μL;柱温30℃.
2 结果与讨论
2.1 不同实验条件下左氧氟沙星的降解
考察了pH 7.14,左氧氟沙星浓度为20mg/L,在H2O2单独氧化、直接超声和超声/H2O23种条件下的降解(图1).其中,超声功率为195W.
由图1可以看出,与直接超声、H2O2单独氧化相比,超声/H2O2对左氧氟沙星具有明显的协同降解作用.反应 240min,直接超声、H2O2单独氧化的降解率分别为1.88%和6.74%;超声/H2O2对左氧氟沙星的降解率提高到66.26%.
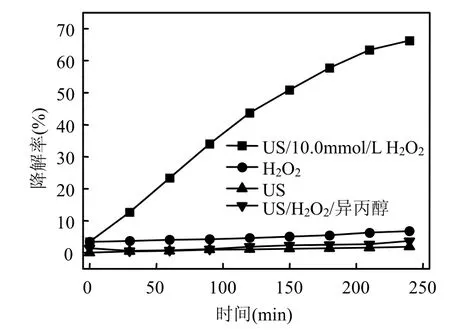
图1 不同实验条件下左氧氟沙星的降解效果Fig.1 Levofloxacin degradation under different experimental conditions
一般认为超声降解是形成超声空化,即空化泡中的热解反应和液相媒介和气液界面的·OH氧化.左氧氟沙星直接超声时,体系中H2O分解产生的·OH非常少,并且产生的·OH只有 10%左右能够进入液相主体参与反应[11].因此左氧氟沙星直接超声的降解率非常低.
H2O2是强氧化剂,其标准氧化还原电位在pH为0和14时,分别为1.80,0.87V.柳闽生等[16]通过循环伏安法研究发现氧氟沙星盐酸溶液在Epa=1.02V处存在不可逆氧化峰.从热力学分析,H2O2能够与左氧氟沙星发生氧化还原反应,因此加入 H2O2直接引起左氧氟沙星的降解,但反应受到反应条件、动力学等因素的影响,本实验条件下H2O2对左氧氟沙星的氧化分解有限.
超声/H2O2体系增强了左氧氟沙星的降解,这主要是因为超声促进了 H2O2的分解[(式 2)],体系中·OH产生量增加. ·OH是强氧化性物种(标准氧化还原电位为 2.8V),能够与许多有机物以近似扩散的速率发生反应,因此加快和提高了药物的超声降解[17-18].
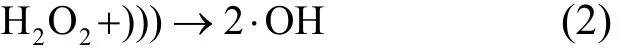
向超声/H2O2体系中加入自由基清除剂—异丙醇后,超声 240min,左氧氟沙星的降解率降低为 3.67%.由此进一步说明,左氧氟沙星的超声降解主要是以·OH自由基的氧化反应为主.
2.2 H2O2添加浓度的影响
考察了pH 7.14,左氧氟沙星浓度为20mg/L,超声功率为 195W, H2O2添加浓度在 3.0~20.0mmol/L范围对超声/H2O2体系降解左氧氟沙星的影响(图2).
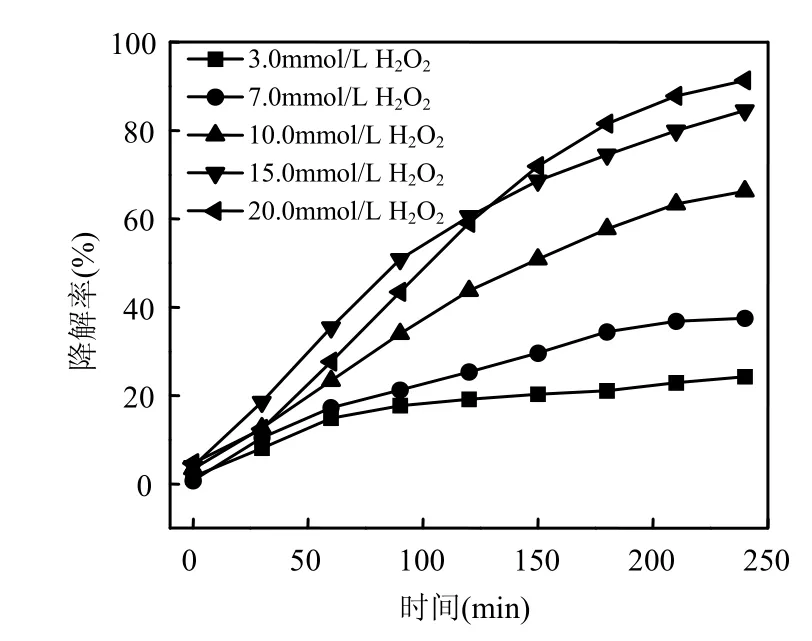
图2 H2O2添加浓度对左氧氟沙星降解效果的影响Fig.2 Effect of H2O2 adding concentration on levofloxacin degradation efficiency
由图2可以看出,反应240min,超声/H2O2对左氧氟沙星的降解效率随H2O2添加浓度的增加而增加. H2O2添加浓度为 3.0, 7.0, 10.0, 15.0,20.0mmol/L时,左氧氟沙星的降解率分别为24.26%, 37.46%, 66.26%, 84.47%, 91.25%.反应前120min, H2O2添加浓度从15.0mmol/L增加到20.0mmol/L时,降解率有所降低.这有可能是因为 H2O2本身是·OH 的捕获剂[式(3)],同时生成HO2·, HO2·的氧化性比·OH 弱[式(4)][19].
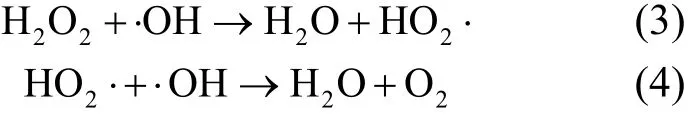
2.3 超声功率的影响
考察了左氧氟沙星溶液浓度为 20mg/L,pH 7.14,H2O2添加浓度为15.0mmol/L,超声功率分别为195, 260, 325W时,左氧氟沙星的超声降解,结果如图3所示.
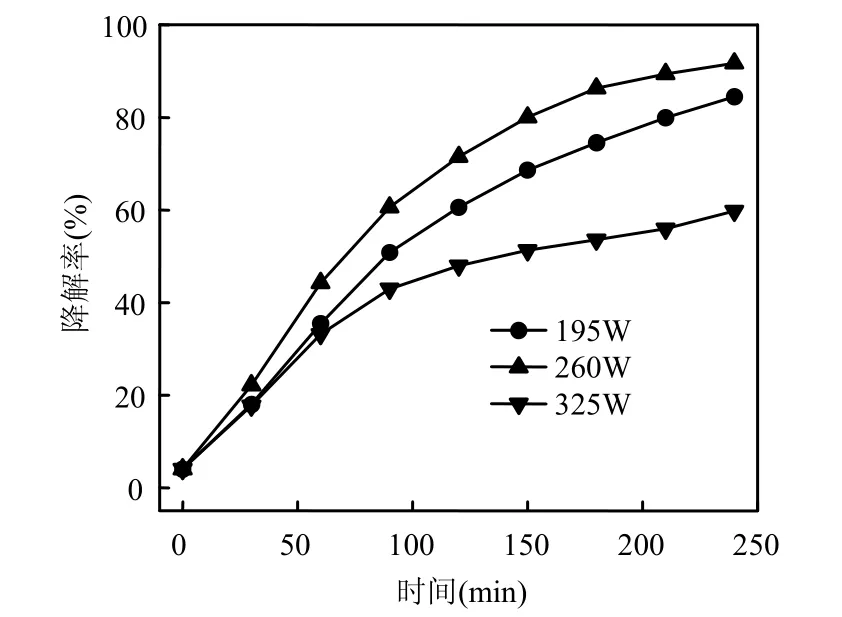
图3 超声功率对左氧氟沙星降解效果的影响Fig.3 Effect of ultrasonic power on levofloxacin degradation efficiency
由图3可以看出,功率从195W增加到260W,左旋氧氟沙星的降解率随之升高,240min的降解率从 84.47%增加到 91.68%;功率继续增加到325W,降解率反而降低,240min的降解率为59.80%.一般认为,超声功率增加,声能密度增加,空化程度也随之增强,空化泡内的温度、压力相应提高,物理化学环境对有机污染物的降解有利[20].功率继续升高,数量、尺寸都增加的空化泡将吸收和分散声波,反而使系统能利用的声场能量降低[21], 所以超声功率存在适宜值.
2.4 pH值的影响
考察了左氧氟沙星浓度为20mg/L, H2O2添加浓度为 15.0mmol/L,超声功率 260W,采用1.0mol/L的H2SO4和NaOH溶液调节体系pH值分别为3.00, 5.00, 9.00和11.00,以及7.14时, 左氧氟沙星的超声降解情况(图4):
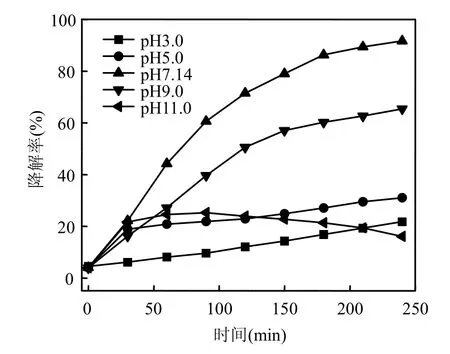
图4 pH值对超声/H2O2降解左氧氟沙星的影响Fig.4 Effect of pH value on levofloxacin degradation by ultrasonic/H2O2 system
由图4可以看出,溶液初始pH值对左氧氟沙星的降解具有明显的影响,pH值分别为 3.00,5.00, 7.14, 9.00和11.00时,降解240min,左氧氟沙星的降解率分别为 21.73%, 31.04%, 91.68%,65.4%和16.05%. pH值在3.00~7.14范围,降解率随着pH值的升高而增加.继续增加pH值到11.00,降解率大幅度降低.
溶液初始 pH值对有机污染物的超声降解影响非常复杂.首先,从H2O2的角度分析,H2O2的氧化电位在酸性介质较碱性介质强,但是超声/H2O2体系中,H+对·OH 的捕获作用非常重要[22][(式 5)].导致pH3.00时左氧氟沙星的降解率低.
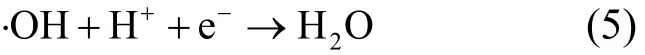
碱性溶液中,H2O2自身分解速率升高[(式6)],可利用的 H2O2量减少,进而降低超声/H2O2体系中·OH 的产量.而且在碱性溶液中,[式(7)]~[式(10)]反应会进一步消耗H2O2和·OH的量,生成的O2-和 HO2·较·OH 的氧化性要弱得多.所以 pH 11.00时左氧氟沙星的降解率也较低.
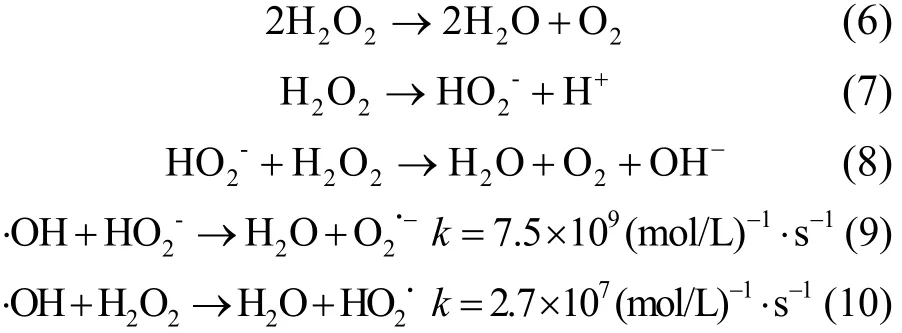
溶液pH值对左氧氟沙星的形态和溶解行为也有一定影响.左氧氟沙星为两性离子,其 pKa1和 pKa2分别为 5.7和 7.9.pH<5.7或 pH>7.9时,左氧氟沙星主要以阳离子或阴离子形式存在;pH值在5.7~7.9之间,以中性分子存在的左氧氟沙星容易吸附在空化泡界面,更容易受到·OH的进攻.所以pH7.14效果最佳.采用一级反应动力学对左氧氟沙星浓度为 20mg/L, H2O2添加浓度为15.0mmol/L,超声功率260W,不同pH值下氧氟沙星的降解过程进行拟合.一级反应速率常数k与左氧氟沙星的形态分布关系见图5.从图5可见,反应速率常数k随pH值的改变趋势与中性或两性离子的分布相似,表明左氧氟沙星中性或两性离子形式更易于超声降解,其降解速率远大于阳离子和阴离子形态的左氧氟沙星.
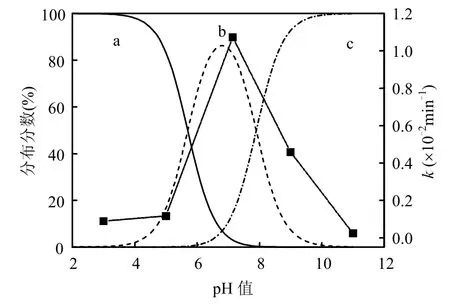
图5 反应速率常数k与左氧氟沙星形态分布的关系Fig.5 The relationship between k and chemical structure forms of levofloxacin at different pH value
2.5 左氧氟沙星初始浓度的影响
H2O2添加浓度为 15.0mmol/L,超声功率为260W,pH 7.14,左氧氟沙星初始浓度分别为 10,20,30mg/L超声降解情况如图6所示.
左氧氟沙星的初始浓度为10,20,30mg/L时,超声 240min,降解率依次为 67.82%,91.68%和73.18%,20mg/L时降解率达到最高;降解量随初始浓度的升高而增加,依次为 6.782,18.336,21.54mg/L.与超声降解 K-2BP 的结果一致[23].超声降解有机污染物主要是热解和液相媒介、气液界面的·OH 氧化,左氧氟沙星不易挥发,很难进入空化泡,不存在空化泡内的热解,结合上述pH值的影响分析,作者认为左氧氟沙星主要在空化泡界面进行分解.空化条件一定,体系中·OH的产生量一定,溶液中左氧氟沙星的量随着初始浓度的增加而增加,降解量也随之增加.
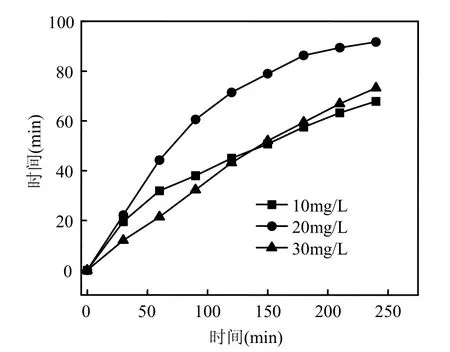
图6 左氧氟沙星初始浓度对其超声降解效果的影响Fig.6 Effect of levofloxacin initial concentration on its ultrasonic degradation
图7 超声/H2O2降解左氧氟沙星的HPLC谱图变化Fig.7 HPLC spectrum change of levofloxacin degradation by ultrasonic/H2O2 system
2.6 超声/H2O2降解左氧氟沙星的产物分析
图 7为实验条件下,左氧氟沙星初始浓度为20mg/L, pH 7.14, H2O2添加浓度为10.0mmol/L,超声功率195W时,超声/H2O2降解左氧氟沙星的HPLC图随时间的变化情况.
由图7可以看出,在本实验HPLC分析条件下,左氧氟沙星的保留时间tR=9.998min (图6),随着反应的进行,tR=9.998min的谱峰面积逐渐减小,说明左氧氟沙星得到降解;主要出现 2个新的产物峰,对应tR分别为6.823min和13.048min.体系加入H2O2,tR= 6.823min的产物直接生成.
考察了pH值对超声/H2O2降解左氧氟沙星HPLC谱图的影响,图 8为左氧氟沙星初始浓度为 20mg/L, pH 7.14, H2O2添加浓度为 10.0 mmol/L, 超声功率195W, pH值分别为3.00, 5.00,7.14, 9.00和11.00时,超声/H2O2降解左氧氟沙星前5min HPLC图的变化情况.
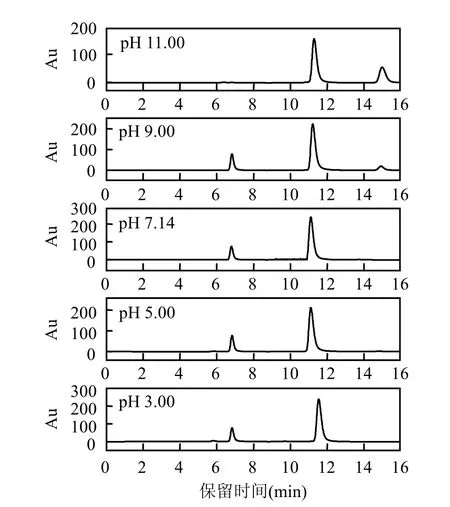
图8 不同pH值对左氧氟沙星HPLC谱图的影响Fig.8 Effect of pH value on the HPLC spectrum of levofloxacin
由图8可以看出, pH 3.00~7.14,主要生成tR=6.823min的产物; pH 9.00时,同时有2种产物生成; pH 11.00时,只有tR=13.048min的产物.说明pH值对超声/H2O2降解左氧氟沙星的产物分布形态有一定影响.
3 结论
3.1 与单独超声、H2O2氧化相比, 超声/H2O2能够有效催化降解左氧氟沙星, H2O2添加浓度在3.0~20.0mmol/L范围,左氧氟沙星的降解率随其添加浓度的增加而增加,240mm降解率达到91.25%.
3.2 超声功率为260W时,左旋氧氟沙星的降解率达到最高;左氧氟沙星的降解量随着初始浓度的增加而增加.
3.3 pH值对左氧氟沙星的降解率和产物的生成和分布具有显著的影响.一级反应速率常数k与左氧氟沙星中性或两性离子形式分布一致.
[1] Ternes T A, Joss A, Siegrist H. Scrutinizing pharmaceuticals and personal care products in wastewater treatment [J]. Environmental Science and Technology, 2004,38:392A-399A.
[2] Karthikeyan K G, Meyer M T. Occurrence of antibiotics in wastewater treatment facilities in Wisconsin USA [J]. Science of the Total Environment, 2006,361(1):196-207.
[3] Chen Y, Zhang H B, Luo Y M, et al. Occurrence and dissipation of veterinary antibiotics in two typical swine wastewater treatment systems in east China [J]. Environ. Monit. Assess.,2012,184:2205-2217.
[4] 陈 涛,李彦文,莫测辉.广州污水厂磺胺和喹诺酮抗生素污染特征研究 [J]. 环境科学与技术, 2010,33(6):144-147.
[5] Kools S A E, Moltmann J F, Knacker T. Estimating the use of veterinary medicines in the European union [J]. Regulatory Toxicology and Pharmacology, 2008,50:59-65.
[6] Calamari D, Zuccato E, Castiglioni S, et al. Strategic survey of therapeutic drugs in the rivers Po and Lambro in nothern Italy [J].Environmental Science and Technology, 2003,37:1241-1248.
[7] Pena A, Chmielova D, Lino C M, et al. Determination of fluoroquinolone antibiotics in surface waters from Mondego river by high performance liquid chromatography using a monolithic column [J]. Journal of Separation Science, 2007,30:2924-2928.
[8] Peng X Z, Tan J H, Tang C M, et al. Multiresidue determination of fluoroquinolone, sulfonamide, trimethoprim, and chloramphenicol antibiotics in urban waters in China [J]. Environ.Toxicol. Chem., 2008,27:73-79.
[9] Sturini M, Speltini A, Pretali L. Solidphase extraction and HPLC determination of fluoroquinolones in surface waters [J]. Journal of Separation Science,2009,32:3020-3028.
[10] Ye Z, Weinberg H S. Trace analysis of trimethoprim and sulfonamide, macrolide, quinolone, and tetracycline antibiotics in chlorinated drinking water using liquid chromatography electrospray tandem mass spectrometry [J]. Analytical Chemistry,2007,79:1135-1144.
[11] Song W H, Armah A, Cruz D L, et al. Ultrasonically induced degradation of microcystin-LR and RR: identification of products,effect of pH, formation and destruction of peroxides [J]. Environ.Sci. Technol., 2006,40,3941-3946.
[12] Song Y L, Li J T. Degradation of C.I. direct black 168 from aqueous solution by fly ash/H2O2combining ultrasound [J].Ultrasonics Sonochemistry, 2009,16:440-444.
[13] Mahamuni N N, Pandit A B. Effect of additives on ultrasonic degradation of phenol [J]. Ultrasonics Sonochemistry, 2006,13:165-174.
[14] 常 海,吕效平.超声降解四氯化碳与甲基橙混合废水的研究[J]. 高校化学工程学报, 2011,25(1):155-160.
[15] Maria K, Dionissios M, Despo K. Removal of residual pharmaceuticals from aqueous systems by advanced oxidation processes [J]. Environment International, 2009,35:402-417.
[16] 柳闽生,何凤云,曹小华,等.氧氟沙星光谱性质及其在碳糊电极上的电化学行为研究 [J]. 江西师范大学学报(自然科学版),2011, 35:187-189
[17] Teo K C, Xu Y R, Yang C. Sonochemical degradation for toxic halogenated organic compounds [J]. Ultrason. Sonochem.,2001,8:241-246.
[18] Iordachel I, Nechita M T, Aelenei N, et al. Sonochemical enhancement of cyanide ion degradation from wastewater in the presence of hydrogen peroxide [J]. Polish J. Environ. Stud.,2003,12:735-737.
[19] Akshaykumar K S, Parag R G. Parathion in aqueous solutions:Intensification using additives and scale up aspects [J]. Separation and Purification Technology, 2011,79:1-7.
[20] Reddy E P, Sun B, Smimitis P G. Transition metal modified TiO2-loaded MCM-41 catalysts for visible- and UV-Light driven photodegradation of aqueous organic pollutants [J]. J. Phys.Chem.B., 2004,108:17198-17205.
[21] Hartmann J, Bartels P, Mau U, et al. Degradation of the drug diclofenac in water by sonolysis in presence of catalysts [J].Chemosphere, 2008,70:453-461.
[22] Huang Y H, Huang Y F, Huang C I, et al. Efficient decolorization of azo dye Reactive Black B involving aromatic fragment degradation in buffered Co2+/PMS oxidative processes with a ppb level dosage of Co2+-catalyst [J]. J. Hazard. Mater., 2009,170:1110-1118.
[23] Wang J G, Wang X K, Guo P Q, et al. Degradation of reactive brilliant red K-2BP in aqueous solution using swirling jet-induced cavitation combined with H2O2[J]. Ultrasonics Sonochemistry,2011,18:494-500.

