N-acetylserotonin对肝缺血再灌注小鼠氧化应激损伤的保护作用
史才兴 杜晓东 姜政辰 于树娜 李 进 蒋吉英
(潍坊医学院人体解剖学教研室;1潍坊医学院,山东261053)
脂质过氧化反应在缺血再灌注损伤、心脑血管病和衰老等多种疾病中起重要作用[1-6],N-acetylserotonin(NAS)可减轻铁、铜、H2O2等多种物质诱导的肝脏、心脏、脑、视网膜、红细胞及淋巴细胞等的脂质过氧化反应[7-11],但其对肝缺血再灌注损伤的作用尚未见报道。因此,本研究采用肝缺血再灌注损伤的动物模型,探讨NAS对肝缺血/缺氧损伤脂质过氧化反应的影响,以明确NAS可通过影响自由基的代谢对肝缺血再灌注损伤产生保护作用,为NAS的临床应用提供理论依据。
材料和方法
1.实验动物及主要试剂
健康雄性成年昆明小鼠24只.购于潍坊医学院实验动物中心,体重18-20g。NAS和 Luzindole(Luz)购自Sigma公司。谷丙转氨酶(Alanine aminotransferase,ALT)、丙二醛(Maleic dialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)测定试剂盒均由南京建成生物工程研究所提供。
2.动物分组、模型制备及药物预处理
随机将24只小鼠分成缺血再灌注损伤组(I/R组)、NAS组、NAS+Luz组及假手术组(Sham组),每组6只。小鼠术前禁食12h,自由饮水。用1%戊巴比妥钠40mg/kg腹腔注射麻醉,上腹部正中切口,游离肝门血管,无创血管夹夹闭门静脉和肝固有动脉,制造肝脏缺血再灌注模型,肝的颜色由红色变为暗紫红色,表明模型制作成功。在30min后去除血管夹复流,形成再灌注。NAS组在造模前30min腹腔注射10mg/kg NAS,然后处理同缺血再灌注损伤组。NAS+Luz组在给予NAS前30min腹腔注射50mg/kg Luz。假手术组仅行麻醉、开腹分离肝蒂,但不阻断肝血流。
我们在预实验中观察了肝缺血30min,再灌注第30min、1h、2h、6h、12h、24h等时间点肝组织的形态和功能改变,结果发现再灌注6h时肝细胞索受压、肝细胞出现灶性坏死、大量中性粒细胞浸润;血清ALT水平达高峰,说明此时肝脏的组织损伤最明显,这与以往的研究结果相似[6]。因此,我们选择缺血30min、再灌注6h进行实验。
3.标本采集及检测方法
再灌注后第6h,处死小鼠,心脏采血,室温静置20min后4000r/min离心5min后取血清,-70℃保存。心脏采血后,立即切取肝组织,一部分组织-70℃保存,待测组织中 MDA、SOD、GSH-Px的含量。另一部分组织置于4g/l多聚甲醛固定,30%蔗糖沉底过夜,冰冻切片(厚9μm),常规HE染色,光镜下观察细胞形态的变化。
按试剂盒说明书操作,取肝组织用冰冷的生理盐水漂洗,拭干、称重,剪碎、研磨制备组织匀浆,3000r/min离心10min,留上清。比色法检测血清中ALT水平及肝组织匀浆中 MDA、SOD、GSH-Px的含量。
4.统计学处理
所有数据以均数±标准差(¯x±s)表示,采用SPSS11.0统计软件对结果进行分析,检验水准α=0.05。
结 果
1.NAS对缺血再灌注后肝细胞形态和功能的影响
I/R组肝细胞排列紊乱,部分肝索、肝血窦分界不清,肝细胞浆疏松化,并可见局灶性坏死,汇管区可见大量炎细胞浸润。NAS组肝组织损伤明显减轻,仅见散在肝细胞疏松化,点状坏死,汇管区可见少量炎细胞浸润。Luz可拮抗NAS的作用,使肝细胞坏死的区域和炎细胞浸润的程度较NAS组加重(图1)。
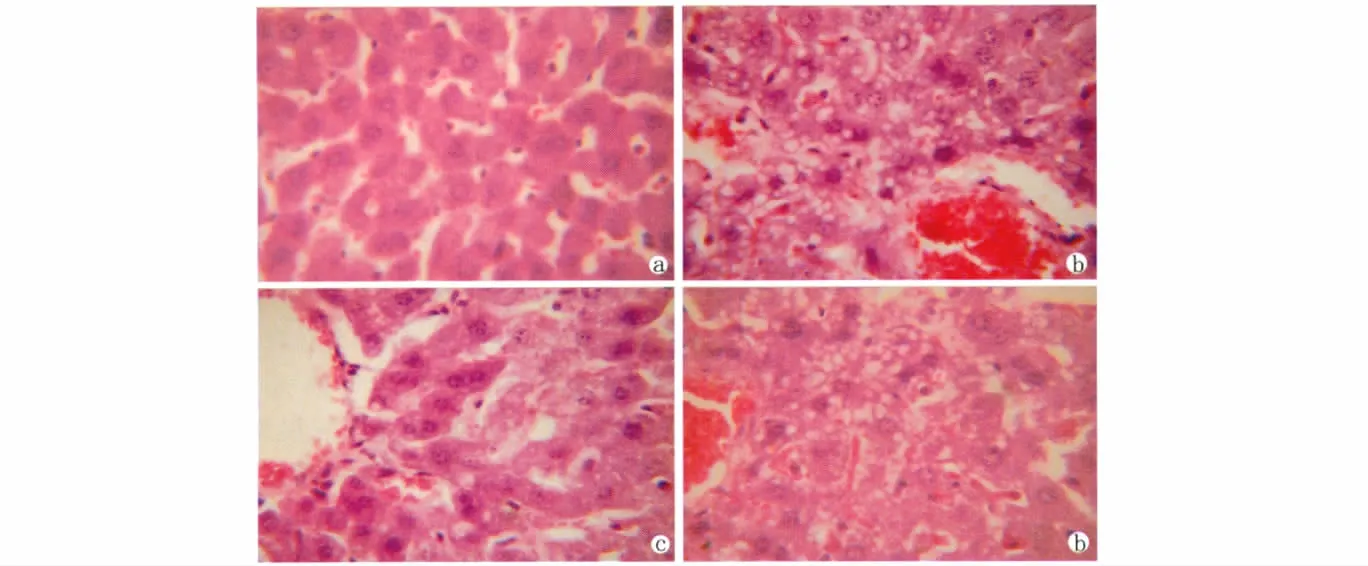
图1 NAS能减轻缺血再灌注损伤所引起的肝细胞的形态改变.(a:假手术组;b:缺血再灌注组;c:NAS组;d:NAS+Luz组。HE×400)Fig.1NAS alleviate the morphological changes induced by hepatic ischemia reperfusion injury.(a:Sham group;b:I/R group;c:NAS group;d:NAS+Luz group.HE×400)
血清转氨酶升高,在一定程度上反映了肝细胞损害和坏死的程度。在轻、中度肝损伤时,以ALT升高最为明显,因此,本研究以血清ALT水平的高低来衡量肝细胞功能的变化。与Sham组相比,缺血再灌注组ALT水平升高(P<0.01),NAS可减少ALT的释放 (P<0.01),Luz可使之逆转(图2)。
2.NAS对肝组织中SOD、MDA、GSH-Px含量的影响
I/R组SOD和GSH-Px的含量下降,而 MDA含量明显上升,与Sham组比较,差异有显著性(P<0.01);NAS组SOD和GSH-Px的含量明显高于IR组,差异有显著性(P<0.05),而 MDA的含量明显低于IR组,差异有显著性(P<0.01);Luz可拮抗 NAS的作用(图3-5)。
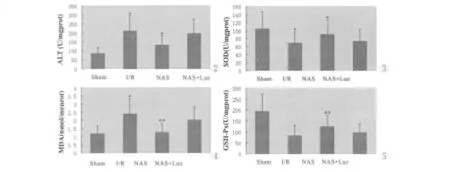
图2 各组血清 ALT水平变化.(P*<0.01,P﹟<0.01)图3 各组肝组织中SOD的含量.(P*<0.01,P﹟<0.05)图4 各组肝组织中 MDA的含量.(P*<0.01,P﹟﹟<0.01)图5 各组肝组织中GSH-Px的含量.(P*<0.01,P﹟﹟<0.01)Fig.2 The changes of ALT level in serum.(P* <0.01,P﹟ <0.01)Fig.3 The changes of SOD content in liver.(P* <0.01,P﹟ <0.05)Fig.4 The changes of MDA content in liver.(P* <0.01,P﹟﹟ <0.01)Fig.5 The changes of GSH-Px content in liver.(P* <0.01,P﹟﹟ <0.01)
讨 论
肝缺血再灌注损伤是肝脏和创伤外科疾病中常见的病理生理过程,其发病机制尚未完全明确,目前认为氧自由基是肝缺血再灌注损伤的重要机制。氧自由基是体内氧分子不完全代谢的产物,主要包括超氧阴离子自由基、羟自由基、单线态氧、过氧化氢以及由此衍生的有机过氧化物自由基和氢过氧化物等。在正常生理状态下,机体代谢过程中产生少量的氧自由基,但立即被氧化分解,不引起细胞毒性作用。肝缺血再灌注损伤时,氧自由基产生增多且清除系统的功能发生障碍,不能将自由基清除,自由基便得以产生损伤作用。线粒体是氧自由基损伤的重要靶器官[12-14]。自由基增多时,可与线粒体膜上的多价不饱和脂肪酸发生脂质过氧化反应,使膜的流动性降低、通透性增加,细胞的完整性及选择性离子渗透功能破坏。另一方面,生物膜的脂质过氧化反应还改变了膜结合蛋白的结构和功能,从而导致细胞凋亡和坏死[15]。因此,寻找更有效的自由基清除剂对于肝缺血再灌注损伤的防治具有重要意义。
氧自由基清除剂SOD和脂质过氧化反应的代谢产物MDA是目前公认反映机体氧化损伤程度的间接指标。NAS是melatonin(Mel)的前体,是松果体分泌的一种吲哚胺类激素。近年来研究表明,NAS不仅是Mel的前体,还是一种自由基清除剂。Leaden PJ等[16]认为,NAS可抑制肝微粒体膜不饱和脂肪酸酶性和非酶性的脂质过氧化反应,且其作用比 Mel强。Calvo JR等[17]证实了NAS在体内对alpha-naphthylisothiocyanate(ANIT)诱导的大鼠肝脏的氧化损伤有保护作用。Stuss M 等[8]发现NAS对LPS诱导的脑、肝、肾等组织脂质过氧化反应有保护作用。Oxenkrug G等[18]发现 NAS可使雄性C57Bl/6J小鼠的寿命延长20%,并证实NAS的抗衰老作用依赖于其抗氧化作用。另有研究证实了NAS对视网膜、心脏、脑、红细胞及淋巴细胞等组织细胞的抗氧化作用[7-11]。
本研究发现,缺血再灌注损伤后肝细胞呈水样变性和局灶性坏死,血清ALT等肝细胞特异性酶水平增高,肝组织中SOD和GSH-Px含量降低,MDA含量增高;给予NAS后,肝组织的结构和功能均有所改善;用Luz拮抗褪黑激素受体1(melatonin receptor 1,MT1)或褪黑激素受体2(melatonin receptor 2,MT2)的作用后,NAS的作用消失,表明肝缺血再灌注损伤后,氧自由基大量产生,从而引发脂质过氧化损伤,同时,SOD和GSH-Px等内源性的抗氧化酶失活或耗尽,引起肝细胞结构和功能破坏,给予NAS预处理可使肝缺血再灌注损伤后血清SOD和GSH-Px含量增加、MDA含量降低,提示NAS可能通过受体途径,增强抗氧化系统的激活程度及减轻抗氧化系统受抑制的程度,发挥对肝缺血再灌注损伤的保护作用。
[1]Keshari KR,Kurhanewicz J,Bok R,et al.Hyperpolarized 13Cdehydroascorbate as an endogenous redox sensor for in vivo metabolic imaging.Proc Natl Acad Sci U S A,2011,108(46):18606-18611
[2]Romano AD,Serviddio G,de Matthaeis A,et al.Oxidative stress and aging.J Nephrol,2010,15:S29-36
[3]Tang D,Kang R,Zeh HJ 3rd,et al.High-mobility group box 1,oxidative stress,and disease.Antioxid Redox Signal,2011,14(7):1315-1335
[4]Kusaka J,Koga H,Hagiwara S,et al.Age-dependent responses to renal ischemia-reperfusion injury.J Surg Res,2012,172(1):153-158
[5]Petrosillo G,Moro N,Paradies V,et al.Increased susceptibility to Ca(2+ )-induced permeability transition and to cytochrome c release in rat heart mitochondria with aging:effect of melatonin.J Pineal Res,2010,48(4):340-346
[6]Davies SS,Traustadóttir T,Stock AA,et al.Roberts LJ 2nd.Ischemia/reperfusion unveils impaired capacity of older adults to restrain oxidative insult.Free Radic Biol Med,2009,47(7):1014-1018
[7]Sadowska-Woda I,Wójcik N,Karowicz-Bilińska A,et al.Effect of selected antioxidants in beta-cyfluthrin-induced oxidative stress in human erythrocytes in vitro.Toxicol In Vitro,2010,24(3):879-884
[8]Stuss M,Wiktorska JA,Sewerynek E.N-acetylseroto-nin reduces lipopolysaccharide-induced lipid peroxidation in vitro more effectively than melatonin.Neuro Endocrinol Lett,2010,31(4):489-496
[9]Tang GY,Ip AK,Siu AW.Pinoline and N-acetylserotonin reduce glutamate-induced lipid peroxidation in retinal homogenates.Neurosci Lett,2007,412(3):191-194
[10]Requintina PJ,Oxenkrug GF.Differential effects of lipopolysaccharide on lipid peroxidation in F344N,SHR rats and BALB/c mice,and protection of melatonin and NAS against its toxicity.Ann N Y Acad Sci,2003,993:325-333
[11]Wölfler A,Abuja PM,Schauenstein K,et al.N-acetylserotonin is a better extra-and intracellular antioxidant than melatonin.FEBS Lett,1999,449(2-3):206-210
[12]González-Salazar A,Molina-Jijón E,Correa F,et al.Curcumin protects from cardiac reperfusion damage by attenuation of oxidant stress and mitochondrial dysfunction.Cardiovasc Toxicol,2011,11(4):357-364
[13]Petrosillo G,Colantuono G,Moro N,et al.Melatonin protects against heart ischemia-reperfusion injury by inhibiting mitochondrial permeability transition pore opening.Am J Physiol Heart Circ Physiol,2009,297(4):H1487-493
[14]Fink MP,Macias CA,Xiao J,et al.Wipf P.Hemigramicidin-TEMPO conjugates:novel mitochondriatargeted antioxidants.Crit Care Med,2007,35(9Suppl):S461-467
[15]Gavazza M,CataláA.Relative efficacies of alpha-tocopherol,N-acetyl-serotonin,and melatonin in reducing non-enzymatic lipid peroxidation of rat testicular microsomes and mitochondria. Mol Cell Biochem,2009,321(1-2):37-43
[16]Leaden PJ,CataláA.Melatonin and N-acetyl serotonin inhibit selectively enzymatic and non-enzymatic lipid peroxidation of rat liver microsomes.Prostaglandins Leukot Essent Fatty Acids,2007,77(1):29-35
[17]Calvo JR,Reiter RJ,García JJ,et al.Characterization of the protective effects of melatonin and related indoles against alpha-naphthylisothiocyanate-induced liver injury in rats.Karbownik M,2001,80(4):461-470
[18]Oxenkrug G,Requintina P,Bachurin S.Antioxidant and antiaging activity of N-acetylserotonin and melatonin in the in vivo models.Ann N Y Acad Sci,2001,939:190-199

