奥美沙坦减轻高脂饮食诱导的非酒精性脂肪肝病的机制研究
许仁帆 杨思思 曾月霞 牛慧琴 张木勋
(华中科技大学同济医学院附属同济医院内分泌科,武汉430030)
非酒精性脂肪肝病(NAFLD)在发达国家是最常见的肝脏病理改变,与肥胖、糖尿病和代谢综合症密切联系[1]。NAFLD是一个广泛的疾病谱,发病率约为10-20%,包括单纯脂肪变和非酒精性肝炎(NASH),并可以进展为肝硬化和肝细胞性肝癌[2]。单纯的脂肪变进展为NASH的具体机制并不十分明确,其中最主要学说为“二次打击”学说[3,4]。第一次打击为代谢失衡,如胰岛素抵抗(IR),从而导致过量甘油三酯在肝细胞中聚集和脂肪变性,第二次打击主要包括氧化应激和炎性因子,如TNF-α,IL-6等炎性因子在促进肝细胞炎性坏死和星状细胞纤维活性中起着重要的作用。
血管紧张素Ⅱ(AngⅡ)为肾素-血管紧张素系统(RAS)的主要肽,其Ⅰ型受体AT1分布在肝细胞、胆管细胞、HSC、成纤维细胞、枯否细胞和血管内皮细胞等[5]。AngⅡ与AT1相互作用,在调节肝脏的细胞生长、炎症和纤维化中起着重要的作用[6]。研究表明,AngⅡ能够产生一些炎性因子,如IL-6,IL-1,TGF-β,TNF-α等[7,8],从而导致炎症反应的发生,且Ang II在多种细胞类型中均能激活前炎性转录因子如 NF-κB[9,10]。奥美沙坦,一种 AngⅡⅠ型受体阻断剂(ARB),在一些研究认为能够减轻NAFLD模型中脂肪变[11],但其具体机制并不十分明确。本实验的目的是探讨奥美沙坦在NAFLD发生发展过程中的保护作用,尤其是对炎症因子的影响。
在本实验中,我们给予小鼠高脂饮食诱导NAFLD模型后,奥美沙坦灌胃8w,观察其对肝脏脂肪变的影响,Real-time PCR检测肝脏炎性因子TNF-α和IL-6mRNA 的表达,并采 用 Western blot方法检测IκB-α、p-IκBα、NF-κB信号通路的活化情况,初步探讨奥美沙坦对NAFLD脂肪变和炎性改变的影响及可能机制。
材料和方法
1.实验材料及试剂
奥美沙坦购自上海三共制药有限公司,辣根过氧化酶偶联羊抗兔IgG抗体和SP试剂盒及DAB显色试剂盒购自武汉博士德生物工程有限公司,蛋白质转印膜PVDF膜 购自Schleicher and Schuell公司,化学发光试剂ECL购自PIERCE公司,抗IκB-α、p-IκBα、β-actin、Lamin B 抗 体 购 自 Santa Cruz公 司,抗 NF-κB p65 抗 体 购 自 Cell Signal Technology公司。逆转录试剂盒、Trizol以及PCR引物购于宝生物工程(大连)有限公司,其余试剂为国产分析纯试剂。
2.实验动物分组及模型构建
7周龄SPF级雄性C57BL/6小鼠,购买自北京华阜康公司。小鼠每笼4只,自由进食和饮水,室温20℃,昼夜交替12h,适应性喂养1w后随机分为高脂组(n=16)和正常饮食组(n=8),高脂组小鼠高脂饮食(含60%的的脂肪)12w后再随机分为高脂饮食对照组(n=8),高脂饮食治疗组(n=8)。正常组(n=8)给予正常饮食以及没有处理的水;高脂饮食对照组(n=8)给予高脂饮食(含60%的脂肪)和未处理的水。高脂饮食治疗组(n=8)给予高脂饮食(含60%的脂肪)并0.75mg/kg的奥美沙坦灌胃8w。分组后每周称量食物摄入量,饮用水量以及体重,8w后处死小鼠。小鼠禁食12h后,眼眶内眦取血1ml,分离血清,全自动生化分析仪测定丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)。小鼠处死后迅速剪开腹腔,观察肝脏形态。取出完整肝脏,部分用OCT包埋剂包埋制作冰冻切片行油红染色,部分用福尔马林固定以备形态学染色,其余标本液氮速冻后置于-80℃冰箱保存备用。
3.组织病理学观察
各组小鼠肝脏用福尔马林固定后石蜡包埋并制成4μm切片,HE染色观察肝脏脂肪变性及炎症变化。采用链霉亲和素-生物素复合物技术SP法检测F4/80表达,具体实验步骤参照试剂盒说明,组化染色阳性呈棕黄色,在每张切片分别随机选取10个高倍镜视野(200×)摄片;计数每个视野内F4/80阳性的细胞数,取其均值作为衡量肝组织内巨噬细胞表达的指标。油红O染色用以检测冰冻切片上的脂肪分布。肝脏脂肪变的分度:0=没有,1=肝细胞脂肪变低于33%,2=肝细胞脂肪变为33%-66%,3=肝细胞脂肪变大于66%,光镜下观察结果[12]。
4.肝脏甘油三酯含量检测
称取100mg肝脏组织标本加入1ml氯仿/甲醇(2∶1)混合液中,1500r/min 电动匀浆器匀浆5min,制备10%的肝组织匀浆。匀浆移入干净试管中,在室温下摇动过夜,然后加入1ml 0.6%的氯化钠混匀,2000r/min离心15min分离有机相和无机相,底层的氯仿层小心移入玻璃管,用氮气吹干后再溶于适量乙醇中,用甘油三酯测定试剂盒(南京建成)测出甘油三酯含量。
5.实时荧光定量PCR检测肝脏中TNF-α和IL-6mRNA的表达
每只小鼠的肝脏组织均取50mg,按Trizol试剂盒提供的方法,提取总RNA,取RNA溶液用紫外分光光度计测定其纯度和含量,取总RNA 5μg由逆转录试剂盒转录成cDNA。用β-actin基因作为内参,2-△△CT值表示基因相对表达量。TNF-α基因上游引物序列为:5’-TTCCTGATCGTGGCAGGCGC-3’,下游引物序列:5’-CAGCTCCACGCCATTGGCCA-3’。IL-6基因上游引物序列为:5’-AGCGCCTTCGGTCCAGTTGC-3’,下 游 引 物 序 列:5’-TGCCAGTGCCTCTTTGCTGCT-3’。β-actin基因上游引物序列为:5’-AGAGGGAAATCGTGCGTGAC-3’,下 游 引物序列:5’-CAATAGTGATGACCTGGCCGT-3’。
6.Western blot检测
分别提取小鼠肝脏组织的总蛋白和核、浆分离蛋白,用BCA蛋白定量试剂盒测定浓度。每只均提取20μg蛋白质,上样到10%SDS PAGE凝胶电泳,所用转 膜 缓 冲 液 为 Tris HCl 125mmol/L,甘 氨 酸192mmol/L和20%甲醇,在4℃条件下用25V电压维持10h将蛋白质转至PVDF膜上。PVDF膜在含5%脱脂牛奶的TBST缓冲液中封闭2.5h后放入含有IκB-α、p-IκBα、NF-κB p65、β-actin、Lamin B抗体的抗体稀释液中4℃孵育过夜,第二日TBST于室温下洗膜6次,每次10min,加入辣根过氧化物酶(HRP)偶联的二抗(1∶5000),室温下摇动孵育2h,TBST室温下同法洗膜6次,加入ECL试剂显色曝光。最后IBAS图像处理。系统对胶片进行扫描并测定感光区带的感光密度积分处理相对吸光度值(IOD)。
7.统计与分析
所有的数据均用mean±SD表达。各参数之间的差异显著性应用统计软件SPSS13.0进行ANO-VA检验,P<0.05被认为有显著统计学意义。
结 果
1.奥美沙坦对高脂饮食诱导NAFLD肝功能的影响
高脂饮食喂养20w后,与普通饮食组小鼠相比,高脂饮食对照组小鼠饮食量无明显变化,奥美沙坦治疗8w后明显降低高脂饮食小鼠的饮食量。高脂饮食对照组小鼠饮用水量及体重较正常饮食组小鼠明显增加,奥美沙坦治疗8w后明显降低了高脂饮食引起的饮用水量及体重的增加(P<0.05;表1)。高脂饮食对照组小鼠肝功能的ALT、AST数值分别为102±13.4、133±14.6U/L,较正常饮食组小鼠ALT、AST数值43.6±7.1、62.8±8.7U/L明显升高,而奥美沙坦治疗8w后肝功能ALT、AST数值为72.2±10.6、95.6±12U/L,显著降低了高脂饮食诱导的肝功能失常(P<0.05;表1)。

表1 各组小鼠的体重及肝功能Table 1 Physiological parameters of body weigh and liver function in mice
2.奥美沙坦对高脂饮食诱导NAFLD肝脏脂肪变的影响
油红染色显示正常饮食组肝细胞无脂肪变性,偶尔可见散在脂滴。高脂诱导20w后(高脂饮食对照组)小鼠呈现重度脂肪变,特点为弥漫性大小脂肪泡混合存在,以大泡为主。奥美沙坦治疗8w后(高脂饮食治疗组)肝细胞脂肪变明显减轻,多为轻到中度,且脂肪变的面积明显减少(P<0.05;图1A-C)。普通饮食组肝脏甘油三酯的含量为7.37±0.70mg/g,高脂饮食对照组为28.64±2.62mg/g,而高脂饮食治疗组12.63±1.42mg/g,明显减少,差异有统计学意义(P<0.05,图1D)。普通饮食组的脂肪评分为0.13±0.35,高脂饮食对照组的脂肪评分为2.75±0.46,而高脂饮食治疗组的脂肪评分明显减少,为1.63±0.51,差异有统计学意义(P<0.05,图1E)。

图1 奥美沙坦显著改善高脂饮食诱导的肝脏脂肪变。(A-C)各组小鼠肝脏冰冻切片分别行油红O染色(×100)。(A:普通饮食组;B:高脂饮食对照组;C:高脂饮食治疗组。)(D)各组小鼠油红0染色的切片行脂肪变分级。(E)各组小鼠肝脏甘油三酯含量比较。
3.肝脏炎性改变
肝脏HE染色显示,正常组肝组织结构正常,肝窦清晰可见,肝索排列整齐,无明显炎症细胞浸润。高脂饮食对照组小鼠呈现出中到重度的炎症,表现为汇管区和小叶间的大量单核细胞和多核巨细胞聚集,以及局部肝细胞坏死。高脂饮食治疗组炎性病变明显减轻,仅肝小叶少量炎性细胞浸润(图2AC)。免疫组化染色显示,高脂饮食治疗组中F4/80阳性细胞(代表肝巨噬细胞即枯否细胞)的数目明显低于高脂饮食对照组(图2D-G)。
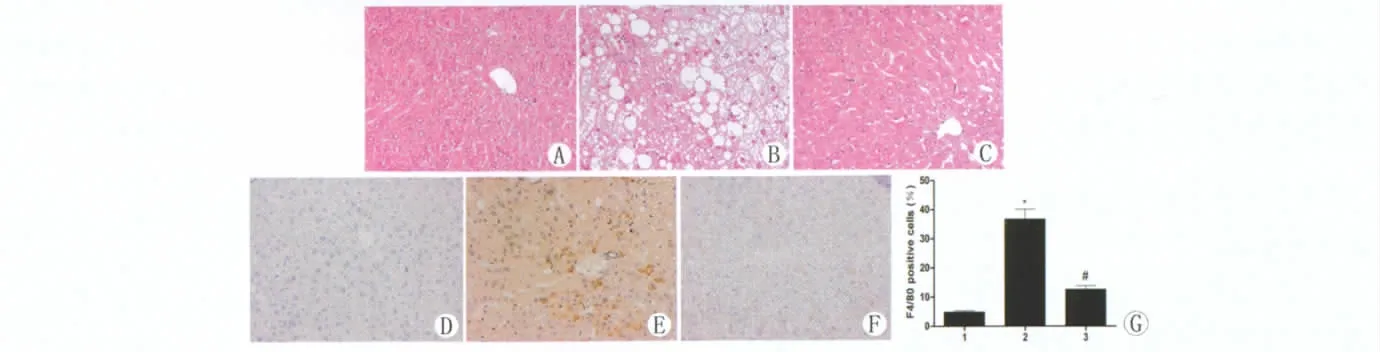
图2 奥美沙坦显著改善HFD诱导的肝脏炎症反应。(A-C)各组小鼠肝脏石蜡切片行HE染色。(D-F)各组小鼠肝脏石蜡切片行免疫组织化学染色(F4/80),显示巨噬细胞表达。(G)各组小鼠免疫反应F4/80阳性细胞计数(A、D:普通饮食组;B、E:高脂饮食对照组;C、F:高脂饮食治疗组。)Fig.2Olmenstartan reduced high fat diet-induced liver inflammation.(A-C)Histological analysis of inflammation in liver HE sections(×200).(D-F)Representative pictures of immunohistochemical detection of F4/80expression in liver from each treatment group(×200).(G)Quantification of F4/80-positive cells in liver of each group.Data are shown as mean± SD (n=8per group).1:normal control diet mice;2:high fat diet control mice;3:high fat diet treatment mice.*P<0.05vs.normal control diet mice;#P<0.05vs.high fat diet control mice.
4.肝组织TNF-αmRNA和IL-6mRNA的表达
实时荧光定量PCR显示,在肝脏中,TNF-αmRNA和IL-6mRNA等促炎症细胞因子的水平在高脂饮食治疗组的相对表达分别为4.21±0.39和1.37±0.10,明显低于高脂饮食对照组,其TNF-αmRNA和IL-6mRNA的相对表达分别为1.88±0.15和2.89±0.25,差异具有统计学意义(P<0.05;图3)。

图3 实时荧光定量PCR检测肝脏炎症因子表达。(A)实时荧光定量PCR检测各组小鼠肝脏中TNF-αmRNA水平。(B)实时荧光定量PCR检测各组小鼠肝脏中IL-6mRNA水平。数据由均数±标准差表示。1:普通饮食组;2:高脂饮食对照组;3:高脂饮食治疗组。*P<0.05与正常组比较,#P<0.05与高脂饮食对照组比较。Fig.3Real-time PCR were performed to evaluate the levels of inflammation factor in liver from each group.(A)Hepatic TNF-αmRNA expression;(B)Hepatic IL-6mRNA expression.The density values were normalized toβ-actin.Data are shown as mean± SD (n=8per group).1:normal control diet mice 2:high fat diet control mice;3:high fat diet treatment mice.*P<0.05vs.normal control diet mice;#P<0.05vs.high fat diet control mice.
5.Western blot 检 测 小 鼠 肝 脏 中IκB-α,p-IκBα,NF-κB p65蛋白的表达水平
与正常饮食组小鼠相比,高脂饮食组小鼠肝脏细胞质中IκB-α蛋白表达明显减少,p-IκBα蛋白表达明显升高(图4A),NF-κB p65在细胞核中表达明显增加(图4B)。奥美沙坦灌胃治疗8w后能够抑制高脂饮食诱导的IκB-α磷酸化和降解,阻抑 NF-κB p65核转位,差异具有统计学意义(P<0.05;图4)。
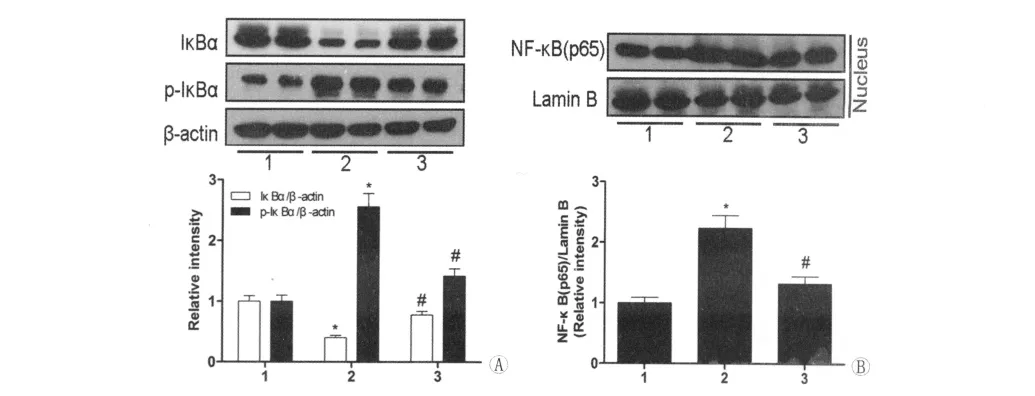
图4 奥美沙坦抑制NF-κB通路蛋白活化。(A)Western blot检测各组小鼠肝脏IκBα和p-IκBα表达水平。(B)Western blot检测各组小鼠肝脏核蛋白NF-κB p65亚单位表达水平。数据由均数±标准差表示。1:普通饮食组;2:高脂饮食对照组;3:高脂饮食治疗组。*P<0.05与正常组比较,#P<0.05与高脂饮食对照组比较。Fig.4Olmenstartan prevents nuclear factor NF-κB activation.(A)Western blot of liver levels of IκBα,p-IκBαfrom each treatment groups.(B)Western blot of nuclear protein levels of NF-κB from each treatment group.Data are shown as mean±SD (n=8per group).1:normal control diet mice;2:high fat diet control mice;3:high fat diet treatment mice.*P<0.05vs.normal control diet mice;#P<0.05vs.high fat diet control mice.
讨 论
炎性因子为NASH“二次打击”学说的重要组成部分,被认为在NASH的发生发展中起着关键作用[2]。本实验的目的是探讨ARB药物,奥美沙坦对于高脂饮食诱导的NAFLD模型炎症反应的影响及相关机制。小鼠在高脂或标准饮食中饲养20w,期间喂食或不喂食奥美沙坦8w,观察奥美沙坦对NAFLD脂肪变和炎症的影响。结果表明奥美沙坦药物能明显减轻肝脏脂肪变的程度、炎症细胞浸润及炎症相关通路活化。炎性因子TNF-α和IL-6 mRNA的表达明显减低,而与其相关的NF-κB通路活化也被抑制。表明奥美沙坦能够减轻NAFLD肝脏炎性改变,从而可能减缓NASH的发生发展。
RAS的活性被认为与NASH的病理进展密切相关。肝脏的RAS通路可能成为NASH治疗的靶向通路。AngⅡ缺乏的小鼠不易由高脂饮食诱导产生脂肪肝,而过量AngⅡ注射能诱导正常小鼠出现脂肪肝,且呈剂量依赖性[13],说明AngⅡ在NASH发生的“第一次打击”脂肪变中起着不可或缺的作用。这与本实验的结论相一致,奥美沙坦治疗的小鼠肝功能(ALT,AST)得到明显改善,且血清TG水平和肝细胞脂肪变明显减轻。
实验表明,奥美沙坦治疗的NAFLD小鼠中,肝脏中TNF-α和IL-6mRNA表达均降低,而目前认为TNF-α和IL-6与全身性和肝脏局部胰岛素抵抗、肝细胞损伤和凋亡、白细胞趋化,以及肝星状细胞激活密切相关[14],而AT1a受体敲除的小鼠肝脏炎症改变减轻[15]。研究表明 NAFLD的患者与正常人相比其TNF-α以及IL-6的血浆表达明显增加,其表达上升的程度与肝脏纤维化的程度呈正相关[16]。因此降低 TNF-α和IL-6的表达在 NASH中起到了重要的作用。
TNF-α和IL-6炎症表达进展的重要的通路为NF-κB通路。NF-κB家族包括五个成员,RelA(P65),C-Rel,Rel B,NF-κB1(P50和它的前体P105)和NF-κB2(P52以及其前体P100)。所有NF-κB成员为二聚体,如异二聚体 RelA/P50,C-Rel/P52与 NF-κB介导的基因活性相关,而同二聚体P50和P52作用为转录抑制蛋白。在静止的细胞中,IκB与至少一个NF-κB的聚合体相结合而抑制NF-κB在细胞核的转导以及与DNA的结合。NF-κB的经典通路为TNF-α激活TNFR1,进一步活化细胞内的IKK复合体(包括催化亚基IKKα,IKKβ和调节性亚基 NEMO)。IKKβ介导IκBα的磷酸化。IκBα被认为是调节NF-κB经典途径的主要IκB蛋白质,IκB降解释放转录因子 NF-κB,使其转位入细胞核,与κB部位相结合,以及激活基因转录[17]。在本实验中,NF-κB和P-IκBα的蛋白表达在高脂饮食对照组明显高于高脂饮食治疗组,而IκBα的蛋白表达在高脂饮食对照组明显低于高脂饮食治疗组。说明在NAFLD,炎症通路NF-κB被激活,而奥美沙坦治疗的NASH小鼠中NF-κB的激活被抑制。
综上所述,实验发现ARB类药物奥美沙坦可以明显的减轻NAFLD小鼠的脂肪变性和炎性改变,为抑制NASH的发生发展提供了可行性。RAS系统在NAFLD治疗中有望成为一个较好的靶点。但由于NAFLD机制复杂,且RAS系统对全身均有作用,故ARB类药物能否作为NAFLD治疗药物还需要进一步的研究。
[1]Fabbrini E,Sullivan S,Klein S.Obesity and nonalcoholic fatty liver disease:biochemical,metabolic,and clinical implications.Hepatology,2010,51:679-689
[2]Tiniakos DG,Vos MB,Brunt EM.Nonalcoholic fatty liver disease:pathology and pathogenesis.Annual review of pathology,2010,5:145-171
[3]Te Sligte K,Bourass I,Sels JP,et al.Non-alcoholic steatohepatitis:review of a growing medical problem.European journal of internal medicine,2004,15:10-21
[4]Edmison J,and McCullough AJ.Pathogenesis of nonalcoholic steatohepatitis:human data.Clinics in liver disease,2007,11:75-104
[5]Wang X,Martindale JL,Liu Y,et al.The cellular response to oxidative stress:influences of mitogen-activated protein kinase signalling pathways on cell survival.The Biochemical journal,1998,333(Pt 2):291-300
[6]Ruiz-Ortega M,Ruperez M.Molecular mechanisms of angiotensin II-induced vascular injury.Current hypertension reports,2003,5:73-79
[7]Nakamura A,Johns EJ,Imaizumi A,et al.Role of angiotensin II-induced cAMP in mesangial TNF-alpha production.Cytokine,2002,19:47-51
[8]Skurk T,van Harmelen V,Hauner H.Angiotensin II stimulates the release of interleukin-6and interleukin-8 from cultured human adipocytes by activation of NF-kappaB.Arteriosclerosis,thrombosis,and vascular biology,2004,24:1199-1203
[9]Ruiz-Ortega M,Lorenzo O,Ruperez M,et al.Angiotensin II activates nuclear transcription factor kappaB through AT(1)and AT(2)in vascular smooth muscle cells: molecular mechanisms. Circulation research,2000,86:1266-1272
[10]Brasier AR,Jamaluddin M,Han Y,et al.Angiotensin II induces gene transcription through cell-type-dependent effects on the nuclear factor-kappaB (NF-kappaB)transcription factor.Molecular and cellular biochemistry,2000,212:155-169
[11]Fujita K,Yoneda M,Wada K,et al.Telmisartan,an angiotensin II type 1receptor blocker,controls progress of nonalcoholic steatohepatitis in rats.Digestive diseases and sciences,2007,52:3455-3464
[12]Brunt EM,Janney CG,Di Bisceglie AM,et al.Nonalcoholic steatohepatitis:aproposal for grading and staging the histological lesions.The American journal of gastroenterology,1999,94:2467-2474
[13]Kim S,Soltani-Bejnood M,Quignard-Boulange A,et al.The adipose renin-angiotensin system modulates systemic markers of insulin sensitivity and activates the intrarenal renin-angiotensin system.Journal of biomedicine & biotechnology,2006,2006:27012
[14]Shoelson SE,Lee J,Goldfine AB.Inflammation and insulin resistance.The Journal of clinical investigation,2006,116:1793-1801
[15]Yang L,Bataller R,Dulyx J,et al.Attenuated hepatic inflammation and fibrosis in angiotensin type 1areceptor deficient mice.Journal of hepatology,2005,43:317-323
[16]Das SK,Balakrishnan V.Role of cytokines in the pathogenesis of non-alcoholic Fatty liver disease.Indian J Clin Biochem,2011,26:202-209
[17]Zheng C,Yin Q,Wu H.Structural studies of NF-kappaB signaling.Cell research,2011,21:183-195

