耐高温小球藻紫外诱变育种及其耐高温性质研究
夏金兰 ,宁进军,陈程浩,万民熙,聂珍媛
(1.中南大学 资源加工与生物工程学院 湖南 长沙,410083;2.中南大学 生物冶金教育部重点实验室,湖南 长沙,410083)
生物柴油是替代化石燃料最有潜力的清洁能源,能有效减少化石燃料造成的温室气体排放[1−2],是应对全球能源危机的有效手段[3]。作为第三代生物能源,微藻生物柴油在许多方面具有和化石燃料相当的优良特性,其粘度、密度、闪点、浊点、流动点和铜条腐蚀测试结果 6项指标全部符合 EN14214以及ASTM6571标准[4]。微藻的养殖范围很广,甚至能在污水和盐湖中生长[5],不与农作物争夺有限耕地[6]。微藻生物柴油的制取过程分为养殖、采收、油脂提取和转酯反应,由于生产成本过高,目前被认为尚无法大范围工业应用[7]。为了解决这个难题,研究者试图将微藻生物柴油技术与市政污水处理[8]、厌氧消化制取沼气[9]、烟道气CO2固定耦联,从而增加这项技术的经济可行性。火力发电厂、水泥厂、冶金厂烟道气中含有大量的CO2气体,直接排放会导致严重的温室效应。哥本哈根会议严格规定了各国承担的减排义务。《清洁发展机制(CDM)的实施与管理》规定了项目级的碳减排量抵消额的转让与获得,企业参与碳减排,可以获得实实在在的经济收益。利用烟道气中的高浓度CO2培养微藻,能够显著提高微藻细胞的生长速度、细胞浓度和油脂含量[7−8],从而降低微藻生物柴油的成本。烟道气含有硫氧化物、氮氧化物、粉尘及高热,这些因素使微藻细胞的生长受到抑制。能耐受一定的高温环境的微藻藻株,对生物柴油的制取以及烟道气CO2的固定是至关重要的。紫外诱变技术以其简便快捷和效果显著,备受诱变育种研究者的青睐。配合原生质体诱变技术[10],增加了细胞对辐射的敏感程度,使紫外诱变的效果更佳。近年来利用紫外诱变这一经典手段对微藻改性的研究很多,如降低对 O2的敏感度[11]、增大对 CO2的耐受性[12]、获得耐高温性质[13]等。本研究从内蒙古筛选得到的 1株淡水小球藻Chlorella sorokinianaCS-01[14]为出发藻株,采用原生质体−紫外线诱变技术,高温(55 ℃)环境培养为选择压力,获得1株在该温度下存活的突变藻株。通入模拟的500 MW火电厂烟道气培养,评价该突变的藻株的工业应用价值。
1 材料和方法
1.1 材料
1.1.1 菌种和培养基
淡水小球藻Chlorella sorokinianaCS-01(专利号200910252395.3),为本实验室自行筛选得到的藻株,该藻株的特点是能高效利用高浓度CO2[15]。采用BG11作为培养基。
1.1.2 微藻细胞壁破除复合酶溶液
微藻细胞壁破除复合酶溶液中含2%(质量分数,下同)纤维素酶,0.5%半纤维素酶,1.5%离析酶,0.6 mol/L渗透压调节剂,pH=6.0。
1.1.3 实验仪器
SPX-250B-G 微电脑光照培养箱,Sunrise Remote/Touch Screen 酶标仪,紫外定时诱变仪,Beckman avanti j-E 离心机。
1.2 实验方法
1.2.1 培养方法
将培养基单个成分按照1 000倍浓度配成工作母液,分开存储。培养时,按1 mL/L添加母液至蒸馏水中,高压灭菌;其中CaCl2和A5土壤营养液分开灭菌,并在超净工作台中添加,以免高温环境使A5土壤营养液成分失活,钙离子沉淀。取对数生长期的微藻,接种量为6.5×105个/mL,温度为25 ℃,通气量为0.05(kPa·m3)/h,光照强度为5 000 lx,光暗比为14:10,置于光照培养箱培养。
1.2.2 细胞浓度测定
每天取样,样品添加至96孔酶标板,用分光光度计,700 nm波长下测量光密度(OD)值。每次测OD值之前,先测空白标板的吸光值,相减得到样品的吸光度。利用血球计数板对已知OD值的样品计数,建立细胞浓度对 OD值的函数关系,为Y=(5.159X+0.008 4)×107个/mL,其中(Y为细胞浓度,X为OD值,相关系数R2=0.999 2)。
1.2.3 紫外诱变育种
小球藻细胞外包被了一层厚厚的细胞壁,对紫外线有很强的阻碍作用。利用复合酶溶液去除细胞壁后的原生质体[16],对紫外线辐射更为敏感。实验方法见文献[16]。
将制好的原生质体平铺于灭菌的培养皿,迅速放入紫外定时诱变仪,15 W紫外灯,30 cm,分别设置0,1,2,4,6,8,10,15,20,30 min 辐照时间,3个平行组。藻液放置黑箱过夜后,稀释至合适浓度,涂平板,计算致死率。选择合适的诱变时间,对Chlorella sorokinianaCS-01进行诱变。紫外处理之前去除细胞壁。经紫外处理的原生质体黑箱过夜后,细胞壁再生,涂平板,置于光照培养箱培养,温度为55℃,光照强度为5 000 lx,光暗比为14:10。
1.2.4 突变藻株的耐高温性质研究
将在高温环境下存活的突变藻株,转接和扩大培养(5 L光反应器,光照强度为5 000 lx,通气量为0.05(kPa·m3)/h,接种量为 6.2×105个/mL)。分别设置 15,25,35,45和55 ℃,3个平行实验组。在相同的条件下,以出发藻株为对照组,研究该突变藻株在不同温度下的生长速率、生物量以及油脂含量的变化情况。按已优化的Bligh-Dyer法测定微藻的总脂含量[17]。
1.2.5 通入模拟火电厂烟道气扩大培养
扩大培养突变藻株,5 L光反应器,接种量为6.3×105个/mL,温度为38 ℃,光暗比为10:14,光照强度为5 000 lx,通气量为0.05 (kPa·m3)/h(将装机容量500 MW的火力发电厂烟道气的模拟气体,通入突变藻株的培养液中)。由于烟道气中的硫氧化物会造成酸雨,危害很大,因此,烟道气排放之前都有除硫工序。模拟气体成分不含SO2。
1.2.6 突变藻株的遗传稳定性研究
活化突变藻株,取第二代为M1,连续传代5次,保持每一代培养条件(5 L光反应器,接种量为6.3×105个/mL,温度为40 ℃,光暗比为10:14,光照强度5 000 lx,通气量为 0.05 (kPa·m3)/h)相同,每日测定细胞浓度,绘制藻株的生长曲线。
2 结果与讨论
2.1 诱变条件的确定
去除细胞壁的微藻原生质体,对紫外线非常敏感,处理5 min时超过50%细胞死亡,15 min时致死率达到 100%。紫外线诱变育种方法对于有细胞壁包被的细胞难以奏效的原因是细胞壁降低了细胞对辐射的敏感度,尽管该方法简单易行,却效果不佳。紫外诱变育种研究中,多选择致死率99%以上的诱变剂量,以便减小筛选的工作量,同时确保较大的突变率,但是,存在诱变剂量过高、菌体死亡的问题。本研究由于采用的筛选压力十分有效,不需要花费大量时间进行筛选,因此,可以使用相对较小的剂量来进行诱变,处理8 min,致死率为81%左右,能保证辐射剂量足够,引起突变数量较多。

图1 不同剂量紫外线对小球藻Chlorella sorokiniana CS-01的致死情况Fig.1 Lethality of Chlorella sorokiniana CS-01 under different dosages of UV
2.2 突变藻株细胞形态的变化
经纤维素复合酶溶液破壁后的小球藻细胞,由紫外线处理8 min后,在黑箱过夜,细胞壁再生。通过显微镜观察,耐高温的小球藻突变藻株,细胞形态较出发藻株Chlorella sorokinianaCS-01,并未发生改变。紫外线辐射改变了藻细胞的DNA,造成酶的改变,激活了与耐受高温相关的酶的合成与表达,但是并未引起细胞形态的改变。

图2 出发藻株和突变藻株在显微镜下的细胞形态Fig.2 Cell morphologies of Chlorella sorokiniana CS-01 and mutated alga under microscope
2.3 突变藻株耐受高温的性质
Chlorella sorokinianaCS-01是从内蒙古选育得到的 1株淡水小球藻,生长速度快,油脂质量分数为18%,特别是该藻株能够耐受高浓度 CO2,具有应用于工业烟道气固定CO2的潜力。该藻株为常温养殖,最适生长温度为25~30 ℃,超过40 ℃时基本上不能生长。工业烟道气含高热,而为了缩短改造工序,对烟道的改造一般不设置专门的冷却装置,从而会引起微藻养殖池的温度大幅度提高。有人利用烟道气进行温水水产养殖[18],高温实际上会让生长活动加速,生产周期降低。
经诱变处理的微藻细胞,放置于 55 ℃环境下培养,得到1株存活的藻株。经过扩大培养后平板再次纯化。以出发藻株为对照,研究不同温度下藻株的生长曲线、生物质产量和油脂含量,结果如图3所示。从图3可看出:低温培养时,二者的生长都很缓慢,细胞浓度低;高温培养时,突变藻株的优势越发明显:35 ℃是突变藻株较合适的培养温度,稳定期的细胞浓度达到2.08×108个/mL,而对照组的小球藻生长情况已经接近低温(15 ℃)培养时的状态,细胞浓度很低。图3(f)所示为40 ℃之后的情形,对照组的原始小球藻已经没有生长迹象,培养液发白,而突变藻株在40 ℃时仍然具有相当高的生长活性,进一步表明该突变藻株在30~40 ℃范围内生长都很旺盛;高于40 ℃时,生长受到抑制,但在55 ℃仍能维持基本生长。这在淡水小球藻中是非常罕见的。温水养殖技术,利用的是废热,水温设置一般为18~34 ℃[19]。火电厂烟道气将导致温度更大幅度提升,会达到40 ℃左右,在开放池培养体系中,一般不超过45 ℃。突变的小球藻藻株耐高温的性质基本能满足烟道气温水养殖的需求。

图3 不同温度培养下出发藻株和突变藻株的生长曲线Fig.3 Growth curves of Chlorella sorokiniana CS-01 and mutated alga cultured at different temperatures
生物质产量也有相同的规律。图4描述了出发藻株和突变藻株在不同温度培养下5 L藻液的生物质产量,比较了突变藻株和原始的藻株的稳定期藻粉湿质量和干质量。从图4可见:在25 ℃左右,二者的产量基本一致,这再次证明了突变藻株在低温时与原始藻株的一致性。超过30 ℃时,出发的原始藻株的生物质产量开始略微下降,与此不同的是,突变株的生物质产量大幅度增加,这正是由于2种细胞对高温不同的耐受性。突变株由于能抵抗高温对细胞的抑制,与新陈代谢相关的酶在30~35 ℃下活性更高,生命活动更加旺盛,在同样的时间内,累积的生物质相应更多。从图4还可计算出:经4 000 r/min离心的湿藻中水的质量分数约为60%。
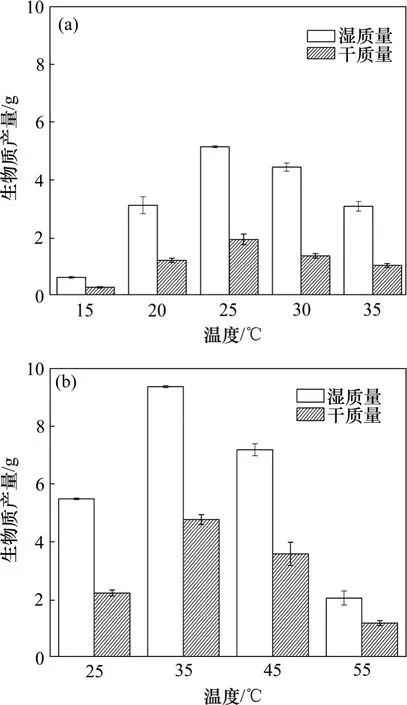
图4 不同温度培养出发藻株和突变藻株的生物质产量Fig.4 Biomass yields of Chlorella sorokiniana CS-01 and mutated alga cultured at different temperatures
表 1所示为突变藻株与原始出发藻株的油脂含量对比。经过紫外辐射作用之后,突变藻株的油脂含量略微降低,可能是旺盛的生长与脂质累积是相冲突的。值得注意的是,突变藻株的平均油脂质量分数为25%,在淡水小球藻中属于中上水平,加之它相当高的生长速度以及生物质产量,其最终的油脂产量仍然是很高。这对于工业应用十分重要。
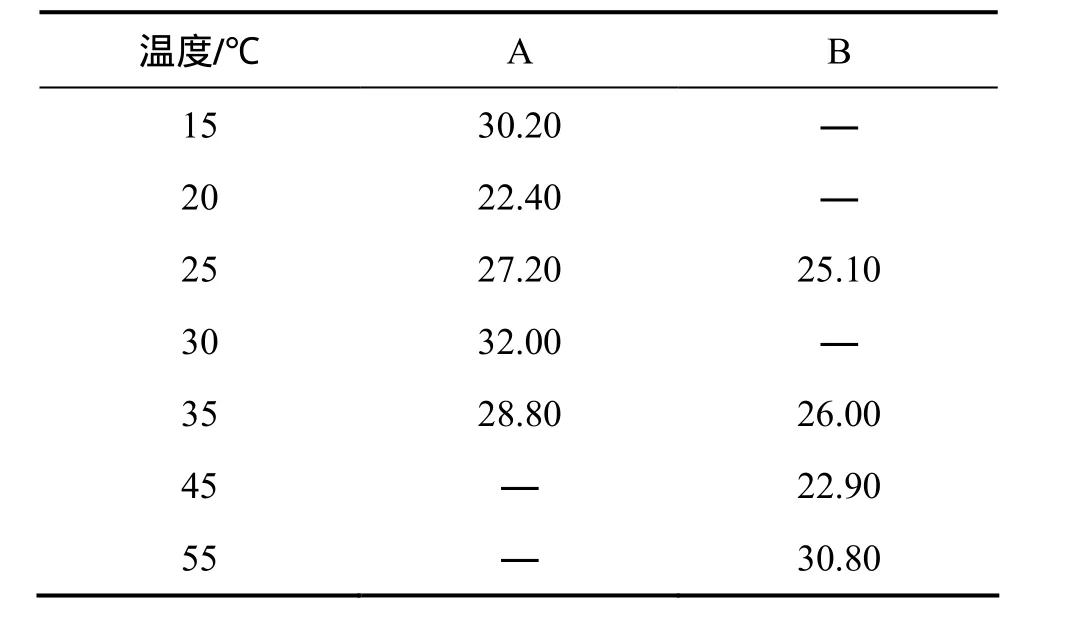
表1 出发藻株(A)和突变藻株(B)不同温度培养下油脂含量(质量分数)Table 1 Oil content of Chlorella sorokiniana CS-01(A) and mutated alga(B) cultured at different temperatures %
2.4 突变藻株的遗传稳定性
由于获得突变株经过几次传代之后,优良性状难以继续维持,出现退化,因此,在评价一个突变体性质时,其遗传稳定性是一个必须要考察的指标。图 5所示为突变株连续接种5代,在38 ℃、其他培养条件均严格保持一致的条件下,各代的生长情况。图中标识为M1的实际为该突变株的第3代。由于经过了多次转接和平板活化,此时藻株的生长活力是最强的。在该温度下,各代的生长都很旺盛,很好地继承了耐高温的性质;生长情形相似,细胞浓度很大,呈现墨绿色。稳定期细胞浓度高达1.3×108/mL。

图5 突变藻株的遗传稳定性Fig.5 Genetic stability of mutated alga
2.5 模拟烟道气扩大培养
参照湖南长沙附近的火电厂(华电集团长沙电厂),模拟烟道气企业装机容量为500 MW,烟气中除了不含有硫氧化物(工厂均有除硫装置,烟气中含硫量很小),其余气体成分按比例混合配制。
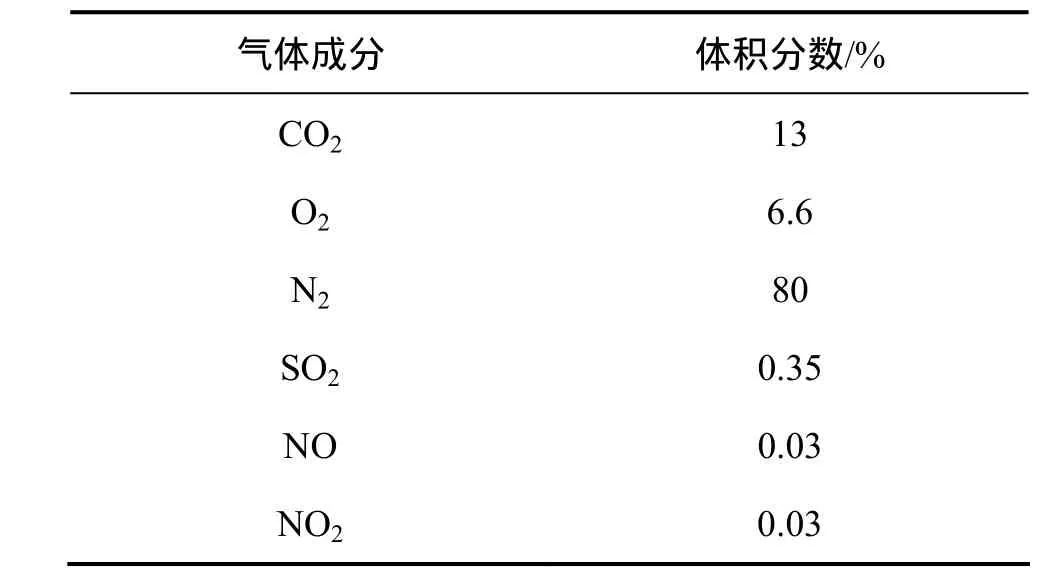
表2 装机容量500 MW的火力发电厂烟道气成分Table 2 Flue gas components of 500 MW thermal power plant
将烟气通入培养微藻的开放池,势必造成水温过高。用温控型光照培养箱直接设置38 ℃,通入模拟气体培养,结果见图6。图6表明:模拟气体的通入头3 d,微藻细胞处于适应过程,细胞无增殖现象;第 4天进入对数期后,第7天就达到生长顶峰,细胞浓度达 1.3×108/mL。烟道气中高浓度的 CO2气体有效地促进了藻细胞的生长,生长周期缩短2 d。

图6 通入模拟烟道气培养突变藻株的生长曲线Fig.6 Growth curve of the mutated alga cultured under pumping of simulated flue gas
5 L藻液离心收集后冷冻干燥,得到4.4 g干藻粉,提取得到1.8 g油脂,油脂质量分数达40.7%,与出发藻株油脂质量分数相比提高近1倍。高浓度的CO2显然对突变藻株的生长、油脂累积同样起到了积极的作用。生长周期缩短对工业生产意义重大,这能大幅度消减成本。油脂含量的提高同样可以增加单位油脂产量。只要生产成本降低到可接受的程度,这项最有前景的清洁能源计划将能付诸实施。
本研究将瞄准工业烟道气CO2固定,以获得耐高温藻株为目标。若期望获得油脂含量高的突变藻株,只需在本研究的基础上,对筛选环节进行改进即可。在原生质体−紫外诱变处理之后,结合尼罗红细胞染色技术,用荧光显微镜观测,细胞内的油脂成分与尼罗红染料特异结合,产物能激发荧光,荧光强度能线性表征油脂含量。尼罗红染色解决了评价藻细胞油脂含量的技术难题,适合大量多批次的重复性研究。
3 结论
(1) 本研究采用原生质体−紫外线诱变技术进行育种,效果良好,细胞壁的去除极大增大了细胞对紫外辐射的敏感程度。
(2) 获得 1株遗传稳定的耐高温的淡水小球藻,并且在较高温度有较好的生理生化表现,适合作为烟道气 CO2固定以及微藻生物柴油生产的工业应用藻种。
(3) 模拟500 MW火电厂烟道气成分扩大培养该突变藻株,对烟道气中有毒成分适应之后,高浓度CO2使生长周期缩短2 d,油脂含量提高近1倍。突变藻株获得耐高温的性质的同时,未丢失原始藻株对高浓度CO2的耐受能力。
(4) 该突变微藻对烟道气 CO2的固定效率有待进一步进行研究,这对于工业应用是至关重要的。
[1] Venkata M S, Prathima D M, Mohanakrishna G, et al.Potential of mixed microalgae to harness biodiesel from ecological water-bodies with simultaneous treatment[J].Bioresource Technology, 2011, 102(2): 1109−1117.
[2] 夏金兰, 万民熙, 王润民.微藻生物柴油的现状与进展[J].中国生物工程杂志, 2009, 29(7): 118−126.XIA Jinlan, WAN Minxi, WANG Runmin.Review on the microalgal biodiesel[J].China Biotechnology, 2009, 29(7):118−126.
[3] 夏金兰, 刘鹏, 万民熙.Chlorella sorokinianarbcL基因的克隆与序列分析及其与 18S rRNA基因在分类学上的比较[J].现代生物医学进展, 2010, 10(24): 4601−4605.XIA Jinlan, LIU Peng, WAN Minxi.Cloning and sequence analysis of rbcL Gene fromchlorella sorokinianaand comparison with 18S rDNA Gene in Taxonomy[J].Progress in Modern Biomedicine, 2010, 10(24): 4601−4605.
[4] Akhavan Moghaddam N, Tahvildari K, Taghvaie S.Transesterification for production of biodiesel from waste frying oil(WFO)[J].International Journal of Chemical and Biological Engineering, 2010, 3(3): 119−123.
[5] Demirbas A, Fatih Demirbas M.Importance of algae oil as a source of biodiesel[J].Energy Conversion and Management,2011, 52(1): 163−170.
[6] Najafi G, Ghobadian B, Yusaf T F.Algae as a sustainable energy source for biofuel production in Iran: A case study[J].Renewable and Sustainable Energy Reviews, 2011, 15(8): 3870−3876.
[7] Oshita K, Furubayashi T, Nakata T.The analysis on performance of microalgae-based biofuel production system considering regional climate condition and transportation[J].Nihon Enerugi Gakkaishi/Journal of the Japan Institute of Energy, 2011.90(11):1047−1056.
[8] Jiang L, Luo S, Fan X, et al.Biomass and lipid production of marine microalgae using municipal wastewater and high concentration of CO2[J].Applied Energy, 2011, 88(10):3336−3341.
[9] Harun R, Davidson M, Doyle M, et al.Technoeconomic analysis of an integrated microalgae photobioreactor, biodiesel and biogas production facility[J].Biomass and Bioenergy, 2011,35(1): 741−747.
[10] 仲松, 张庆庆.紫外诱变原生质体选育高产 L-乳酸菌株的研究[J].安徽工程大学学报, 2011, 26(1): 28−30.ZHONG Song, ZHANG Qingqing.UV mutagenesis of protoplast and screening for high L-lactate yielding strain[J].Journal of Anhui Polytechnic Universit, 2011, 26(1): 741−747.
[11] Zhang Y T, Fan X L, Li X P, et al.Screening of oxygen-tolerance phenotypes in hydrogen-producing strains of Chlamydomonas moewusii with ultraviolet radiation[J].Journal of South China University of Technology: Natural Science, 2011, 39(5):149−153.
[12] Javed S, Asgher M, Sheikh M A, et al.Strain improvement through UV and chemical mutagenesis for enhanced citric acid production in molasses-based solid state fermentation[J].Food Biotechnology, 2010, 24(2): 165−179.
[13] 黄瑞芳, 刘广发, 周韬.耐高温巴氏杜氏藻突变株的诱变和鉴定[J].厦门大学学报, 2006, 45(2): 272−275.HUANG Ruifang, LIU Guangfa, ZHOU Tao.Mutagenesis and idenfication ofDuna liellaba rd awil which can withstand high temperature[J].Journal of Xiamen University, 2006, 45(2):272−275.
[14] Wan M, Liu P, Xia J, et al.The effect of mixotrophy on microalgal growth, lipid content, and expression levels of three pathway genes inChlorella sorokiniana[J].Applied Microbiology and Biotechnology, 2011, 91(3): 835−844.
[15] Wan M, Rosenberg J N, Faruq J, et al.An improved colony PCR procedure for genetic screening ofChlorellaand related microalgae[J].Biotechnology Letters, 2011, 33(8): 1615−1619.
[16] 沈继红, 林学政.细胞融合法构建EPA和DHA高产异养藻株的研究[J].中国水产科学, 2001, 8(2): 63−66.SHEN Jihong, LIN Xuezheng.Building high EPA and DHA yielding algae strains by method of cell diffusion[J].Journal of Fishery Science of China, 2001, 8(2): 63−66.
[17] Smedes F, Thomasen T K.Evaluation of the Bligh & Dyer lipid determination method[J].Marine Pollution Bulletin, 1996,32(8/9): 681−681.
[18] 陈明明, 杨忠华.利用微藻技术减排 CO2的研究[J].武汉科技大学学报, 2009, 32(4): 436−439.CHEN Mingming, YANG Zhonghua.Reducing of CO2emission by method of algal technology[J].Journal of Wuhan University of Science and Technology, 2009, 32(4): 436−439.
[19] 杨太有, 彭仁海.淡水鲨鱼温流水养殖技术初探[J].河南水产, 2004, 1(1): 24−26.YANG Taiyou, PENG Renhai.Breeding of fresh water shark using warm water[J].Fishery Science of Henan, 2004, 1(1):24−26.

