佛波酯诱导血小板黏附受体GPⅠbα酶切的机制研究
王志成,罗梅宏,谢如锋,张晓峰
(1.上海中医药大学附属市中医医院实验中心,上海200071;2.上海市血液中心血液工程室,上海200051)
血小板在活化的同时,伴随有黏附受体GPⅠbα的酶切,产生的酶切片段称为糖盏蛋白(glycocalicin,GC)[1]。GPⅠbα 酶切是血小板储存损伤(platelet storage lesion,PSL)一个重要的生物标志物[2]。因此,阐明GPⅠbα酶切的机制将有助于认识血小板储存损伤的机理。
佛波酯 (phorbol12-myristate-13-acetate,PMA)是常用的蛋白激酶 C(protein kinase C,PKC)的活化剂。PMA 能诱导 GPⅠbα 酶切[3],但是PMA诱导GPⅠbα酶切的分子机制尚未完全阐明。我们主要探讨了PMA诱导GPⅠbα酶切的分子机制。
材料和方法
一、材料
1.研究对象 选取健康志愿者10名,男、女各5名,经上海中医药大学附属市中医医院伦理审查委员会批准同意,志愿者均签署知情同意书。
2.主要试剂 抗GPⅠbα N端单克隆抗体SZ-2、辣根过氧化物酶(HRP)标记的羊抗小鼠IgG二抗购自Santa Cruz公司;GM6001购自Calbiochem公司;二硫苏糖醇(DTT)、NAD(P)H氧化酶抑制剂(DPI)、蛋白激酶 C(PKC)抑制剂(BIM)、佛波酯(PMA)、ROS检测探针DCFDA购自Sigma公司;PKC活性检测试剂盒购自Promega公司;线粒体活化氧(ROS)拮抗剂MitoQ购自苏州沃盛化学有限公司。
二、方法
1.制备洗涤血小板 取健康自愿者静脉血,用柠檬酸盐缓冲液(ACD)按照1∶7抗凝,380×g离心20 min得到富含血小板血浆(PRP),PRP经1 500×g离心20 min,沉淀用葡萄糖柠檬酸盐缓冲液(CGS)缓冲液悬浮,经离心、洗涤,最后用MTB液重悬,得到洗涤血小板,调整血小板浓度为3×108/mL,室温静置1 h使其恢复至静息状态以备用[4]。
2.Western blot检测 GPⅠbα酶切片段 3×108个/mL洗涤血小板与1.0 μmol/L PMA或二甲基亚矾(DMSO)37℃孵育30 min,2 600×g离心5 min,得到上清,加入5×上样缓冲液和β-巯基乙醇,最后样品经western blot检测GPⅠbα酶切片段。抑制实验:3×108个/mL洗涤血小板预先与100 μmol/L BIM、DTT(25、50、100、200 μmol/L)或DMSO 37℃孵育15 min后,再与1.0 μmol/L PMA 37℃孵育30 min。
3.流式细胞仪检测ROS 3×108个/mL洗涤血小板分别与不同浓度PMA(0.25、0.5、1.0、2.0 μmol/L)或 DMSO 37 ℃孵育 30 min,加 ROS检测探针 DCFDA(20 μmol/L)孵育10 min,经稀释后,用流式细胞仪进行检测。抑制实验:3×108个/mL洗涤血小板预先与 10 μmol/L DPI、100 μmol/L MitoQ、100 μmol/L BIM、200 μmol/L DTT或DMSO 37℃孵育15 min,再与1.0 μmol/L PMA 37℃孵育30 min。
4.检测PKC活性 3×108个/mL洗涤血小板与1.0 μmol/L PMA或DMSO 37℃孵育30 min。抑制实验:3×108个/mL洗涤血小板预先与200 μmol/L DTT、100 μmol/L BIM 或 DMSO 37 ℃孵育 15 min,再与 1.0 μmol/L PMA 37 ℃ 孵育30 min。使用非同位素标记的PKC活性检测试剂盒,先抽提PKC,再检测。具体步骤按说明书操作。
三、统计学方法
结 果
一、BIM抑制 PMA诱导的 GPⅠbα酶切的分析
PMA是常用的PKC活化剂,能诱导GPⅠbα酶切。为了证实PKC在PMA诱导GPⅠbα酶切中的作用,本研究使用PKC特异性抑制剂BIM,同时使用解离素-金属蛋白酶17(a disintegrin and metalloproteinase 17,ADAM17)抑制剂GM6001作为对照。图1结果显示,BIM完全抑制PMA诱导的GPⅠbα酶切;GM6001能完全抑制PMA诱导的GPⅠbα酶切。

图1 BIM完全抑制PMA诱导的GPⅠbα酶切
二、DTT抑制 PMA诱导的GPⅠbα酶切的分析
ROS通过氧化ADAM17的半胱氨酸残基调控ADAM17活性[5]。为了证实 ROS是否参与PMA诱导的GPⅠbα酶切,本研究使用ROS抑制剂DTT。结果显示DTT浓度依赖地抑制PMA诱导的GPⅠbα 酶切,在高浓度(200 μmol/L)时能完全抑制PMA诱导的GPⅠbα酶切。表明ROS参与调控PMA诱导的GPⅠbα酶切。见图2。
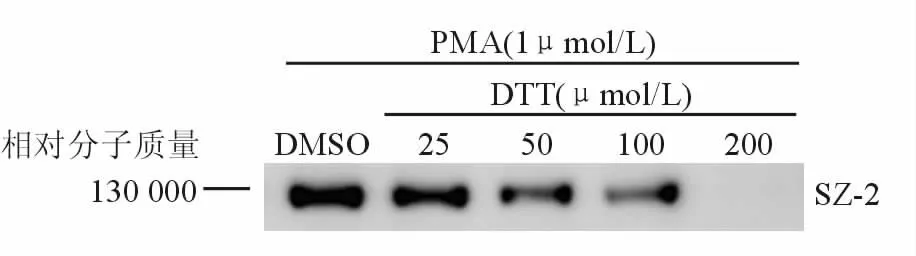
图2 DTT浓度依赖地抑制PMA诱导的GPⅠbα酶切
三、PMA浓度依赖地诱导血小板产生ROS
为了证实PMA是否诱导血小板产生ROS,本研究使用ROS检测探针DCFDA。图3结果显示,PMA浓度依赖地诱导血小板产生ROS,表明PMA能够诱导血小板产生ROS。
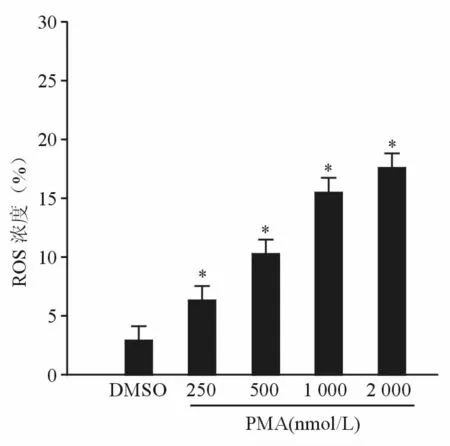
图3 PMA浓度依赖地诱导血小板产生ROS
四、NAD(P)H氧化酶抑制剂抑制PMA诱导的ROS
ROS主要由线粒体呼吸链和NAD(P)H氧化酶产生[6]。为了证实PMA诱导产生的ROS的来源,本研究使用线粒体靶向的ROS拮抗剂MitoQ和DPI。图4结果显示,MitoQ不抑制PMA诱导产生ROS,而DPI则抑制PMA诱导产生ROS,表明PMA诱导产生的ROS来自NAD(P)H氧化酶。
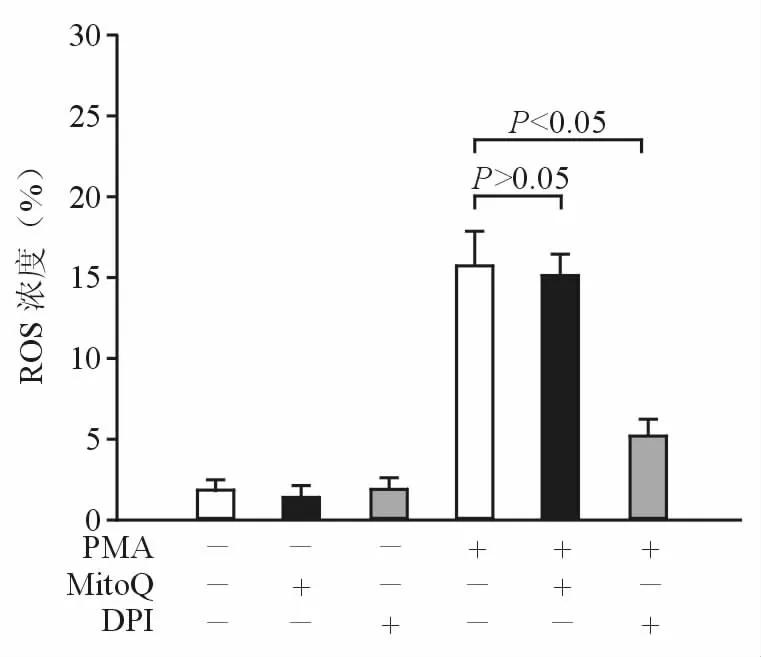
图4 DPI抑制PMA诱导的ROS
五、PKC抑制剂抑制PMA诱导的ROS
为了证实PMA诱导产生ROS是通过活化PKC,本研究使用BIM。图5结果显示,BIM抑制PMA诱导的 ROS,表明PKC参与 PMA诱导的ROS,提示PKC可能在ROS信号通路的上游。
六、ROS抑制剂不抑制PMA诱导的PKC活化
为了进一步证实PKC与ROS之间的上下游关系,本研究使用PKC活性检测试剂盒。图6结果显示,DTT不影响PMA诱导的 PKC活性,而BIM则抑制PMA诱导的PKC活化。

图5 BIM抑制PMA诱导的ROS
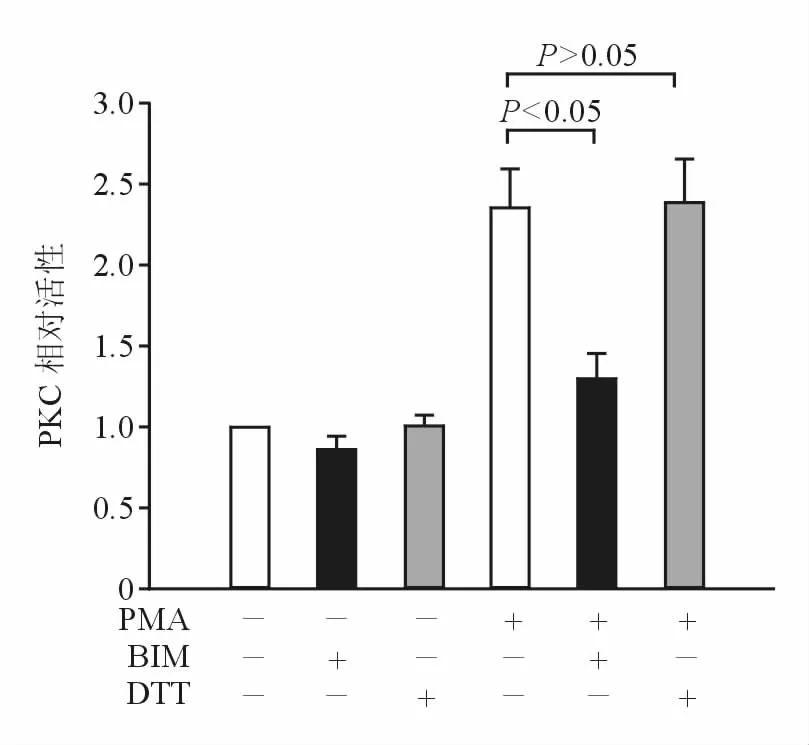
图6 DTT不抑制PMA诱导的PKC活化
讨 论
GPⅠbα是血小板膜受体GPIb-IX-V复合物中最重要的一个亚基,能与血管性血友病因子(VWF)、凝血酶、P-选择素等结合,在血小板血栓形成的起始阶段起关键作用[7]。血小板在活化的同时,伴随有GPⅠbα酶切,产生的酶切片段称为 GC[1]。
最近Bergmeier等[8]使用基因敲除小鼠证实ADAM17是负责酶切 GPⅠbα的主要蛋白酶。ADAM17由824个氨基酸残基组成的I型跨膜蛋白,含有多个结构域。从N端开始包括:信号肽、前域、金属蛋白酶域、解离素域、表皮生长因子样域、半胱氨酸富含域、跨膜域和胞质尾[9]。已有报道,ADAM17的前域、半胱氨酸富含域、跨膜域和胞质尾参与ADAM17的活性调节[10]。其中,胞质尾在ADAM17活性调控中的调节存在争议,有些报道认为ADAM17胞质尾的丝氨酸被p38促分裂原活化蛋白激酶(p38MAPK)或PKC磷酸化引起ADAM17活性增加[11-12];另一些报道认为胞质尾不参与调控ADAM17活性[13]。PMA是PKC活化剂,常用于ADAM17底物酶切的研究。Killock等[12]报道,PMA先活化PKC,活化的PKC直接磷酸化ADAM17胞质尾的丝氨酸,进而活化ADAM17引起底物的酶切。PMA能够诱导GPⅠbα酶切已被很多文献报道[3]。然而,PMA 诱导 GPⅠbα酶切的信号通路目前还未完全阐明。本研究使用各种抑制剂,结果表明在PMA诱导的GPⅠbα酶切中,可能存在“PMA-PKC-NAD(P)H氧化酶-ROS-ADAM17-GPⅠbα酶切”信号通路。本研究进一步支持ADAM17的胞质尾可能不参与调节ADAM17活性。NAD(P)H氧化酶是由5个主要亚基构成的酶复合体[14]。PKC如何引起NAD(P)H氧化酶活化本研究未涉及,可能通过直接或间接的方式,目前这方面的研究正在进行中。
近年来,ROS在调控ADAM17活性方面逐渐引起人们的关注[5]。ROS的来源主要有线粒体呼吸链和NAD(P)H氧化酶。本研究结果显示,PMA通过活化PKC,PKC通过直接或间接途径活化NAD(P)H氧化酶,产生ROS,ROS通过直接或间接的方式活化ADAM17,进而引起GPⅠbα酶切。有报道,ROS能直接通过氧化ADAM17的半胱氨酸残基直接活化ADAM17[5];也有报道,ROS通过活化p38MAPK进而引起ADAM17的活化[15]。ROS如何引起ADAM17活化本研究未涉及,可能通过直接或间接的方式,目前这方面的研究正在进行中。
最近的研究报道,钙离子依赖蛋白酶(calpain)参与 A23187、凝血酶(在搅拌条件下)和calpain活化剂dibucaine诱导的GPⅠbα 酶切[16]。本研究使用calpain抑制剂MDL28170,结果发现MDL28170不抑制PMA诱导的GPⅠbα酶切,表明不同的诱导剂引起的GPⅠbα酶切涉及不同的信号通路。
综上所述,本研究证实PMA诱导GPⅠbα酶切不是通过PKC直接活化 ADAM17,而是通过NAD(P)H氧化酶产生的ROS活化ADAM17。本研究结果有助于进一步认识GPⅠbα酶切的机制。阐明GPⅠbα酶切的机制不仅有助于认识血小板血栓形成的机理,而且为认识血小板储存损伤提供新的视角。
[1]Andrews RK,Karunakaran D,Gardiner EE,et al.Platelet receptor proteolysis:a mechanism for downregulating platelet reactivity[J].Arterioscler Thromb Vasc Biol,2007,27(7):1511-1520.
[2]Canault M,Duerschmied D,Brill A,et al.p38 mitogen-activated protein kinase activation during platelet storage:consequences for platelet recovery and hemostatic function in vivo[J].Blood,2010,115(9):1835-1842.
[3]Gardiner EE,Karunakaran D,Shen Y,et al.Controlled shedding of platelet glycoprotein(GP)Ⅵand GPIb-Ⅸ-Ⅴ by ADAM family metalloproteinases[J].J Thromb Haemost,2007,5(7):1530-1537.
[4]王志成,张晓锋,陈晓宇,等.三苯氧胺诱导血小板凋亡的研究[J].安徽医科大学学报,2011,46(9):853-857.
[5]Wang Y,Herrera AH,Li Y,et al.Regulation of mature ADAM17 by redox agents for L-selectin shedding[J].J Immunol,2009,182(4):2449-2457.
[6]Dikalov S.Cross talk between mitochondria and NADPH oxidases[J].Free Radic Biol Med,2011,51(7):1289-1301.
[7]Du X.Signaling and regulation of the platelet glycoprotein Ib-Ⅸ-Ⅴ complex[J].Curr Opin Hematol,2007,14(3):262-269.
[8]Bergmeier W,Piffath CL,Cheng G,et al.Tumor necrosis factor-alpha-converting enzyme(ADAM17)mediates GPIbalpha shedding from platelets in vitro and in vivo[J].Circ Res,2004,95(7):677-683.
[9]Gooz M.ADAM-17:the enzyme that does it all[J].Crit Rev Biochem Mol Biol,2010,45(2):146-169.
[10]Klein T,Bischoff R.Active metalloproteases of A the disintegrin and metalloprotease(ADAM)family:biological function and structure[J].J Proteome Res,2011,10(1):17-33.
[11]Xu P,Derynck R.Direct activation of TACE-mediated ectodomain shedding by p38 MAP kinase regulates EGF receptor-dependent cell proliferation[J].Mol Cell,2010,37(4):551-566.
[12]Killock DJ,Ivetic'A.The cytoplasmic domains of TNFalpha-converting enzyme(TACE/ADAM17)and L-selectin are regulated differently by p38 MAPK and PKC to promote ectodomain shedding[J].Biochem J,2010,428(2):293-304.
[13]Horiuchi K,Le Gall S,Schulte M,et al.Substrate selectivity of epidermal growth factor-receptor ligand sheddases and their regulation by phorbol esters and calcium influx[J].Mol Biol Cell,2007,18(1):176-188.
[14]陈 宁,傅 毅,应雅韵,等.NAD(P)H氧化酶p22phox亚基C242T基因多态性与脑梗死的关系[J].检验医学,2011,26(3):175-179.
[15]Brill A,Chauhan AK,Canault M,et al.Oxidative stress activates ADAM17/TACE and induces its target receptor shedding in platelets in a p38-dependent fashion[J].Cardiovasc Res,2009,84(1):137-144.
[16]Wang Z,Shi Q,Yan R,et al.The role of calpain in theregulation ofADAM17-dependentGPIbalpha ectodomain shedding[J].Arch Biochem Biophys,2010,495(2):136-143.