重型乙型肝炎患者外周血T淋巴细胞亚群及乙型肝炎病毒特异性细胞毒性T淋巴细胞的变化及意义
彭赛蛟,李伟林,张 瑾
(1.台州市中医院检验科,浙江台州318000;2.台州市立医院检验科,浙江台州318000)
乙型肝炎是我国最常见的传染病之一,具有发病率高、传染性强和传播途径复杂等特点[1]。按临床表现的不同,乙型肝炎可分为急性肝炎、慢性肝炎和重型乙型肝炎3种。重型肝炎患者病情严重,进展快,死亡率很高[2],为此,探明重型肝炎发生和进展的有关因素对于疾病的治疗具有十分重要的意义。有研究表明,乙型肝炎病毒(HBV)感染机体后,对肝脏的损伤主要是免疫损害所致,其中细胞免疫起着主要作用[3-4],而且细胞毒性T淋巴细胞(CTL)在HBV清除和肝细胞损伤方面均发挥了重要作用,但上述细胞免疫反应在重型肝炎中所起的具体作用还不十分清楚[5-6]。为此,本研究在与不同类型肝炎和健康对照组比较的基础上,探讨了重型乙型肝炎患者外周血T淋巴细胞亚群及HBV特异性CTL的变化,以期为重型肝炎的发生及进展研究提供一定的依据。
材料和方法
一、研究对象
所有研究对象来自2010年3月至2012年8月期间,在台州市中医院内科病房收住入院患者和门诊健康体检者,共122例,其中男96例,女26例,年龄(43±13)岁。共有乙型肝炎患者102例,其中急性乙型肝炎20例、慢性乙型肝炎40例、重型乙型肝炎42例(急性重型乙型肝炎20例,慢性重型乙型肝炎22例),在重型乙型肝炎患者中死亡患者8例,其余34例患者均好转或康复出院。健康对照组20名,体检过程正常,体检结果显示肝功能无异常,无肝炎、血吸虫病史,各型肝炎病毒抗体阴性。各组研究对象的性别、年龄差异无统计学意义,具有可比性。
二、方法
1.外周血T淋巴细胞亚群检测 各组患者的外周血T淋巴细胞亚群采用直接免疫荧光标记全血溶血法和流式细胞仪检测。各患者于住院次日清晨空腹(体检患者于体检当日)经肘正中静脉采血5 mL。将CD3+、CD4+和CD8+荧光标记的单克隆抗体20 μL,分别加入乙二胺四乙酸(EDTA)抗凝的外周血中,混匀,室温避光15 min,细胞裂解液溶解红细胞,磷酸盐缓冲液(PBS)洗涤细胞,吸去上清液后加入PBS 500 μL,混匀,待细胞悬浮后,上流式细胞仪(FACS Calibur,BD公司,美国)检测。
2.外周血HBV特异性CTL检测 (1)采用肝素抗凝试管,空腹静脉采集全血标本5 mL,采用淋巴细胞分离液分离外周血单个核细胞(PBMC);(2)在PBMC中加入抗HLA-A2异硫氰酸荧光素(FITC)单克隆抗体(BD公司,美国),采用流式细胞术快速检测HLA-A2抗原分型,并用聚合酶链反应(PCR)进行验证;(3)根据文献[7]的方法合成3条HLA-A2阳性的HBV特异性CTL抗原表位肽(core18-27、polymerase575-583和envelope335-343),core18-27短链的氨基酸序列为FLPSDFFPSV,polymerase575-583短链的氨基酸序列为FLLSLGIHL,envelope335-343短链的氨基酸序列为WLSLLVPFV(由中国军事医学科学院提供)。在此基础上,用藻红蛋白(PE)进行标记,进一步合成肽段特异性的Tetramer复合体,即Tc18-27、Tp575-583和 Te335-343;(4)用含有10%胎牛血清的1640液悬浮PBMC,调整细胞浓度至2×106个/mL。将悬浮液分别加入24孔培养板中,每孔1 mL,每孔分别加入10 μL/mL的core18-27、polymerase575-583 和 envelope335-343多肽,每3天行半量换培养液,于培养后第14天收集 HBV肽链特异性的 CTL细胞;(5)新鲜EDTA抗凝血分离的PBMC和HBV肽链特异性的CTL细胞系均采用PBS洗3次,用200 μL冷PBS悬浮,加入流式细胞仪专用管中,每管106个细胞,然后加入Tc18-27、Tp575-583和Te335-343各2 μL,同时加入CD8-FITC标记的单克隆抗体和CD3-多甲藻黄素叶绿素蛋白(PerCP,BD公司,美国)各5 μL,遮光温育30 min后,多聚甲醛固定6 h上流式细胞仪检测,采用CellQuest软件分析结果。
三、统计学方法
数据采用SPSS 11.0统计学软件和Excel软件进行处理,采用单因素方差分析和q检验分析比较组间差异,P<0.05表示差异有统计学意义。
结 果
一、各组研究对象外周血T淋巴细胞亚群的变化
慢性重型乙型肝炎患者外周血淋巴细胞的CD3+、CD4+、CD8+百分比分别为 66.5 ±2.5、41.0±2.3、34.5±2.2,CD4+/CD8+比值为1.17±0.09。与健康对照组比较,慢性重型乙型肝炎患者外周血淋巴细胞的CD3+和CD4+百分比显著下降(P<0.05),分别降低13.0%和11.5%;外周血淋巴细胞的 CD8+百分比显著上升(P<0.05),上升20.6%;外周血淋巴细胞的CD4+/CD8+比值显著下降(P<0.05),降低27.8%。与急性乙型肝炎和慢性乙型肝炎患者比较,慢性重型乙型肝炎患者外周血淋巴细胞的 CD3+、CD4+、CD8+百分比和 CD4+/CD8+比值差异均有统计学意义(P<0.05)。重型乙型肝炎患者中,存活组 CD3+、CD4+、CD8+百分比分别为67.0±2.3、42.5 ±2.2、34.5 ±2.2,CD4+/CD8+比值为1.21 ±0.12;死亡患者组 CD3+、CD4+、CD8+百分比分别为 64.4±2.0、39.1±2.2、36.1±1.9,CD4+/CD8+比值为1.08±0.08。与存活组比较,死亡组的 CD3+、CD4+百分比和 CD4+/CD8+比值降低更加明显,CD8+百分比上升更加明显(P <0.05),见表1。
二、各组乙型肝炎患者外周血HBV 3种特异性CTL的变化
与健康对照组比较,慢性重型乙型肝炎患者外周血 core18-27、polymerase 575-583和 envelope335-343特异性CTL水平均明显下降(P<0.05);慢性乙型肝炎患者3种CTL水平与健康对照组差异无统计学意义(P>0.05);急性乙型肝炎患者各种CTL水平明显上升(P<0.05);急性重型乙型肝炎患者的外周血core18-27特异性CTL上升明显,而 polymerase575-583和 envelope335-343特异性CTL与健康对照组差异无统计学意义(P>0.05)。死亡组中3种HBV特异性CTL水平下降明显(P<0.05),见图1和表2。
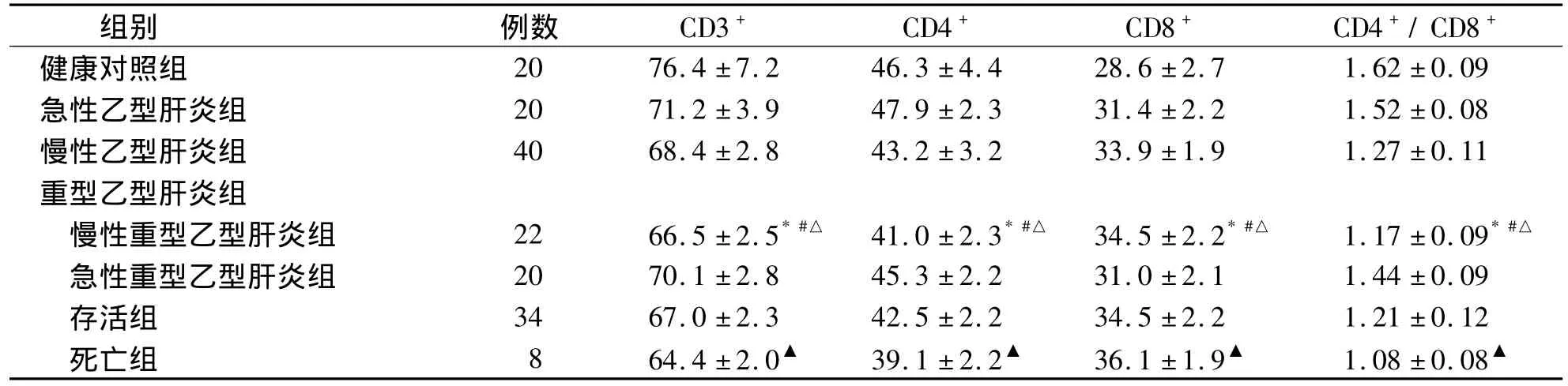
表1 各组研究对象外周血T淋巴细胞亚群的变化 (%)

图1 流式细胞术检测HBV特异性CTL散点图

表2 各组研究对象外周血3种特异性CTL的变化 (%)
讨 论
以往报道显示,细胞免疫对于清除细胞内HBV起着主要作用[3-4]。本研究结果显示,在重型乙型肝炎患者中,慢性重型乙型肝炎患者的CD3+和CD4+细胞百分比出现了明显的降低,而CD8+百分比出现明显的增高,CD4+/CD8+比值明显下降,这表明患者在细胞免疫功能降低的同时,出现了细胞免疫功能的紊乱,但急性重型乙型肝炎患者不明显。在急性肝炎中,患者T淋巴细胞变化主要表现在CD8+细胞的异常上,而CD4+细胞出现轻度的增加,说明急性期机体应激状态好,在积极地清除HBV以保护机体;在慢性肝炎中,患者T淋巴细胞变化不仅出现了CD8+细胞的增加,同时还出现了CD4+细胞的降低,说明由于HBV的长期慢性感染,机体逐渐失去了清除HBV的能力,患者病情逐渐加重。当CD8+细胞的增加和CD4+细胞的降低严重到一定程度,患者病情迅速恶化,出现慢性重型肝炎,增加了肝炎患者的死亡率。
重型乙型肝炎的发生还可能与某些基因位点的变异和抗原抗体免疫复合物的出现有关,这些因素均可导致由CTL介导的免疫应答失调,这可能与乙型肝炎炎症加重存在密切的关系。有研究表明,HBV特异性CTL在清除病毒和引起肝细胞损伤2种不同作用中均可能扮演着关键角色。CTL既可以通过分泌细胞因子等非溶细胞性清除HBV,又可以在不同情况下引起非特异性免疫活性细胞在肝内浸润,最终导致肝细胞受损。如果特异性CTL应答失调,就可能导致慢性重型乙型肝炎的出现。
本研究结果显示,慢性重型乙型肝炎患者乙型肝炎 core18-27、polymerase575-583和 envelope335-343特异性CTL水平均明显下降,慢性乙型肝炎患者各种CTL水平与健康对照组差异无统计学意义,急性乙型肝炎患者各种CTL水平与健康对照组比较明显上升,这与陈瑜等[8]的研究相符合。急性肝炎患者机体处于代偿期,其特异性CTL水平的增加有利于HBV的清除,有的药物能增强特异性细胞免疫功能,如聚乙二醇IFN-α-2b能增强特异性 CD8+细胞的功能[9],但同时也会导致肝功能的损害,因此,在治疗过程中要注意保护肝功能。慢性肝炎患者逐渐失去了对HBV的抵抗能力,专家推测过低的抗原特异性CTL反应可能是肝炎病毒感染更容易慢性化的原因之一[10]。当CTL水平出现急剧下降时,机体完全失去了对HBV的抵抗能力,病毒迅速复制,因此导致慢性肝炎的出现。有研究发现,慢性乙型肝炎患者HBV DNA水平与HBV特异性CTL有关,HBV DNA水平低者 HBV特异性 CTL高,HBV DNA水平高者HBV特异性 CTL低[11]。近几年研究还发现慢性乙型肝炎患者HBV特异CTL细胞功能与机体调节性T细胞(regulatory T cell,Treg)和感染不同 HBV 基因型有关[12-14]。因此,乙型肝炎患者HBV特异性与非特异性T淋巴细胞的变化是一个比较复杂的课题,搞清乙型肝炎患者体内HBV特异性CTL水平对用药物和乙型肝炎治疗性疫苗[15]治疗有一定的临床意义。
由于重型乙型肝炎存在较高的死亡率,所以本研究生存患者和死亡患者的有关数据给予了进一步的分析。结果发现,死亡的重型乙型肝炎患者外周血淋巴细胞CD3+、CD4+百分比和CD4+/CD8+比值降低明显,CD8+百分比上升明显;HBV特异性CTL也是如此,慢性重型乙型肝炎患者外周血HBV特异性CTL水平下降更加明显,说明细胞免疫的异常在重型乙型肝炎的发生、发展中发挥了重要作用。
综上所述,对于乙型肝炎患者进行外周血T淋巴细胞亚群以及HBV特异性CTL水平的检测十分重要。动态检测他们的水平对于判定乙型肝炎的进展具有重要参考价值[16-17]。当上述检测指标出现急剧改变时,应考虑可能发生慢性重型乙型肝炎;当慢性重型乙型肝炎患者上述指标进一步发生改变,提示患者的预后不良。
[1]姚碧莲,刘 峰,黄素园,等.乙型肝炎病毒感染不同状态下血清病毒反转录酶区准种特点及其临床意义[J].中华传染病杂志,2011,29(12):717-722.
[2]任贵英,蒋 音,刘 莉.重型肝炎53例死亡原因分析[J].世界感染杂志,2007,7(3):230-231.
[3]孙桂珍,陈俊梅.乙型肝炎病毒前S1抗原与抗体的研究进展及临床应用[J].中华检验医学杂志,2011,34(8):761-763.
[4]徐 敏,曹向红,胡丽香,等.乙型肝炎患者血清IL-16含量与其抗原抗体模式及HBV-DNA载量的关系研究[J].检验医学与临床,2011,8(4):403-404.
[5]顾锡炳,杨小娟,王娟华,等.T淋巴细胞亚群及HBV特异性细胞毒性T淋巴细胞的变化在慢性乙型肝炎重症化中的意义[J].中华肝脏病杂志,2011,19(4):307-308.
[6]黄绍萍,王冯滨,王介非.重型肝炎并发真菌感染的细胞免疫状态[J].肝脏,2006,11(5):341-342.
[7]Bihl FK,Loggi E,Chisholm JV 3rd,et al.Simultaneous assessment of cytotoxic T lymphocyte responses against multiple viral infections by combined usage of optimal epitope matrices,anti-CD3 mAb T-cell expansion and"RecycleSpot"[J].J Transl Med,2005,3(1):20.
[8]陈 瑜,吴 炜,李兰娟.重型肝炎患者乙型肝炎病毒特异性细胞毒性T淋巴细胞应答功能研究[J].中华肝脏病杂志,2006,14(9):658-661.
[9]Chen J,Wang Y,Wu XJ,et al.Pegylated interferon α-2b up-regulates specific CD8+T cells in patients with chronic hepatitis B[J].World J Gastroenterol,2010,16(48):6145-6150.
[10]王 洪,周吉军,王宇明.MHC-表位肽四聚体技术在病毒性肝炎研究中的应用[J].世界华人消化杂志,2004,12(6):1432-1436.
[11]Gu XB,Yang XJ,Wang D,et al.Relationship between serum HBV DNA level and HBV-specific,nonspecific cytotoxic T lymphocytes and natural killer cells in patients with chronic hepatitis B[J].Chin Med J(Engl),2009,122(18):2129-2132.
[12]Koay LB,Feng IC,Sheu MJ,et al.Hepatitis B virus(HBV)core antigen-specific regulatory T cells confer sustained remission to anti-HBV therapy in chronic hepatitisB with acute exacerbation[J].Hum Immunol,2011,72(9):687-698.
[13]Gu X,Yang X,Wang D,et al.Comparison and significance ofspecificand non-specific cellular immunity in patients with chronic hepatitis B caused by infection with genotypes B or C of hepatitis B virus[J].Sci China C Life Sci,2009,52(8):719-723.
[14]Li X,Chen Y,Ma Z,et al.Effect of regulatory T cells and adherent cells on the expansion of HBcAgspecific CD8+T cells in patients with chronic hepatitis B virus infection[J].Cell Immunol,2010,264(1):42-46.
[15]Wang H,Su X,Zhang P,et al.Recombinant heat shock protein 65 carrying PADRE and HBV epitopes activates dendritic cells and elicits HBV-specific CTL responses[J].Vaccine,2011,29(12):2328-2335.
[16]陈 瑜,李兰娟,楼 滨,等.组织相容性抗原-肽四聚体流式细胞技术检测乙型肝炎患者特异性CD8+T 细胞[J].中华检验医学杂志,2004,27(4):221-223.
[17]姚永良.流式技术测定乙型肝炎患者外周血特异性CD8+T细胞及其临床意义[J].中华实验和临床病毒学杂志,2010,24(6):476-478.