啤酒糟蛋白水解物对金黄色葡萄球菌抑菌能力研究
宗绪岩李 丽罗惠波刘长江
(1.四川理工学院生物工程学院,四川 自贡 643000;2.沈阳农业大学食品学院,辽宁 沈阳 110161)
啤酒糟蛋白水解物对金黄色葡萄球菌抑菌能力研究
宗绪岩1李 丽1罗惠波1刘长江2
(1.四川理工学院生物工程学院,四川 自贡 643000;2.沈阳农业大学食品学院,辽宁 沈阳 110161)
选择4种蛋白酶制备出不同时间水解的啤酒糟蛋白水解物,分别检测其对金黄色葡萄球菌的抑菌能力。结果表明:采用Flavourzyme水解180 min的水解物具有较好的抑制金黄色葡萄球菌的能力;采用聚酰胺柱层析、离子交换柱层析方法及凝胶柱层析方法对水解物进行分离测定,得到分子量约为1 877.67的啤酒糟多肽样品,其对于金黄色葡萄球菌的最小抑菌浓度为2%。
啤酒糟;蛋白酶;抗菌肽;抑菌能力;多肽
抗菌肽原有的意思是指存在于生物体内具有抵抗外界微生物侵害,并能消除体内突变细胞的一类小分子多肽[1]。这类活性多肽多数具有热稳定性、耐强碱性以及广谱性等特点[2]。最初发现这类活性多肽对细菌具有杀菌活性,因而命名为抗菌肽,其原意为抗细菌肽。
近来的研究[3]发现使用蛋白酶水解食物蛋白也能产生出有效的抗菌肽:Malkoski等[4]从酪蛋白的酶解产物中分离得抗菌肽;夏庆和薛正莲[5,6]采用胰蛋白酶对酪蛋白进行水解试验,得到了具有较强抑菌效果的产物;Daoud等[7]用胃蛋白酶酶解牛血色素,得到有抗菌活性的肽;McCann等[8]用胃蛋白酶水解牛乳酪蛋白得到2个具有抗菌活性的肽;又用凝乳酶酶解牛乳酪蛋白得到抗菌肽[9];Pellegrini等[10]发现用胰蛋白酶或胰凝乳蛋白酶酶解鸟蛋蛋清中的卵清蛋白后的产物具有抗菌活性;Adham等[11]从鸡蛋溶菌酶中获得一种抗菌肽;Liu等[12]用碱性蛋白酶和菠萝蛋白酶水解牡砺后得到——含半胱氨酸的抗菌肽。
本试验采用4种食品级商用蛋白酶对啤酒糟蛋白进行水解,并监测了不同水解时间水解物对于金黄色葡萄球菌的抑菌能力,然后采用柱层析的方法对于活性较高的水解物进行了分离测定,旨在制备较纯的抑菌活性肽。
1 材料与方法
1.1 材料与试剂
啤酒糟蛋白:实验室参照文献[13]的方法制备;
蛋白酶 Alcalase 2.4L FG、Flavourzyme 500 MG、Neutrase 0.8L、Protamax:诺维信(中国)生物技术有限公司;
革兰氏阳性菌——金黄色葡萄球菌 (Staphylococcus aureus):沈阳农业大学食品学院微生物实验室;
聚酰胺、DEAE-52、Sephadex G-50、铬酸钾、还原型谷胱甘肽、氧化型谷胱甘肽、维生素B12、Nisin:均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
高速冷冻离心机:CR21G,Hitachi High-Technologies Corporation;
电子精密天平:BP210S,德国Sartorius AG公司;
酸度计:PHS-25型,上海雷磁仪器厂。
1.3 试验方法
1.3.1 菌种活化 将融化的培养基装入试管,灭菌后摆斜面。在无菌条件下用划线法将供试菌种移接入相应的斜面培养基上,于37℃培养18~24 h,进行菌种斜面活化[14]。
1.3.2 供试菌株悬浮液的制备 将活化好的菌种,在无菌条件下,每种分别挑取两环菌苔,各用无菌水稀释,制成含107~108CFU/m L菌悬液[15]。
1.3.3 管碟法测定抑菌能力 参照文献[16]的方法,并稍有改进。在无菌条件下,在9 cm的培养皿中加入15 m L培养基,冷却并使琼脂表面干燥,用移液器吸取菌悬液0.5 m L,加入到培养皿上,用涂布器涂布均匀,于每碟中以等距放置牛津杯4只,样品溶解过滤除菌后,取50μL在牛津杯中点样,点样后的平板于37℃培养24 h,比较抑菌效果。
1.3.4 最低抑菌浓度(MIC)测定 参考文献[17]并略有修改:将培养基熔化,然后定量地加入抑菌剂溶液,使提取物的浓度分别达到4%,2%,1%,0.5%,0.25%,0.125%,对照样中分别加入等量的无菌水、氯仿、70%乙醇,充分混合均匀,倾注于平皿中。待培养基冷却后,加入供试菌液,并用涂布器将供试菌液均匀涂于培养基表面,倒置在37℃下培养24 h,观察平皿中菌体的生长情况,从无菌生长的培养基中找出对应的最低的提取物浓度,即为该抑菌剂的最低抑菌浓度(MIC)。
1.3.5 蛋白酶水解条件 参考 Ren等[18]的方法,在200 g样品中加入1 000 g去离子水后10 000 r/min均质1 min,混合液等分成4份。用NaOH将调整各份至所需p H,再放入水浴摇床加热到所需温度后,添加6.0×104U蛋白酶同时开始计时,反应过程维持恒定温度,定时监测p H并添加NaOH使溶液p H恒定不变,记录碱液消耗量,换算成DH值,按时间取样1 m L沸水浴灭酶10 min后测定抑菌效果的变化,并以此确定较优的水解用酶和较适宜的水解条件[19]。酶水解啤酒糟蛋白时具体酶解参数见表1。
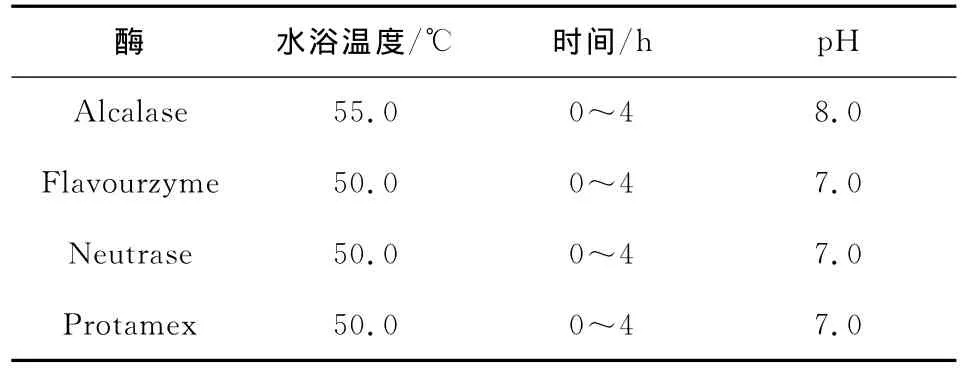
表1 酶水解啤酒糟蛋白参数Table 1 Parameters for enzymatic hydrolysis of BSG protein
1.3.6 聚酰胺柱层析 根据文献[20],精确称取一定量样品干粉,溶于少量去离子水中,采用湿法上柱,缓慢加注于聚酰胺柱表面,待样品完全渗入到固定相中时,依次加入缓冲溶液及添加了浓度分别为 0.1%,0.2%,0.3%,0.4%,0.5%,0.6%,0.7%,0.8%,0.9%的 NaCl的缓冲溶液,进行步进式洗脱。控制洗脱液流速在1.0 m L/min,用紫外检测器在280 nm波长下检测流出液的吸光值,并收集测定其抑菌能力。
1.3.7 离子交换层析 根据文献[20],精确称取一定量样品干粉,溶于少量去离子水中,采用湿法上柱,缓慢加注于离子交换柱表面,待样品完全渗入到固定相中时,依次加入缓冲溶液及添加了浓度分别为0.1%,0.2%,0.3%,0.4%,0.5%,0.6%,0.7%的 NaCl的缓冲溶液,进行步进式洗脱。控制洗脱液流速在1.0 m L/min,用紫外检测器在280 nm波长下检测流出液的吸光值,并收集测定其抑菌能力。
1.3.8 Sephadex G-50凝胶层析 分别将铬酸钾、还原型谷胱甘肽、氧化型谷胱甘肽、维生素B12及Nisin按照样品测定的方法进行上样和洗脱,记录洗脱时间,并绘制出洗脱时间与分子量之间的标准曲线,按照洗脱时间换算出样品的分子量大小[21,22]。
2 结果与讨论
2.1 水解度与抑菌能力的比较
对于金黄色葡萄球菌(革兰氏阳性菌)的抑菌试验:Alcalase水解啤酒糟蛋白的水解物未见抑菌效果出现;Flavourzyme水解啤酒糟蛋白120 min时即出现抑菌效果,并维持至酶解进行到240 min,其中在水解180 min时出现了明显的抑菌效果;Neutrase水解啤酒糟蛋白的酶解物未发现抑菌效果;Protamax水解啤酒糟蛋白120 min时出现抑菌效果,但在酶解进行到150 min时其抑菌效果消失,在水解进行到210 min时抑菌效果再次出现,并在水解240 min时再次消失。
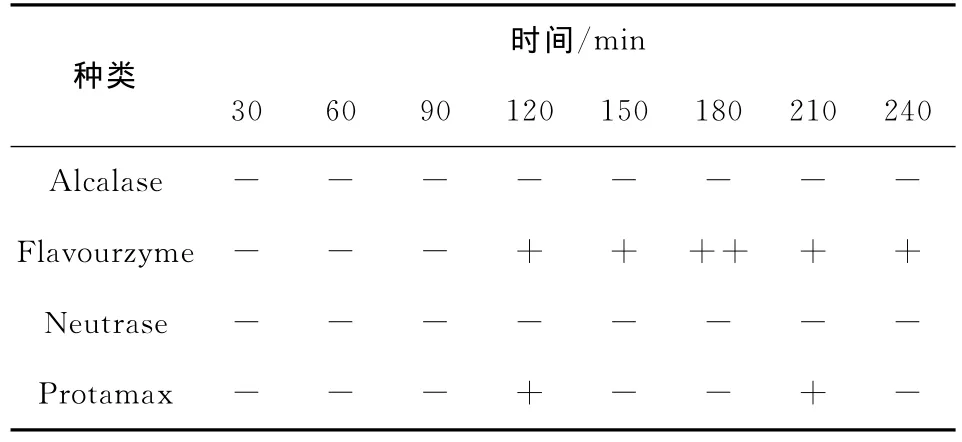
表2 不同蛋白酶水解啤酒糟蛋白的水解度和抑菌能力+Table 2 DH of BSG protein treated with various enzymes and antimicrobial activity of hydrolysate
图1为不同蛋白酶酶解180 min时4种酶解液分别对指示菌——金黄色葡萄球菌的抑菌效果图。
由以上试验数据和分析可知,对于金黄色葡萄球菌的抑菌效果较好的是Flavourzyme水解啤酒糟蛋白180 min的酶解物。蛋白酶解物的抑菌效果同其水解程度呈现不完全对应关系,这可能是因为在水解进行的初期,随着水解度的增加,溶液中可溶性蛋白类物质量的增加,同时具有抑菌效果的组分含量也增加,因此出现抑菌效果;随着水解的继续进行,溶液中某些具有抑菌效果的蛋白类物质受到蛋白酶的水解作用,某些具有抑菌效果的基团或结构被蛋白酶破坏或者是蛋白类物质的氨基酸序列发生改变,造成其抑菌效果丧失;有些情况抑菌效果随时间延长消失后会再次出现,这可能是由于随着水解的进行,某些具有抑菌能力的蛋白类物质或含有抑菌能力基团的多肽被水解溶出,也有可能是因为溶液中蛋白类物质被酶作用后,具有抑菌效果的基团或结构再次暴露或出现。
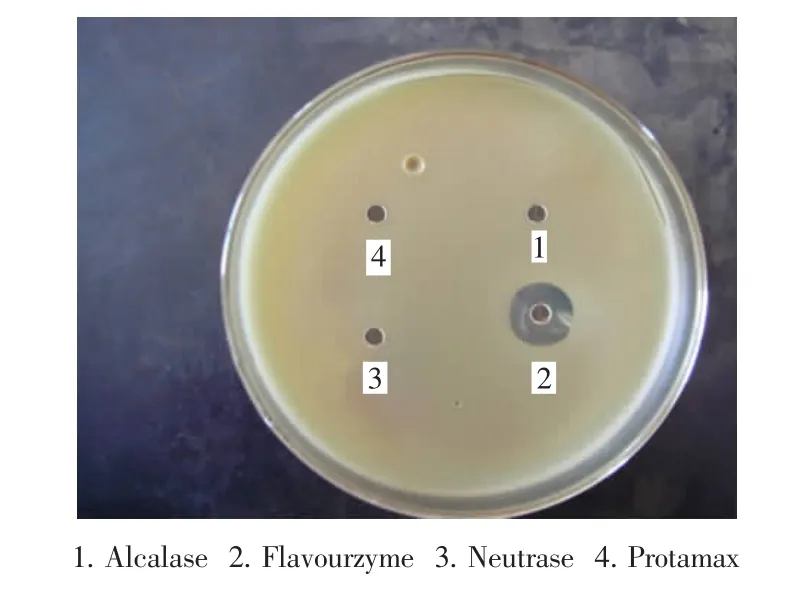
图1 酶解180 min酶解液对金黄色葡萄球菌的抑菌图Figure 1 Enzymatic hydrolysis of 180 min on the inhibition of Staphylococcus aureus
制备Flavourzyme水解啤酒糟蛋白180 min的酶解物,冷冻干燥后备用,并分别将其命名为BSG-F3。
2.2 聚酰胺柱层析
将啤酒糟多肽样品BSG-F3干粉溶解后湿法上柱,采用步进式洗脱方式洗脱,洗脱液分别为缓冲溶液及添加了浓度分别为0.1%,0.2%,0.3%,0.4%,0.5%,0.6%,0.7%的NaCl缓冲溶液,洗脱液流速控制在1.0 m L/min,以洗脱时间为横轴,以280 nm下流出液的吸光值及还原力为纵轴,绘制曲线图2。
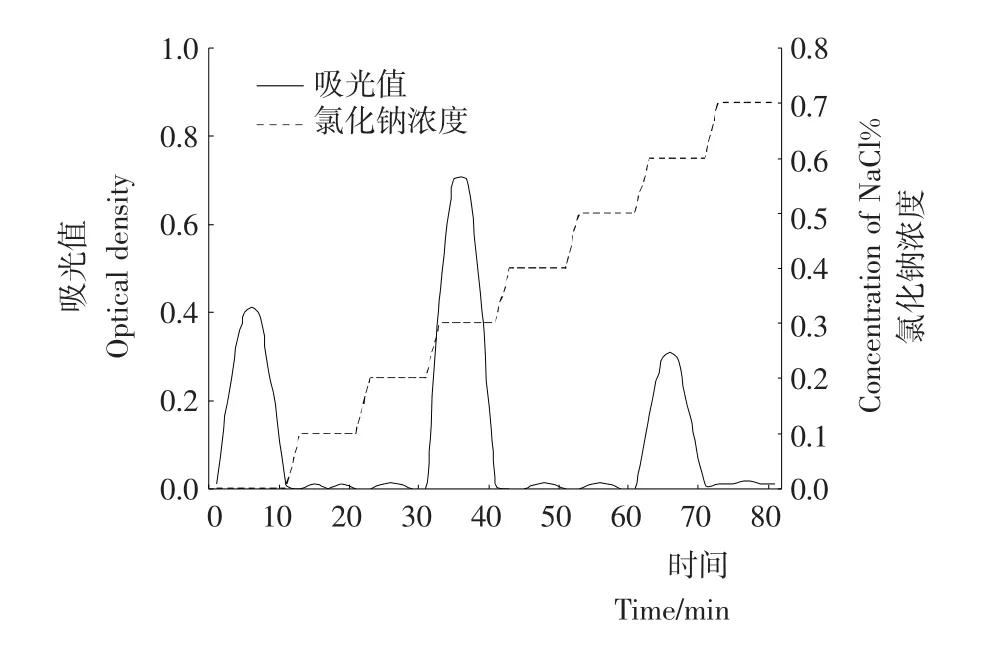
图2 聚酰胺层析洗脱曲线Figure 2 Elution curves of polyamide chromatography
由图2可知,用缓冲液、添加0.3%的NaCl的缓冲溶液及添加0.6%的NaCl的缓冲溶液洗脱时,均有洗脱峰出现,收集各峰组分,冷冻干燥然后进行抑菌活力测定,其中0.3%的NaCl溶液洗脱后的流出液抑菌效果最好,收集此组分冷冻干燥,进行后续试验,并命名为BSG-F3-3。
2.3 离子交换层析
用缓冲液将啤酒糟多肽样品BSG-F3-3干粉溶解后湿法上柱,采用步进式洗脱方式进行洗脱,洗脱液分别为缓冲溶液及添加了浓度分别为0.1%,0.2%,0.3%,0.4%,0.5%,0.6%,0.7%的 NaCl的缓冲溶液,洗脱液流速控制在1.0 m L/min,以洗脱时间为横轴,以280 nm下流出液的吸光值及还原力为纵轴,绘制曲线图3。
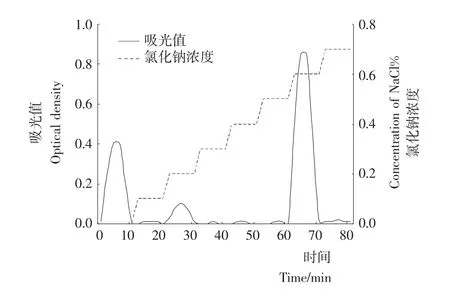
图3 离子交换层析洗脱曲线Figure 3 Elution curves of ion-exehange chromatography
由图3可知,用缓冲溶液、添加了0.2%的NaCl的缓冲溶液及添加了0.6%的NaCl的缓冲溶液洗脱时,均出现了洗脱峰,收集各峰组分,冷冻干燥然后进行抑菌活力测定,其中添加了0.6%的NaCl的缓冲溶液洗脱后的流出液抑菌效果最好,收集此组分冷冻干燥,进行后续试验,将该组分命名为 BSG-F3-3-6。
2.4 凝胶柱层析
将溶胀处理好的Sephadex G-50凝胶悬浮液缓慢倾入层析柱,待凝胶颗粒沉降后用缓冲液洗涤层析柱至稳定和平衡。将铬酸钾、还原型谷胱甘肽、氧化型谷胱甘肽、维生素B12及Nisin的干粉分别溶于少量的缓冲液中,分别上样并记录洗脱时间,再绘制出洗脱时间与分子量之间的标准曲线。再将啤酒糟多肽样品BSG-F3-3-6溶解后上样、测定并记录洗脱时间,按照样品的洗脱时间计算出样品的分子量大小。标准物质的分子量与洗脱时间关系见表3。
以洗脱时间为自变量,分子量的对数为因变量,拟合曲线,得到如下方程:
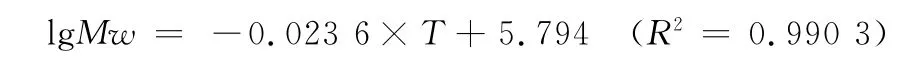
试验中啤酒糟多肽样品BSG-F3-3-6洗脱时只出现一个单峰,其洗脱时间为106.8 min,通过拟合曲线计算其分子量约为1 877.67。
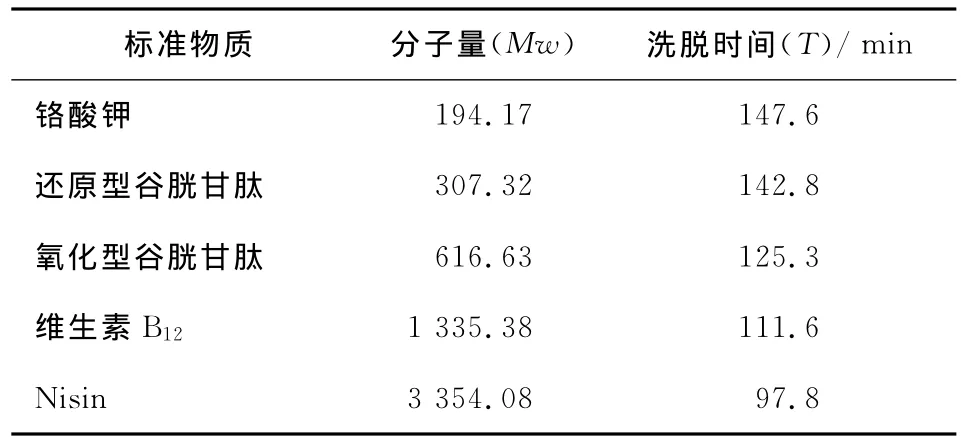
表3 标准物质的分子量与洗脱时间Table 3 Molecular weight and elution time of control sample
2.5 最小抑菌浓度测定
将不同剂量的啤酒糟多肽样品BSG-F3-3-6分别添加到60℃左右的培养基中,混合均匀后倾倒平板,待培养基冷却后加入金黄色葡萄球菌培养液,涂布均匀后倒置培养,观察发现含有1%啤酒糟多肽样品BSG-F3-3-6的培养皿中开始有菌落生成,并随着培养基中啤酒糟多肽样品BSG-F3-3-6添加量的减少,菌落数逐渐增多,但在含有2%啤酒糟多肽样品BSG-F3-3-6的3个培养皿中有一个出现了两个菌落,重复此浓度进行试验无此现象,因此可以认定啤酒糟多肽样品BSG-F3-3-6对于金黄色葡萄球菌的最小抑菌浓度为2%。
3 结论
通过测定不同蛋白酶水解啤酒糟蛋白不同时间所生成的啤酒糟多肽样品的抑菌能力,发现Flavourzyme酶解啤酒糟蛋白180 min的酶解液对金黄色葡萄球菌具有较好的抑菌效果。
使用p H为7.0的洗脱液,添加0%~0.7%NaCl溶液采用步进式洗脱聚酰胺层析柱,并收集含0.3%NaCl洗脱液洗脱下的具有最大抑菌效果的组分。再使用p H为8.0的洗脱液,添加0%~0.7%NaCl采用步进式洗脱离子交换层析柱(DEAE-Cellulose),并收集含0.6%NaCl洗脱液洗脱下的具有最大抑菌效果的组分。并采用Sephadex G-50凝胶柱层析方法测定其分子量约为1 877.67。分离得到的啤酒糟多肽样品BSG-F3-3-6对于金黄色葡萄球菌的最小抑菌浓度为2%。
1 申吉泓.抗菌肽作用机制研究现状[J].国外医学肿瘤学分册,2003,30(5):347~349.
2 田晓乐.林蛙抗菌肽的制备与制剂研究[D].长春:吉林大学,2004.
3 黎观红,张锦华,瞿明仁,等.乳酪蛋白源抗菌肽——结构、功能及应用[J].中国食品添加剂,2010(3):207~214.
4 Malkoski M,Dashper S G,O'Brien-Simpson N M,et al.Kappacin,a novel antibacterial peptide from bovine milk[J].Antimcrob Agents Chemother,2001,45(8):2 309~2 315.
5 夏庆,薛正莲.胰蛋白酶水解酪蛋白所得产物抗菌活性的研究[J].安徽工程科技学院学报,2007,22(1):23~26.
6 祝骥,高飞,易喻,等.抗菌肽的研究进展[J].生命科学,2008,20(4):605~610.
7 Daoud R,Dubois V,Bors-Dodita L,et al.New antibacterial peptide derived from bovine hemoglobin[J].Peptides,2005,26(5):713~719.
8 McCann K B,Shiell B J,Michalski W P,et al.Novel antibacterial peptide derived from bovine aS1-casein[J].Australian J.Dairy Technol.,2003,58(2):199.
9 McCann K B,Shiell B J,Michalski W P,et al.Isolation and characterisation of antibacterial peptides derived from the f(164-207)region of bovine aS2-casein[J].International.Dairy J.,2005,15(2):133.
10 Pellegrini A,Hülsmeier A J,Hunziker P,et al.Proteolytic fragments of ovalbumin display antimicrobial activity[J].Biochim Biophys Acta.,2004,1 672(2):76~85.
11 Adham M,Abdou S,Higashiguchi A M,et al.Antimicrobial peptides derived from hen egg lysozyme with inhibitory effect against Bacillus species[J].Food Control.,2007,18(2):173~178.
12 Liu Z Y,Dong S Y,Xu J,et al.Production of cysteine-rich antimicrobial peptide by digestion of oyster(Crassostrea gigas)with alcalase and bromelin[J].Food Control.,2008,19(3):231~235.
13 宗绪岩,刘长江,李丽,等.蛋白酶水解啤酒糟蛋白动力学研究[J].食品工业科技,2009,30(12):108~112.
14 刘华英.北五味子木脂素提取工艺及提取物抑菌作用的研究[D].长春:吉林农业大学,2006.
15 李斌,孟宪军,薛雪,等.北五味子乙素清除自由基及体外抑菌作用的研究[J].食品科学,2011,32(5):79~82.
16 刘玉楼,贺微.滴样时间对抗生素管碟法含量测定的影响[J].黑龙江医药,2004,17(3):181~182.
17 Ji L L,Tan R X.Antimicrobial activities of maize silk extracts against food spoilage and food-borne pathogens[J].Life Science Research,2001,5(1):68~72.
18 Ren J Y,Zhao M M,Shi J,et al.Optimization of antioxidant peptide production from grass carp sarcoplasmic protein using response surface methodology[J].LWT-Food Science and Technology,2008,41(9):1 624~1 632.
19 宗绪岩,刘长江,李丽,等.啤酒糟蛋白抗氧化肽的酶法制备及其体外抗氧化活力[J].沈阳农业大学学报,2010,41(2):231~234.
20 宗绪岩.啤酒糟蛋白提取、改性及酶解产物活性研究[D].沈阳:沈阳农业大学,2010.
21 Liu L J,Zhu C H,Zhao Z.Analyzing molecular weight distribution of whey protein hydrolysates[J].Food and Bioproducts Processing,2008,86(1):1~6.
22 薛培宇.牛乳酪蛋白抗菌肽的制备及其抗菌活性研究[D].长春:吉林大学,2011.
Antibacterial activity ofstaphylococcus aureushydrolyzed from brewer's spent grains protein
ZONG Xu-yan1LI Li1LUO Hui-bo1LIU Chang-jiang2
(1.College of Bioengineering,Sichuan University of Science & Engineering,Zigong,Sichuan643000,China;2.Food Science College of Shenyang Agriculture University,Shenyang,Liaoning110161,China)
Four proteases were used in different hydrolysis time and hydrolysis’s antibacterial ability was detected.The results showed:hydrolysis has better inhibition ability ofStaphylococcus aureuswith Flavourzyme in 180 min.Peptides was separated and tested with polyamide column chromatography,ion exchange column chromatography,and gel column chromatography.Molecular weight is about 1 877.67.The minimal inhibitory concentration forEscherichia coliwas 2%.
brewer's spent grains;protease;antimicrobial peptides;antibacterial activity;peptides
10.3969/j.issn.1003-5788.2012.01.027
酿酒生物技术及应用四川省重点实验室开放基金项目(编号:NJ2010-12);四 川 理 工 学 院 科 技 项 目 (编 号:2010XJKRL002)
宗绪岩(1976-),男,四川理工大学讲师,博士。E-mail:13881410277@139.com
罗惠波
2011-10-30

