六味地黄汤对5/6肾切除大鼠肾组织中细胞外基质的影响
唐 群 ,何泽云*,徐文峰 ,陈 丽 ,徐 琴 ,曾海飞 ,张爽爽
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007)
六味地黄汤对5/6肾切除大鼠肾组织中细胞外基质的影响
唐 群1,何泽云2*,徐文峰1,陈 丽1,徐 琴1,曾海飞1,张爽爽1
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007)
目的 观察六味地黄汤对慢性肾衰大鼠肾组织细胞外基质的影响,探讨其防治肾间质纤维化的可能机制。方法 用5/6肾切除大鼠复制慢性肾衰模型,分空白对照组、假手术组、模型组和六味地黄汤组。术后8周,检测各组肾功能指标;HE染色观察肾脏组织病理变化,Masson染色检测肾脏中胶原纤维沉积;免疫组化法检测ColⅠ、ColⅢ、FN在肾组织中的表达;Western blot法检测PDGF-A、PDGF-B在肾组织中的蛋白表达水平。结果 与假手术组比较,模型组24 h尿蛋白、血尿素氮和血肌酐明显升高(P<0.01);与模型组比较,六味地黄汤组24 h尿蛋白(P<0.01)、血尿素氮(P<0.01)和血肌酐(P<0.05)均明显降低。模型组HE和Masson染色显示大鼠肾间质纤维化明显,大量胶原纤维沉积,六味地黄汤组肾间质纤维化程度明显减轻,少量胶原纤维沉积。免疫组化法显示,与假手术组比较,模型组肾组织中ColⅠ、ColⅢ、FN蛋白水平均明显升高(P<0.01);与模型组比较,六味地黄汤组肾组织中ColⅠ、ColⅢ、FN蛋白水平均明显降低(P<0.05)。Western blot法显示,与假手术组比较,模型组肾组织中PDGF-A、PDGF-B蛋白水平均明显升高(P<0.01);与模型组比较,六味地黄汤组肾组织中PDGF-A、PDGF-B蛋白水平均明显降低(P<0.01)。结论 六味地黄汤可能通过下调PDGF-A、PDGF-B表达,从而减少肾组织中细胞外基质的积聚而抑制肾间质纤维化。
肾间质纤维化;5/6肾切除;细胞外基质;大鼠;六味地黄汤;熟地黄;山药;山茱萸
六味地黄汤是临床上治疗肾阴虚证型慢性肾小球肾炎的有效方剂[1]。近年来研究发现,肾间质纤维化(renal interstitial fibrosis,RIF)是各种原因导致的进行性肾脏疾病最重要的病理特点,细胞外基质(extracellular matrix,ECM)的沉积是肾间质纤维化的主要病变基础。 I型胶原(Collagen type I,Col I)、Ⅲ型胶原(Collagen typeⅢ,ColⅢ)及纤维连接蛋白(fibronectin,FN)是ECM的主要成分。血小板源性生长因子-A(PDGF-A)和血小板源性生长因子-B(PDGF-B)是经典的血小板源性生长因子(platelet-derived growth factor,PDGF) 存在形式[2]。PDGF可促进ECM合成增多、降解减少,因此与肾间质纤维化关系密切[3-5]。本研究采用5/6肾切除制作慢性肾功能衰竭大鼠模型,观察六味地黄汤对5/6肾切除大鼠肾组织中ECM的影响,探讨六味地黄汤防治肾间质纤维化的作用机制。现将实验方法及结果报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级雄性SD大鼠40只,体质量(200±10)g,由湖南中医药大学实验动物中心提供并饲养于湖南中医药大学SPF级动物房。动物合格证号:SCXK(湘)2009-0001。
1.1.2 药物 六味地黄汤(熟地黄24 g,山药12 g,山茱萸 12 g,泽泻 9 g,茯苓 9 g,牡丹皮 9 g)购自湖南中医药大学第一附属医院药剂科。先将药材用相当于药材5倍质量的自来水浸泡2 h煮沸后再微火煎熬30min,过滤后收集煎液,原药渣加少量水再煎煮1次,滤过。将2次煎液合并,于水浴恒温器上浓缩至每毫升药液含生药1 g。
1.1.3 试剂 一抗为兔抗大鼠 ColⅠ、ColⅢ、FN、PDGF-A、PDGF-B 多克隆抗体(美国 Santa Cruz),兔二步法免疫组化检测试剂盒(PV-6001);二抗为生物素标记山羊抗兔IgG(北京中杉金桥);DAB显色试剂盒(武汉博士德);ECL化学发光试剂(美国Pierce)。
1.1.4 仪器 SHANDON FINESSE325型石蜡切片机(英国珊顿公司);Motic BA410T生物显微镜(德国);显微形态分析系统 (北京麦克奥迪);MultiphorII Nova Blot(玛西亚生物技术);PROTEAN II Xi Cell(美国 BIO-RAD);垂直电泳槽(美国 Hoefer公司);微量加样器(北京吉尔森公司)。
1.2 方法
1.2.1 动物造模 SD大鼠适应性喂养1周后随机分为空白对照组、假手术组、模型组、六味地黄汤组4组,每组10只。模型组、六味地黄汤组均在无菌条件下进行5/6肾切除术,以10%水合氯醛0.3 mL/100 g腹腔注射麻醉大鼠,常规消毒铺巾,从左腹部切口,打开腹腔,静脉夹夹住肾蒂后切除左肾上下极(切除2/3),以明胶海绵压迫止血,复位肾脏。1周后进行第2次手术,切除右侧肾脏。假手术组采取同样步骤,打开腹腔暴露肾脏后避免牵拉肾脏,不切除肾脏。
1.2.2 给药方法 造模后第2天,六味地黄汤组予以六味地黄汤浸膏灌胃,给药剂量均按70 kg成人的体表面积换算,灌胃量为 3.2 g/(kg·d)。空白对照组、假手术组和模型组以等容积蒸馏水灌胃,灌胃量为 10 mL/(kg·d)。每天 1 次,连续 8 周。各组大鼠灌胃中途死亡者予以剔除。
1.2.3 标本收集 各组大鼠分别于第8周后处死,处死前收集24 h尿量,酶联免疫吸附法(ELISA)检测24 h尿白蛋白(24 h UAlb)。腹主动脉采血分离血清,酶法测定血肌酐(Scr)浓度,尿素酶-GLDH法测定尿素氮(BUN)浓度。肾组织分为两部分处理:(1)光镜观察。标本用4%多聚甲醛固定,分别进行HE染色、Masson染色及免疫组化检测。(2)肾组织取出后立即放入液氮罐中,随后转入-80℃冰箱保存待用。
1.2.4 肾脏组织学检查 肾组织经4%多聚甲醛固定,梯度乙醇脱水、二甲苯透明、石蜡包埋、切片(厚度为3~4μm)后,分别进行HE染色及Masson染色,Olympus显微镜观察并拍照。
1.2.5 免疫组织化学法检测 免疫组化采用兔二步法检测试剂盒 (PV-6001),一抗用兔抗大鼠ColⅠ(1∶200)、Col Ⅲ(1∶200)、FN(1∶200)抗体,二抗用相应羊抗兔抗体 (工作浓度按产品说明书配制为1∶100),染色呈棕褐色或棕黄色者为阳性染色。显微镜下观察每张切片并随机选取5个视野,用麦克奥迪数码医学分析系统(Motic Med 6.0)进行图像分析。测定视野内阳性细胞的平均灰度值,以灰度值进行定量分析,测得组织细胞平均灰度值愈小,其蛋白水平愈高。
1.2.6 Western blot法检测 常规提取蛋白质样品,BCA法进行蛋白质定量。每泳道50 μg蛋白,10%十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分离后湿转至PVDF膜,封闭,分别加一抗PDGF-A(1∶300)、PDGF-B(1∶300),4 ℃孵育过夜,洗膜。加相应二抗(1∶100)室温孵育,ECL试剂X线底片上显色。扫描测定条带密度值,以与β-actin的比值作为表达强度。
1.3 统计学分析
采用SPSS 18.0统计软件进行处理分析,计量资料用“”表示,多样本均数间比较用单因素方差分析检验,P<0.05为差异有统计学意义。
2 结果
2.1 六味地黄汤对5/6肾切除大鼠肾脏功能的影响
空白对照组与假手术组之间肾功能比较,差异无统计学意义(P>0.05);与假手术组比较,模型组24 h尿白蛋白、血尿素氮和血肌酐均显著升高(P<0.01);与模型组比较,六味地黄汤组24 h尿白蛋白(P<0.01)、尿素氮(P<0.01)和血肌酐(P<0.05)均显著降低。见表1。
表1 六味地黄汤对5/6切除大鼠肾脏功能的影响 ()

表1 六味地黄汤对5/6切除大鼠肾脏功能的影响 ()
注:与假手术组比较 **P<0.01;与模型组比较△P<0.05,△△P<0.01。
组 别空白对照组假手术组模型组六味地黄汤组n 101079药物剂量(g/kg)蒸馏水蒸馏水蒸馏水3.224 h UAlb(mg)4.43±0.803.60±1.4022.12±1.05**19.08±2.02**△△BUN(mmol/L)5.40±0.996.49±0.9813.54±1.33**11.66±1.20**△△SCr(μmol/L)56.30±5.0659.60±5.8287.42±6.92**77.44±5.68△
2.2 六味地黄汤对5/6肾切除大鼠肾组织形态学的影响
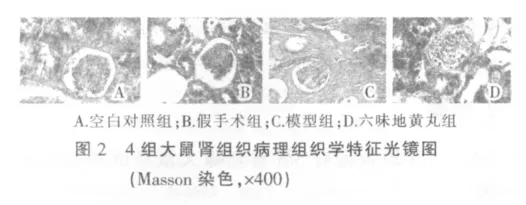
HE染色下,空白对照组及假手术组大鼠肾组织未见明显病变,肾小球和肾小管大小、形态正常,结构清晰,间质未见明显炎细胞浸润。模型组肾皮质变薄,肾小球系膜细胞明显增生,硬化增多,部分肾小管明显萎缩、消失,部分肾小球发生代偿性肥大,肾小管发生代偿性扩张,部分可见蛋白管型,间质纤维组织增生,大量淋巴细胞浸润。与模型组相比,六味地黄汤组病变程度明显减轻,肾小球硬化减少,肾小管萎缩及间质纤维化程度减轻,炎细胞浸润减少(图1)。Masson染色下,空白对照组及假手术组仅肾小球和肾小管基底膜染成蓝色,肾间质无明显胶原纤维。模型组肾间质见大量染成蓝色的胶原纤维。六味地黄汤组肾间质可见少量胶原纤维(图2)。

2.3 六味地黄汤对5/6肾切除大鼠肾组织ColⅠ、ColⅢ和FN表达的影响
2.3.1 ColⅠ的表达 假手术组微表达,模型组和六味地黄汤组表达增加,尤以远曲小管表达最明显,肾小球及肾间质相对较弱,六味地黄汤组较模型组表达减弱(图 3)。
2.3.2 ColⅢ的表达 假手术组、六味地黄汤组和模型组均有表达且依次增强,主要在肾小管,尤其是远曲小管最为明显,肾小球和肾间质表达相对较弱(图 4)。
2.3.3 FN的表达 肾小球、肾小管及肾间质中均有表达,其中以远曲小管最为明显,组间相比,以模型组最强,六味地黄汤组次之,假手术组最弱(图 5)。



2.3.4 各组肾组织ColⅠ、ColⅢ、FN表达半定量分析 肾组织ColⅠ、ColⅢ、FN表达均以模型组最强,六味地黄汤组次之,假手术组最弱。与假手术组比较,模型组ColⅠ、ColⅢ、FN表达均明显增加,差异有统计学意义(P<0.01);与模型组比较,六味地黄汤组ColⅠ、ColⅢ、FN表达均明显降低,差异有统计学意义(P<0.05)。 见表 2。
表2 3组肾组织ColⅠ、ColⅢ、FN表达免疫阳性部分半定量分析 ()

表2 3组肾组织ColⅠ、ColⅢ、FN表达免疫阳性部分半定量分析 ()
注:与假手术组比较**P<0.01;与模型组比较△P<0.05。
组 别假手术组模型组六味地黄汤组n 1079 ColⅠ230.5±24.5134.3±11.4**162.8±10.7△ColⅢ216.4±12.4132.2±17.2**174.0±16.3△FN 229.4±17.9148.4±21.4**182.8±15.7△
2.4 六味地黄汤对5/6肾切除大鼠肾组织PDGFA、PDGF-B蛋白水平的影响
与假手术组比较,模型组和六味地黄汤组PDGF-A、PDGF-B蛋白水平均明显升高,且模型组与假手术组之间差异有统计学意义(P<0.01);六味地黄汤组PDGF-A、PDGF-B蛋白水平明显低于模型组,差异有统计学意义(P<0.01)。见图6~7。


3 讨论
慢性肾脏病 (Chronic kidney disease,CKD)是一种严重危害人类健康的泌尿系统疾病,未来20年,CKD导致终末期肾脏疾病 (end-stage renal disease,ESRD)的发生率将显著升高而成为一种流行病。肾间质纤维化是各种CKD发展到ESRD的共同途径,其主要病理改变表现为肾间质成纤维细胞增生和ECM过度积聚,是多种细胞、生长因子、细胞因子共同参与、相互作用,最终导致ECM合成增多、降解减少,过度沉积的结果[6]。
5/6肾切除大鼠是目前研究慢性肾脏病进展的理想动物模型。本研究模型组大鼠肾组织形态学改变、24h尿白蛋白、血尿素氮和血肌酐检测结果与慢性肾衰的表现基本一致,说明本实验制作的慢性肾功能衰竭模型是成功的。ECM是由细胞产生并分泌到细胞外周围中的物质,主要包括纤维成分(如胶原和弹性蛋白)、连接蛋白(如纤维连接蛋白等)和填充分子(如糖胺聚糖)等。正常的情况下,ECM的生成和降解保持动态平衡。肾脏局部缺血、缺氧及炎症细胞浸润时,多种生长因子持续表达导致肾间质成纤维细胞增生和ECM的沉积,其中PDGF与肾间质纤维化关系密切,其主要机制是能够促进肌纤维母细胞产生胶原[7],尤其是I型及Ⅲ型胶原,并通过抑制胶原酶活性[8],减少ECM 的降解,最终导致ECM合成增多、降解减少,过度沉积,形成纤维化。本研究发现模型组 PDGF-A、PDGF-B、ColⅠ、ColⅢ、FN蛋白水平均明显高于假手术组,提示PDGF-A、PDGF-B可能通过促进ColⅠ、ColⅢ、FN的合成与分泌,从而导致ECM在肾间质中过度沉积。
六味地黄汤始见于宋·钱乙的 《小儿药证直诀·卷下诸方》,以张仲景《金匮要略》的肾气丸减桂枝、附子,易干地黄为熟地黄而成,其临床治疗慢性肾脏病运用广泛,且疗效肯定,然其作用机制尚不完全明了。以往的研究已证实:5/6肾切除大鼠在手术后8周,留存肾不可避免地发生了间质纤维化[9];给5/6肾切除大鼠灌胃六味地黄汤8周后,其血清尿素氮、肌酐的水平明显低于模型组,并能减少留存肾系膜细胞的增生及间质纤维化,使肾切除大鼠生存期延长[10]。六味地黄汤具有改善5/6肾切除大鼠残肾肾功能的作用,其改善残肾肾功能的作用与六味地黄汤提高肾小球的体积密切相关[11]。在本研究中:与模型组比较,六味地黄汤组PDGF-A、PDGF-B、ColⅠ、ColⅢ、FN蛋白水平均明显降低。说明六味地黄汤可能通过下调PDGF-A、PDGF-B表达,从而减少肾组织中ECM(如ColⅠ、ColⅢ和 FN)的沉积而抑制肾间质纤维化。
[1]何泽云,徐元美.六味地黄丸治疗肾阴虚型慢性肾小球肾炎的临床研究[J].湖南中医学院学报,2004,24(1):35-37.
[2]Fredriksson L,Li H,Eriksson U.The PDGF family:four gene products form five dimeric isoforms[J].Cytokine Growth Factor Rev,2004,15(4):197-204.
[3]LeBleu VS,Kalluri R.Blockade of PDGF receptor signaling reducesmyofibroblastnumberand attenuatesrenalfibrosis[J].Kidney Int,2011,80(11):1119-1121.
[4]Li BX,Tang YT,Wang W,et al.Fluorofenidone attenuates renal interstitial fibrosis in the rat model of obstructive nephropathy[J].Mol Cell Biochem,2011,354(1-2):263-273.
[5]Liu WH,Tang NN,Zhang QD.Could mycophenolate mofetil combined with benazapril delay tubulointerstitial fibrosis in 5/6 nephrectomized rats[J].Chin Med J(Engl),2009,122(2):199-204.
[6]Razzaque MS,Taguchi T.Cellular andmoLecular events leading to renal tubulointerstitial fibrosis[J].Med Electron Microsc,2002,35(2):68-80.
[7]陈莲香,舒建昌.PDGF与肝纤维化关系的研究新进展[J].胃肠病学和肝病学杂志,2011,20(1):95-98.
[8]Si HF,Lv X,Guo A,et al.Suppressive effect of leflunomide on rat hepatic stellate cell proliferation involves on PDGF-BB-elicited activation of three mitogen-activated protein kinases[J].Cytokine,2008,42(1):24-31.
[9]何泽云,阳 晓.参麦注射液对5/6肾切除大鼠肾脏及腹膜形态结构的影响[J].中国中西医结合杂志,1998,18(9):553-555.
[10]何泽云,陈江华,李晓峰.六味地黄丸对肾切除大鼠肾小球化生的影响[J]. 湖南中医学院学报,2004,24(2):1-3.
[11]蔡惠芳,谭元生,何泽云,等.六味地黄丸对大鼠5/6肾切除肾功能的影响[J].湖南中医药大学学报,2007,27(2):17-19.
Effects of Liuwei Dihuang decotion on extracellular matrix of renal tissues in 5/6 nephrectomy rats
TANG Qun1,HE Ze-yun2,XU Wen-feng2,CHEN Li1,XU Qin2,ZENG Hai-fei2,ZHANG Shuang-shuang2
(1.TCM University of Hunan,Changsha,Hunan 410208,China;2.First Affiliated Hospital,TCM University of Hunan,Changsha,Hunan 410007,China)
renal interstitial fibrosis; 5/6 nephrectomy; extracellular matrix; rat; Liuwei Dihuang decotion; prepared Radix rehmanniae; Yam; Cornus
R285.5
A
10.3969/j.issn.1674-070X.2012.11.005.019.05
〔Absrract〕Objective To observe the influence of Liuwei Dihuang decotion on the extracellular matrix of renal tissue in rat model with chronic renal failure and study its mechanism of preventing renal interstitial fibrosis.Methods The rat model of chronic renal failure were induced by 5/6 nephrectomy,rats were divided into 4 groups as follows:blank control group,sham operation group,model group and Liuwei Dihuang decotion group.At 8 weeks after the operation,index of renalfunction wasdetected,the pathologicalchange ofrenaltissueswasobserved by HE stain,collagen deposition in renal was detected by Masson staini,the ColⅠ,Col Ⅲ,FN expression levels in renal tissues were examined by immunohistochemistry assay,the PDGF-A,PDGF-B proteinlevels in the renal tissues were examined by western blot assay.Results Compared with sham operation group,24h urinary protein,blood urea nitrogen and serum creatinine in model group were increased significantly(P<0.01).Compared with model group,24h urinary protein(P<0.01),blood urea nitrogen(P<0.01)and serum creatinine(P<0.05)in Liuwei Dihuang decotion group were decreased significantly.Renal interstitial fibrosis and collagen deposition were obvious in model group,and renal interstitial fibrosis and collagen fibers deposition were markedly reduced in Liuwei Dihuang decotion group.Compared with sham operation group,the ColⅠ,ColⅢ,FN protein levels of renal tissues in model group were significantly increased(P<0.01).And these proteins expression levels in Liuwei Dihuang decotion group were significantly lower than those in model group(P<0.05)。Compared with sham operation group,the PDGF-A,PDGF-B protein levels of renal tissues in model group were significantly increased(P<0.01).The expression levels of PDGF-A and PDGF-B proteins in Liuwei Dihuang decotion group were significantly lower than those in model group(P<0.01).Conclusion Liuwei Dihuang decotion may reduce the accumulation of extracellular matrix of renal tissues and prevent renal interstitial fibrosis through down-regulating the expression of PDGF-A and PDGF-B.
2012-06-15
湖南省自然科学基金(重点)资助项目(09JJ3064);湖南省高校创新平台(09K057)。
唐 群(1980-),男,湖南东安人,讲师,博士研究生,主要从事病理学教学、科研及中医药防治慢性肾脏病研究。
* 何泽云,男,教授,博士研究生导师,E-mail:hzywjl2003@yahoo.com.cn。
(本文编辑 彭芝配)

