交替冻融对东北地区典型土壤氮磷浓度的影响
胡钰,香宝 ,刘玉萍,汪太明,马广文,方广玲
1.中国环境科学研究院,北京 100012
2.国家环境保护区域生态过程与功能评估重点实验室,北京 100012
3.北京师范大学水科学研究院,北京 100875
4.黑龙江省环境保护科学研究院,黑龙江 哈尔滨 150056
5.中国环境监测总站,北京 100012
交替冻融(freeze-thaw cycles,FTC)是由于季节或昼夜温度变化在表土及以下一定深度形成的反复冻结-解冻的土壤过程,是中、高纬度地区和山地地区普遍存在的自然现象。我国东北地区位于中纬度,秋冬季节和初春存在明显的交替冻融过程。交替冻融会对土壤理化性质产生较大影响,能够改变土壤团聚体、营养元素含量[1-2],通过增加细胞透性,促进微生物群落转化和微生物的死亡分解[3-4]等多种方式影响微生物活动,改变土壤元素的生物地球化学循环过程,从而对土壤生态系统结构和功能产生影响[5]。交替冻融对土壤理化性质的影响主要取决于冻融速率、冻融温度、交替冻融的次数,以及土壤含水率、容重、质地等土壤自身的理化性质[6]。
土壤全氮和全磷在一定程度上代表了土壤的供氮和供磷水平,反映的是土壤中氮和磷的整体情况。土壤有效氮和速效磷反映的是短期内土壤的供氮和供磷水平,是评价土壤有效肥力的重要指标[7]。土壤腐殖质是在土壤中的微生物作用下有机物分解形成的特殊类型高分子有机化合物的混合物[8]。土壤松结态腐殖质是用稀碱液从土壤中提取出的腐殖质,主要包括游离有机质以及与活性铁铝氧化物结合的腐殖质,是参与土壤碳氮循环最活跃的腐殖质[9-10]。研究表明[11],冻融条件下土壤腐殖质的浓度及活性都会有所改变。因此,研究土壤氮磷各组分与腐殖质间的动态关系,对于理解交替冻融对土壤氮磷浓度变化的影响很有意义。笔者以东北三种典型土壤即黑土、水稻土、暗棕壤为对象,以土壤氮磷浓度变化为基础,通过模拟试验研究相同冻融速率、冻融温度,不同交替冻融次数下,土壤全氮、有效氮、全磷、有效磷组分及腐殖质的变化,以了解交替冻融次数对土壤中氮磷浓度的影响,及在交替冻融作用下,土壤中的氮磷浓度与腐殖质的关系。
1 材料与方法
1.1 材料
样品采集区位于黑龙江省哈尔滨市阿城区亚沟镇,于2010年7月上旬分别采集黑土、暗棕壤和水稻土三种土壤样品,各项指标如表1所示。采用对角线法均匀采集0~15 cm表层土壤,将采集的新鲜土壤样品迅速带回实验室,完全冻结2 d,然后进行室内交替冻融试验。

表1 三种土壤样品的各项指标Table 1 The index of the three soil samples
1.2 试验设计
将采集的黑土、暗棕壤和水稻土壤样品剔除草根及其他杂物后风干,混匀,分别平均分成7份。将土壤样品在-20℃下冷冻,待完全结冻(24 h)后在20℃下放置24 h使其完全融化,此为一个冻融周期。分别对未经冻融处理的原始样及冻融周期为1次、2次、4次、8次、10次、15次的土壤样品进行分析。为了模拟土壤交替冻融的实际情况,按照春季融雪期土壤含水率对样品进行水分校正。根据调研分析,春季融雪期黑土、暗棕壤和水稻土的含水率分别为27%、35%和41%,试验过程中不断补充失去的水分,保持试验土壤样品相应的水分条件恒定。处理后土壤样品经风干后,研磨,分别进行土壤全氮、有效氮、全磷、有效磷及松结态腐殖质的测试,每次试验均进行3个平行样的测定。
1.3 测定方法
将风干土壤样品过0.149 mm筛,取1.0 g(精确到0.0001 g)进行土壤全氮浓度分析,采用半微量凯氏法测定,土壤中全氮在硫酸铜、硫酸钾与硒粉的存在下,用浓硫酸消煮,使其转变为硫酸氨,然后用氢氧化钠碱化,加热蒸馏出氮,经硼酸吸收,用标准酸滴定其浓度;取0.25 g(精确到0.0001 g)土壤样品进行全磷浓度分析,以高氯酸-硫酸消化溶解土壤中的磷,采用钼锑抗比色法测定[7]。
将风干土壤样品过2 mm筛,取1.00~2.00 g用于有效氮浓度分析,采用碱解扩散法测定,在扩散皿中土壤于碱性条件下进行水解,使易水解态氮经碱解转化为氨态氮,扩散后由硼酸溶液吸收,用标准酸滴定,计算有效氮浓度。取5.0 g(精确到0.01 g)土壤样品用于有效磷浓度分析,采用盐酸-硫酸浸提,用0.05 mol/L盐酸和0.025 mol/L硫酸的双酸浸提液50 mL振荡浸提土壤样品,使土壤中活性较高的磷酸铁、铝盐陆续被溶解释放,用钼锑抗比色法测定有效磷浓度[7]。
土壤松结态腐殖质的提取与表征[12],采用0.1 mol/L NaOH溶液提取土壤中的松结态腐殖质,将浸提液在4000 r/min下离心15 min,取上清液,上清液通过0.45μm玻璃纤维滤膜(Whatman GF/F)过滤,滤液即为松结态腐殖质溶液,成分为胡敏酸和富里酸。采用TOC-VCPH测定仪(岛津公司,日本)测定溶液的TOC,以此来表征土壤松结态腐殖质的量。
1.4 数据分析
数据使用 Excel 2003、Origin 7.5、SPSS 16.0 软件进行统计分析,3个平行样品结果计算标准误差,土壤氮磷浓度变化与交替冻融次数之间显著性检验采用单因子方差分析(ANOVA)处理,土壤氮磷浓度和腐殖质之间的相关性用Pearson相关系数评价。
2 结果与分析
2.1 交替冻融对全氮和有效氮的影响
未冻融和经过冻融处理的土壤样品全氮和有效氮浓度见图1和图2。由图1可见,交替冻融次数对三种土壤全氮浓度影响显著,三种土壤的全氮浓度均在第2次冻融后有所升高,与处理前相比,水稻土、黑土、暗棕壤的涨幅分别为16.03%、44.24%和2.72%。但经过15次冻融后,全氮浓度变化不大。方差分析表明,不同交替冻融次数处理三种土壤全氮浓度差异均显著(P<0.05)。
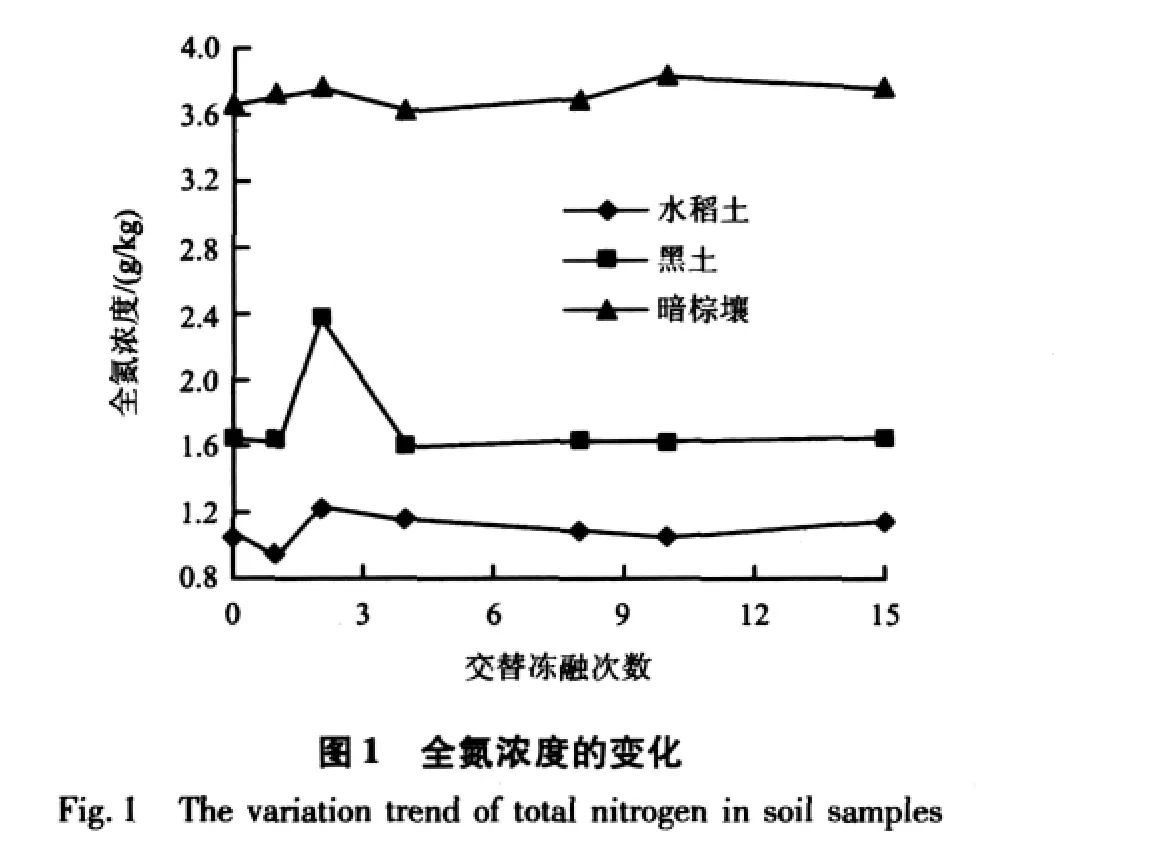
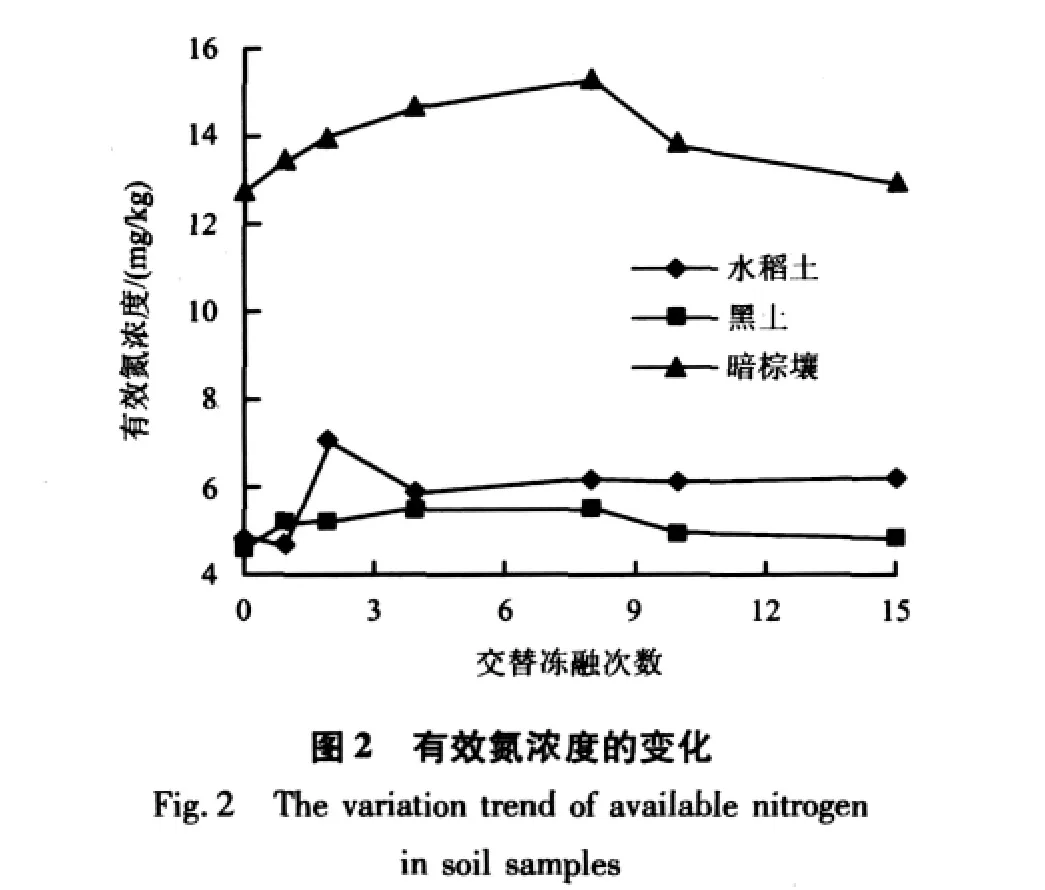
由图2可见,交替冻融次数对三种土壤有效氮浓度影响显著。水稻土有效氮浓度呈现上升→下降→上升→趋于稳定的变化规律,2次冻融后有效氮浓度达到最大值,与处理前相比,涨幅为47.32%,15次交替冻融后有效氮浓度由4.83 mg/kg升高到6.30 mg/kg,上升了31.25%。黑土有效氮浓度逐渐升高,4次交替冻融后达到最大值,与处理前相比涨幅为19.13%,之后略有下降并趋于稳定。暗棕壤有效氮浓度在8次交替冻融后达到最大值,与处理前相比涨幅为15.01%,10次交替冻融后有效氮浓度略有下降,并趋于稳定。方差分析表明,不同交替冻融次数处理三种土壤有效氮浓度差异均显著(P<0.05)。
2.2 交替冻融对全磷和有效磷的影响
未冻融和经过冻融处理的土壤样品全磷和有效磷浓度变化见图3和图4。由图3可见,交替冻融次数对三种土壤全磷浓度影响显著。三种土壤全磷浓度均在初次冻融后有大幅增高,与处理前相比,水稻土、黑土、暗棕壤的涨幅分别为8.07%、7.11%和12.62%。15次交替冻融后三种土壤的全磷浓度均较未处理时有所增长,与处理前相比,水稻土、黑土、暗棕壤的涨幅分别为7.93%、5.45%和9.05%。方差分析表明,不同交替冻融次数处理三种土壤全磷浓度差异均显著(P<0.05)。

图3 全磷浓度的变化Fig.3 The variation trend of total phosphorous in soil samples
由图4可见,交替冻融次数对三种土壤有效磷浓度影响显著。水稻土有效磷浓度随着交替冻融次数的增加总体呈升高形势,15次交替冻融后有效磷浓度由 14.6 mg/kg升高到 22.8 mg/kg,上升了56.16%。黑土有效磷呈现上升→下降→上升→趋于稳定的变化规律,15次交替冻融后有效磷浓度与处理前相比由39.5 mg/kg升高到46.5 mg/kg,上升了17.72%。而暗棕壤有效磷浓度呈逐渐下降的趋势,15次交替冻融后下降35.19%。方差分析表明,不同交替冻融次数处理三种土壤有效磷浓度也是差异均显著(P<0.05)。

图4 有效磷浓度的变化Fig.4 The variation trend of available phosphorous in soil samples
2.3 土壤氮磷浓度和腐殖质之间相关性
未冻融和经过冻融处理土壤样品松结态腐殖质浓度见图5。
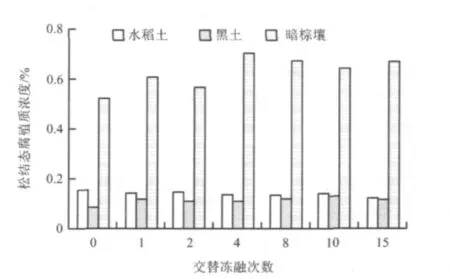
图5 土壤样品松结态腐殖质浓度变化Fig.5 The variation trend of active humus content in soil samples
将三种土壤的原始样及经过1次、2次、4次、8次、10次、15次冻融处理的土壤样品(n=7)的松结态腐殖质浓度与相对应的氮磷浓度进行Pearson相关系数及其显著性检验,分析表明(表2),随着交替冻融次数的变化,松结态腐殖质浓度与土壤氮磷浓度存在一定相关性,但特点各异。松结态腐殖质和水稻土的全氮、有效氮、全磷以及有效磷浓度分别呈负相关关系,但未达到显著水平(P>0.05),黑土有效氮浓度与松结态腐殖质浓度呈显著正相关关系。已有研究表明,冻融过程并未完全抑制微生物活动,微生物的分解作用使黑土土壤腐殖质浓度上升[11],而微生物的作用也提高土壤有机氮矿化效率,从而使有效氮浓度增加,这与该结果相符。黑土全磷与松结态腐殖质浓度呈显著正相关关系。暗棕壤的有效氮和全磷浓度与松结态腐殖质浓度呈正相关关系,但未达到显著水平(P>0.05)。三种类型的总氮指标与松结态腐殖质浓度均呈负相关关系,但未达到显著水平(P>0.05)。目前还不能充分解释冻融作用时土壤氮磷浓度和腐殖质之间的相互作用机理,这方面的研究有待于进一步加强。
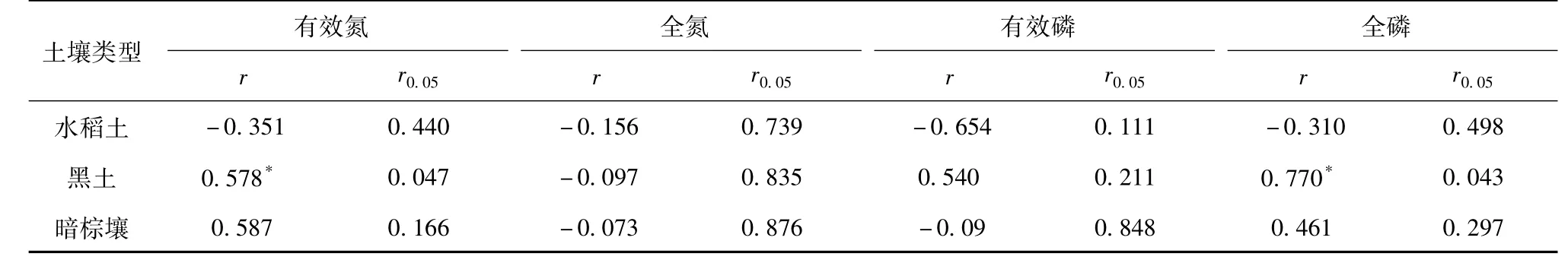
表2 交替冻融下松结态腐殖质与氮磷浓度的相关系数(n=7)Table 2 Correlation coefficients between loose humus and nitrogen phosphorus under freezing and thawing cycles
3 讨论
3.1 交替冻融对土壤全氮和有效氮的影响
经过15次冻融后全氮浓度均未发生明显变化,这与Schimel等[13]的研究结果一致,认为遇剧烈低温可能导致微生物数量明显下降,但低温过后微生物数量的快速恢复在一定程度上可以抵消这种不利影响,因而对土壤氮浓度变化没有明显的影响。另一方面,由于土壤冻融界面及附近区域有一定含水量,在冻融的作用下土壤含水部分产生缺氧区域,加快了微生物的反硝化作用,引起氮的损失[14],所以在初次冻融时水稻土全氮浓度呈下降趋势。随着交替冻融次数的增加,土壤结构的改变,提高了微生物的活性[15],加快了土壤中的硝化过程[16],从而导致全氮浓度变化不大。
交替冻融作用下,三种土壤有效氮浓度总体是增加的,这与Fitzhugh等[1]的研究结果一致,由于冻融作用增强了土壤的释水性和水分的渗透性,使得融化后土壤水分显著提高,养分易于溶出,或吸附在矿物颗粒内以及土壤胶体表面,由于交替冻融加快了土壤中有机质矿化与硝化速率,造成土壤中的可溶性有机物和养分浓度有所增加。另一方面,土壤C/N是指有机物中碳素总量与氮素总量的比值,微生物生命活动需要的C/N约为24,若C/N<24,有机物分解时多余的氮会释放出来[17]。本研究中,黑土、暗棕壤和水稻土的C/N分别为17.27、17.60和19.15,均低于24,所以在生物分解过程中,多余的氮释放出来,因而有效氮浓度增加。
3.2 交替冻融对全磷和有效磷的影响
交替冻融作用下,三种土壤全磷浓度总体均增加,这与Freppaz等[18]的研究结果一致,分析原因主要是由于测试方法和冻融作用破坏了土壤团聚体造成的。测试土壤全磷浓度时,采用高氯酸-硫酸消化的方法将不溶性磷酸盐转化为可溶性磷酸盐,整个消化时间约为40 min,消化时间远低于测试土壤全氮的消化时间(约为90 min),在较短的消化时间内可能存在由于土壤大团聚体的吸附和包覆作用,使部分不可溶性磷酸盐未能与消化液充分反应,而冻融作用破坏了土壤团聚体,使土壤大团聚体变小[6],增加了与消化液反应的机会,因而出现初次冻融后三种类型土壤全磷浓度均大幅增高的现象。
黑土和暗棕壤的有效磷浓度随着交替冻融过程总体呈增加趋势,这与 Taskin等[19]的研究结果一致,土壤有效磷浓度增加是由于磷从土壤固相向液相的释放过程加剧,包括无机磷的溶解,吸附态磷的解吸,有机磷的矿化、迁移过程中与其他土壤组分的反应等[20]。经过交替冻融过程后,随着有机质浓度的增加,土壤内有机质矿化速率提高,导致有效磷浓度升高。也有部分因素是由于冻融作用增强土壤释水性和水分渗透性[1],增加了无机磷的溶解,同时使得包含于土壤矿物颗粒内或吸附于土壤胶体表面的磷在随水分迁移的过程中发生了赋存形态的转化。另一方面,土壤C/P<200,有机物分解时多余的磷会释放出来[21]。本研究中,黑土和水稻土的C/P分别为67和49,所以在生物分解过程中,多余的磷释放出来,因而有效磷浓度增加。暗棕壤的C/P为98,但是由于暗棕壤采样点的土地利用类型是林地,林下土中生物可利用磷的浓度较低,因而可能发生磷的净固定,导致有效磷浓度降低。
4 结论
交替冻融对水稻土、黑土及暗棕壤中氮磷浓度影响显著,随着交替冻融次数的变化,全氮、有效氮、全磷、有效磷浓度差异显著;其中,交替冻融次数是导致氮磷浓度变化的主要原因。交替冻融过程中腐殖质与氮磷浓度之间存在一定相关性,但未达到显著差异。可见,频繁发生的交替冻融事件,是东北地区土壤氮磷浓度的影响因素之一,使得秋冬季节和初春季节不同坡向地带土壤氮磷循环产生差异。
[1]FITZHUGH R D,DRISCOLL C T,GROFFMAN P M,et al.Effects of soil freezing disturbance on soil solution nitrogen,phosphorus,and carbon chemistry in a northern hardwood ecosystem[J].Biogeochemistry,2001,56:215-238.
[2]JOSEPH G,HENRY A L.Soil nitrogen leaching losses in response to freeze-thaw cycles and pulsed warming in a temperate old field[J].Soil Biology Biochemistry,2008,40(7):1947-1953.
[3]DONEY S C,SCHIMEL D S.Carbon and climate system coupling on timescales from the Precambrian to the anthropocene[J].Annu Rev Environ & Resour,2007,32(11):31-66.
[4]SCHMIDT S K,LIPSON D A.Microbial growth under the snow:Implications for nutrient and allelochemical availability in temperate soils[J].Plant& Soil,2004,259:1-7.
[5]王展,张良,党秀丽,等.冻融作用对土壤镉吸附特征的影响[J].农业环境科学学报,2011,30(6):1103-1107.
[6]LEHRSCH G A,SOJKA R E,CARTER D L,et al.Freezing effects on aggregate stability affected by texture,mineralogy,and organic matter[J].Soil Science Society of America Journal,1991,55(5):1401-1406.
[7]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,1999.
[8]钱成,彭岳林,贾钧彦,等.西藏高原退化土壤的生物学肥力及其变化特征[J].应用生态学报,2006,17(7):1185-1190.
[9]刘世全,高丽丽,蒲玉琳.西藏土壤有机质和氮素状况及其影响因素分析[J].水土保持学报,2004,18(6):54-57,67.
[10]龚伟,颜晓元,王景燕,等.长期施肥对小麦-玉米作物系统土壤腐殖质组分碳和氮的影响[J].植物营养与肥料学报,2009,15(6):1245-1252.
[11]汪太明,王业耀,香宝,等.交替冻融对东北典型土壤腐殖质的影响[J].生态环境学报,2010,19(12):2870-2874.
[12]SCHNITER M.Organic matter extraction[C]//MILLER R H,KEENEY D R.Methods of soil analysis.Madison:WI Press,1982:581.
[13]SCHIMEL J P,BILBROUGH C J,WELKER J M.Increased snow depth affects microbial activity and nitrogen mineralization in two Arctic tundra communities[J].Soil Biol Biochem,2004,36:217-227.
[14]VAN BOCHOVE,JONES E H,PREVOST D.Winter fluxes of greenhouses gases from snow-covered agricultural soil:intraannual and interannual variations[J].Global Biogeochemical Cycles,2000,14(1):113-115.
[15]BROOKS P D,WILLIAMS M W,SCHMIDT S K.Inorganic nitrogen and microbial biomass dynamics before and during spring snowmelt[J].Biogeochemistry,1998,43:1-15.
[16]刘淑霞,王宇,赵兰坡,等.冻融作用下黑土有机碳数量变化的研究[J].农业环境科学学报,2008,27(3):984-990.
[17]BAKER A. Fluorescence excitation-emission matrix characterization of river waters impacted by a tissue mill effluent[J].Environmental Science & Technology,2002,36(7):1377-1382.
[18]FREPPAZ M,WILLIAMS B L,EDWARDS A C,et al.Simulating soil freeze-thaw cycles typical of winter alpine conditions:Implications for N and P availability[J].Applied Soil Ecology,2007,35:247-255.
[19]TASIN O,FERHAN F.Effect of freezing and thawing processes on soil aggregate stability[J].Catena,2003,52(1):1-8.
[20]于天仁.土壤化学原理[M].北京:科学出版社,1987:46-75.
[21]尹逊霄,华珞,张振贤,等.土壤中磷素的有效性及其循环转化机制研究[J].首都师范大学学报:自然科学版,2005,26(3):95-101.▷

