纳滤纯化低聚壳聚糖制备液的膜污染
韩永萍, 李亚秋, 郭 丹
(北京联合大学 生物化学工程学院,北京 100023)
纳滤纯化低聚壳聚糖制备液的膜污染
韩永萍, 李亚秋, 郭 丹
(北京联合大学 生物化学工程学院,北京 100023)
为了实现纳滤纯化低聚壳聚糖制备液技术的工业化,对纳滤过程中膜污染的形成进行研究,分析了电解质浓度对纳滤膜吸附层污染的影响和纳滤运行中的能量分布情况以及吸附层对电解质截留率的影响。结果发现,膜面吸附层污染与浓差极化存在复杂的交互影响。运行初期传质过程主要受浓差极化控制,低聚壳聚糖在膜面吸附形成的浓流层使浓差极化进一步加剧;随着低聚壳聚糖在膜面累积数量的增大,传质过程逐渐转变为吸附层结构和浓差极化共同控制。膜面吸附层的形成分为浓流层和致密层两个阶段,其中致密层是造成纳滤膜脱盐和操作性能恶化的主要原因,在操作过程中应及时控制和减缓该层的形成。
纳滤膜;低聚壳聚糖;膜污染
0 引言
纳滤(NF)是上世纪80年代中后期开发的一种新型压力驱动膜分离技术。它对于分子量介于200~2 000及以上的有机物具有良好的截留性能,对单价盐离子和小分子物质的截留率相对较低。在应用中,纳滤还具有高效节能、低污染、可连续生产、过程无相变等优点,被广泛用于水处理及化工产品、生物制品的脱盐纯化和浓缩过程[1]。
壳聚糖作为迄今发现的唯一天然碱性多糖,不仅拥有“当今人体必需的第六健康生命要素”之美誉,还具有良好的生物相溶性、成膜性、保湿性和可生物降解性等[2]。但是,其降解液中存在的单糖和二糖(分子量在300左右),及降解过程带入的Ac-和Na+都将严重影响壳聚糖相关高附加值产品的开发和应用。目前,纳滤纯化低聚壳聚糖制备液的技术可行性已被证实[3]。然而,以压力为驱动的膜分离过程在操作中膜通量总是呈持续下降,尤其对于黏度相对较大的多糖溶液体系,胶体吸附、微生物污染和颗粒沉积等各种形式膜污染不可避免发生,影响了实现该技术的工业化。因此,笔者对纳滤过程中膜污染的形成进行研究,以期合理确定膜系统的操作和清洗策略。
另外,低聚壳聚糖因本身具有广谱抗菌性,可有效缓解膜过程中的生物污染,但分子量相对较大及分子内部和分子间的大量氢键作用,导致了溶液黏度较大。同时,荷正电的特性也使其与带负电的纳滤膜之间存在强烈地吸附作用,体系中大量存在的Ac-和Na+可在纳滤操作过程中引起严重的浓差极化。因此,研究低聚壳聚糖制备液体系造成的纳滤膜污染,也揭示了膜污染过程中胶体污染和浓差极化间的相互干扰规律。
1 实验与方法
1.1 实验装置与材料
实验采用上海迪清过滤技术有限公司提供的YD-2521中试膜分离实验装置,包括多级离心泵、流量计、卷式纳滤膜组件 (膜面积约1.1 m2,Nitto产的NTR-7450膜)、保温贮液槽等。
壳聚糖,山东海得贝海洋生物工程有限公司提供,脱乙酰度>95%;纤维素酶,天津丽华制剂厂生产,酶活力≥40 000 U/mg。
低聚壳聚糖制备液,自制。采用纤维素酶结合双氧水对壳聚糖进行降解,经过0.2 μm微滤过滤脱杂后,滴加1%NaOH溶液调节呈中性,加1倍体积的无水乙醇沉淀,抽滤取沉淀物用去离子水溶解,旋转蒸发浓缩后真空干燥,待用。
葡萄糖、双氧水(30%)、冰醋酸、苯酚、硫酸、氢氧化钠、醋酸钠等试剂均为分析纯,北京化学试剂公司提供。
1.2 实验方法
为了保持初始料液组成基本不变,在操作过程中始终使透过液直接返回料液槽,进行全循环纳滤实验。实验操作压力为1.0 MPa,料液温度保持在35~40℃。
在研究中,Na+采用DWS-51型钠离子浓度计测定;糖含量采用苯酚-硫酸法测定[4]。
实验结束后,对污染的组件进行解剖,将污染后的纳滤膜裁剪成一系列5 cm×5 cm膜片。采用扫描电镜观察污染前后纳滤膜的形貌时,先将待分析膜片在液氮中脆断,再用导电双面胶固定在样品台上,真空喷金后观察。
2 理论分析
根据达西定律,可整理得到纳滤膜表面渗透压Δπ的第一个表达式:
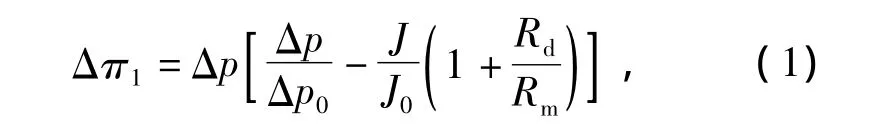
式中:Rm——洁净纳滤膜的阻力,由纳滤的纯水透过实验获得,Rm=2.57×1013m-1;
Rd——吸附层阻力值,与吸附层的厚度和孔隙率ε有关。
多孔滞留层中传质阻力可由Kozeny Carman方程式表示[5]:
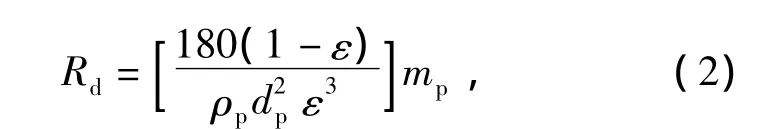
式中:mp——单位膜面积上截留总糖的质量;
ρp——糖的密度;
dp——糖有效粒径。
由质量守恒可得出某一时间的mp:
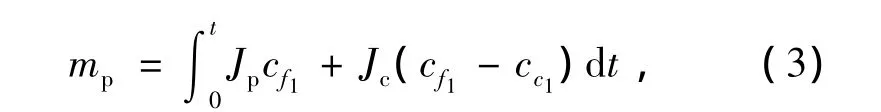
式中:cf1——料液中糖的浓度;
cc1——截留液中糖的浓度;
Jc——截留液流速。
分离体系可大致看成由低聚壳聚糖和1-1型NaAc稀电解质组成,Δπ的第二个表达式可由van’st
Hoff方程近似表示:
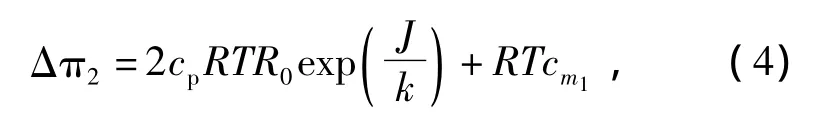
式中:R——热力学常数,R=0.082 atm·L/(mol·K);
T——流体的绝对温度,在35~40℃下运行,T取其平均值为310.5 K;
cm——纳滤膜表面NaAc的浓度;
cp——透过液中NaAc的浓度;
cm1——纳滤膜表面低聚壳聚糖的浓度,cm1=ρp(1 - ε)/4 000;
R0——NaAc的表观截留率;
k——NaAc的传质系数,由于增加了吸附层传质,该值需要重新修正为 k*[6]:

式中:D——NaAc在稀溶液中的扩散系数,只与温度有关;
δc——吸附层厚度,δc=mp/[ρp(1 -ε)]。
根据纳滤连续渗滤结果,联立式(1)~(5),可计算得到实验条件下的Δπ,ε,mp和Rd。
3 结果与讨论
3.1 电解质浓度对纳滤膜吸附层污染的影响
在低聚壳聚糖含量接近制备液组成的情况下,为了考察电解质浓度对纳滤膜吸附层结构的影响,实验采用低聚壳聚糖质量浓度为8 g/L,NaAc质量浓度分别为0,0.4和1 g/L三种料液。其中,1 g/L NaAc约为制备液的2~3倍,接近于纳滤纯化、浓缩结束时低聚壳聚糖料液中的离子质量浓度。实验得到的J,Mp,ε和Rd随运行时间变化情况分别见图1~4。
由图1可以发现,随着分离体系中NaAc质量浓度增大,膜通量随运行时间衰减比较严重,当NaAc质量浓度为1.0 g/L时,运行5 h后膜通量仅为初始值的55%。可见,分离体系中NaAc有加大膜传质阻力的倾向。由图2可发现,纳滤膜表面对三种混合液体系中低聚壳聚糖的吸附数量相差并不大。考虑到膜通量大小不仅与传质阻力相关,还受浓差极化引起的渗透压影响。由此推测,在运行过程中,一方面由于膜面低聚壳聚糖吸附层的出现,导致膜面积累的NaAC向主体溶液反向扩散受阻,即出现了吸附层加剧渗透压现象;另一方面,NaAc可能对吸附层结构产生一定影响。
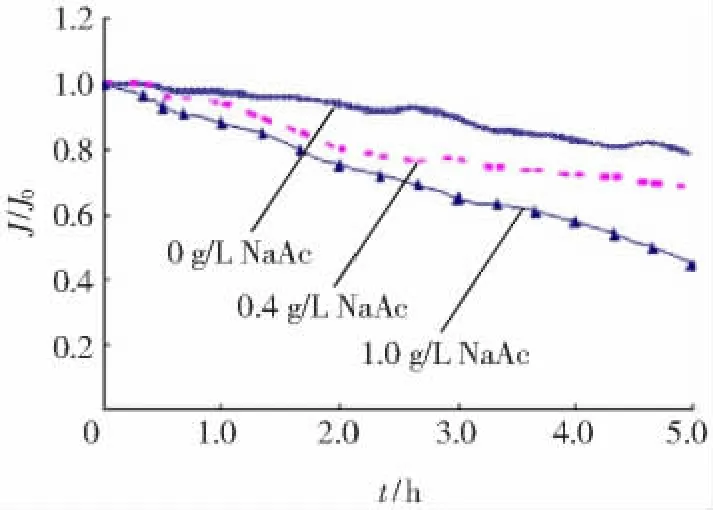
图1 混合液的膜通量随时间变化Fig.1 Change of normalized permeate flux with time

图2 纳滤膜截留的低聚糖质量Fig.2 Mass of CTS deposited with time
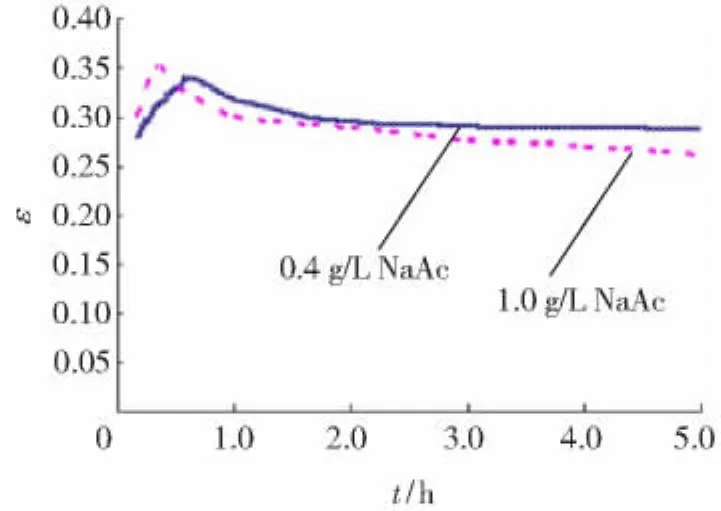
图3 纳滤膜吸附层的孔隙率Fig.3 Change of porosity under with time
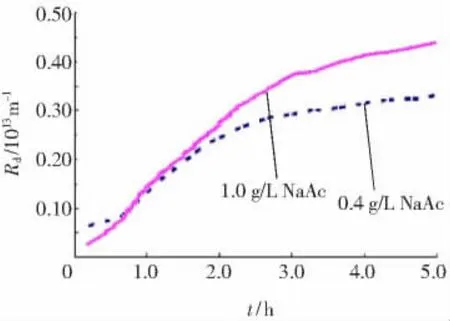
图4 纳滤膜吸附层的传质阻力Fig.4 Change of hydraulic resistance of adsorption layer with time
由图2还可见,膜面污染物的累积速率主要受渗透过程的水力拖拽、水流剪切力和反向扩散三方面影响。随着吸附层厚度增大,膜表面水流剪切力也随之加大,从而抑制吸附层和浓差极化层继续增大,最终使低聚壳聚糖在膜表面的吸附量趋于平衡。
当NaAc不存在时,由于前面的理论公式无法计算出纳滤膜面吸附层的孔隙率ε和由此产生的阻力Rd,所以图3和4中仅给出了有NaAc存在的两种混合液体系ε和Rd随运行时间的变化曲线。
图3显示,在纳滤运行的初始阶段,ε很快达到最高值,之后下降逐渐趋于平稳。这是膜面吸附层ε随运行时间变化趋势的共同特点。运行初期,NaAc质量浓度为0.4 g/L的混合液体系膜面吸附层ε低于1.0 g/L混合液体系,其高峰值出现时间也相对滞后。之后0.4 g/L混合液体系的ε始终高于1.0 g/L混合液体系。由图4也可以发现,吸附层孔隙率的微弱变化,可引起吸附层阻力Rd的巨大改变。在运行初期,Rd(0.4 g/LNaAc体系)> Rd(1.0 g/L NaAc体系);随着运行时间持续,Rd(1.0 g/LNaAc体系)明显高于Rd(0.4 g/LNaAc的体系)。
综合图3和4可发现,在运行初期,混合液体系中的NaAc有明显阻碍低聚壳聚糖在膜面吸附和增大膜面吸附层孔隙率的作用。随着运行时间的延长,这种阻碍作用不仅很快消失,而且大量的NaAc还导致了膜面吸附层压缩。分析认为,在运行初期分子量相对较小、扩散系数较大的Na+和Ac-首先扩散至纳滤膜表面,它们不仅部分中和了纳滤膜的负电性,而且也阻碍了带正电荷的低聚壳聚糖与纳滤膜间的吸附。推测这一阶段浓差极化产生的渗透压对膜通量J的影响起到了主导作用。然而随着Na+和Ac-不断扩散通过纳滤膜,膜表面集结的低聚壳聚糖越来越多,使膜表面层流底层的溶液黏度迅速增大,形成吸附层。它不仅阻碍了溶液中NaAc的反向扩散,也使主体溶液中的NaAc向膜表面的扩散受阻。推测这一阶段膜通量J受吸附层阻力和渗透压共同影响。NaAc对吸附层结构的作用推测为:低聚壳聚糖因分子中存在大量游离氨基和羟基,分子间及内部的氢键作用不仅造成分子结构不够舒展,而且分子自身也因极性较大存在水化膜。由于Ac-的扩散速率相对 Na+要小,运行一段时间后Ac-在吸附层中滞留量相对较大。根据胶体双电层理论[7],反离子的存在使低聚壳聚糖分子的双电层结构被压缩,分子极性也随之减小,水化现象得到了一定程度缓解,从而降低了分子间的间距。
3.2 纳滤运行中的能量分布
为了更加清楚地反映在纳滤过程中渗透压和吸附层阻力对膜通量的影响,将系统操作压差Δp改写为
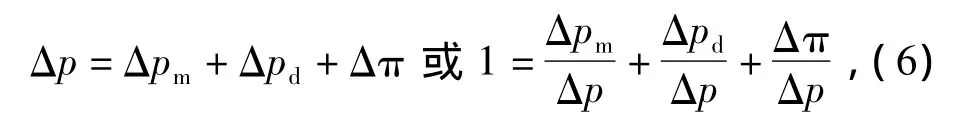
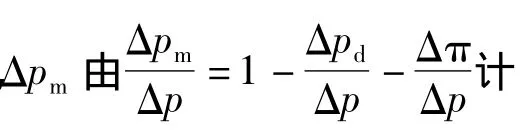
两种混合液体系纳滤运行过程中,各部分能量的消耗比例分布随运行时间变化情况见图5。
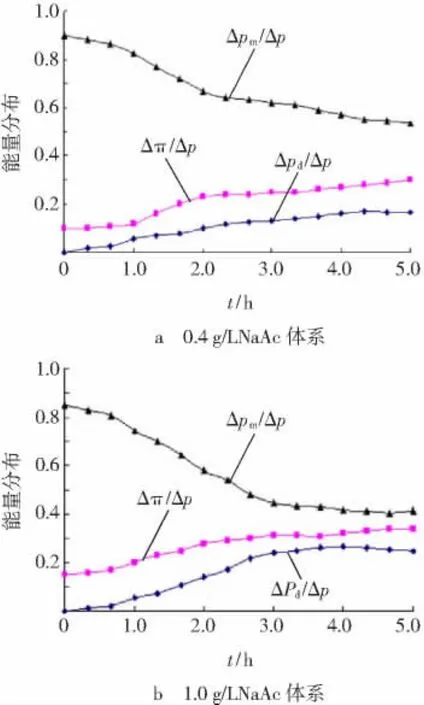
图5 两种混合液体系纳滤运行时能量分布Fig.5 Energy consumption analysis for two feed water system
由图5可见,在运行初期,能量主要用于克服纳滤膜自身阻力。随着运行时间的延长,渗透压和吸附层阻力逐渐增大,能量消耗也随之增大。在整个运行过程中,尽管初期渗透压明显高于吸附层阻力,但吸附层阻力增加速度较快,0.4 g/L NaAc的低聚壳聚糖混合体系运行至2.5 h左右吸附层阻力趋于恒定,而1.0 g/L NaAc体系吸附层阻力接近3h时趋于恒定。图5进一步证实,在运行初期膜通量J主要受渗透压影响,而随着吸附层阻力的增大,很快转变成渗透压和吸附层阻力共同影响。
此外,相对于0.4 g/L NaAc的低聚壳聚糖混合体系,1.0 g/L NaAc体系的渗透压并没有成倍增长,反而是吸附层阻力增加较大。这再次说明NaAc主要通过改变吸附层结构来影响膜通量。
3.3 纳滤膜吸附层对电解质截留率的影响
为了考察低聚壳聚糖含量对电解质截留率的影响,实验采用NaAC质量浓度为0.4 g/L,低聚壳聚糖的质量浓度分别为0,8和15 g/L三种料液。其中NaAC质量浓度接近制备液的组成,而15 g/L低聚壳聚糖接近于纳滤纯化、浓缩结束时料液中的多糖质量浓度。由于受低聚壳聚糖的干扰无法直接获得NaAC的截留率,因此仅仅考察了Na+的截留率。实验中Na+的截留率R随运行时间变化见图6。
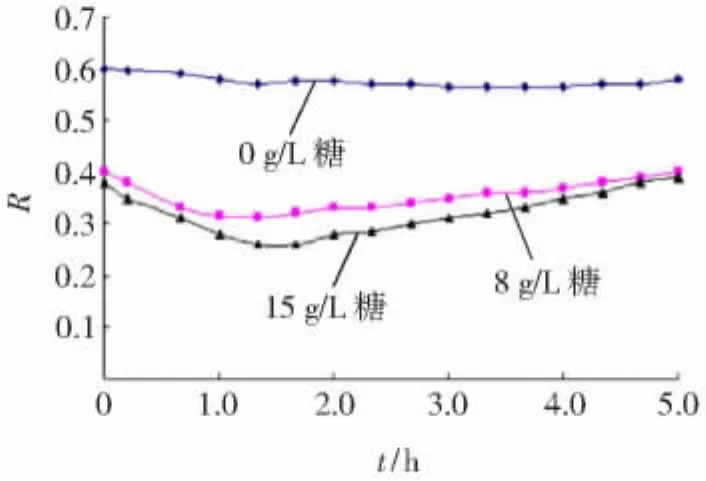
图6 初始料液中低聚壳聚糖的浓度对Na+截留率的影响Fig.6 Effect of initial feed colloidal COS concentration on Na+rejection behave
由图6可看出,Na+的截留率与料液中低聚壳聚糖的质量浓度密切相关。对于不含低聚壳聚糖的料液体系,Na+截留率除因浓差极化影响略有下降外,整个运行过程中比较平稳。而存在低聚壳聚糖的料液体系,Na+截留率不仅明显降低,而且在运行过程中还存在最低值。根据前面的分析,随着膜表面低聚壳聚糖吸附层的形成,Na+在膜表面的渗透压也随之增大,从而导致截留率总体上减小。Na+截留率最低值的出现推测为,低聚壳聚糖在膜表面形成吸附层的过程可分为浓流层和致密层(凝胶层)两个阶段。在纳滤运行过程中,低聚壳聚糖因扩散能力较低其浓流层首先在浓差极化层外围形成。随着运行时间的延长,浓差极化层外移向主体溶液扩展,而吸附层逐渐向膜面推动。与膜表面接触后的浓流层由于受扩散空间限制及静电力、“盐析”等作用,结构逐渐致密化。前期形成的浓流层因具有较大的孔隙率并不能造成较大的传质阻力,但是足以阻碍Na+的反向扩散,使渗透压迅速提高。随着膜表面低聚壳聚糖致密层的形成,纳滤膜面传质阻力迅速增大,Na+截留率再次升高。料液中低聚壳聚糖质量浓度越高,这一过程越明显。结合图1可发现,膜面致密低聚壳聚糖吸附层的形成造成了膜通量迅速下降。
4 结论
纳滤纯化低聚壳聚糖制备液时,主要承受低聚壳聚糖在膜表面吸附形成的有机污染、胶体污染以及料液中Na+、Ac-等引起的浓差极化作用,且吸附层污染与浓差极化作用存在着复杂的交互影响。在运行过程中,膜面低聚壳聚糖吸附层的出现造成了NaAc浓差极化现象加剧。反过来,运行初期在静电斥力作用下体系中的NaAc有明显阻碍低聚壳聚糖在膜表面吸附并增大吸附层孔隙率的作用;而在运行后期,膜表面截留的大量NaAc通过降低低聚壳聚糖分子的极性、减小吸附层结构的孔隙率,导致低聚壳聚糖吸附层压缩,加速了膜污染的形成。低聚壳聚糖在膜表面形成吸附层过程又可推测分为浓流层和致密层(凝胶层)两个阶段。致密吸附层是造成纳滤膜脱盐和操作性能恶化的主要原因。因此,在纳滤纯化低聚壳聚糖制备液操作过程中应及时控制纳滤膜面致密吸附层的形成。
[1]陈欢林.新型分离技术[M].北京:化学工业出版社,2005:17.
[2]JENO Y J,KIM S K.Preparation of chitin and chitosan oligosaccharides and their application in physiological functional foods[J].Food Reviews International,2000,16(2):159 -176.
[3]韩永萍,林 强,王晓琳.纳滤纯化低聚壳聚糖制备液的可行性研究[J].离子交换与吸附,2012,28(1):86-95.
[4]林 颖,吴簌敏,吴 雯,等.天然产物中的多糖含量测定方法正确性研究[J].天然产物研究与开发,1996,8(3):5-8.
[5]FAIBISH R S,ELIMELECH M,COHEN Y.Effect of interparticle electrostatic double layer interactions on permeate flux decline in crossflow membrane filtration of colloidal suspensions:an experimental investigation[J].Colloid Interf Sci,1998,204:77 -86.
[6] FULIN WANG,VOLODYMYR V,TARABARA.Coupled effects of colloidal deposition and salt concentration polarization on reverse osmosis membrane performance[J].J Membr Sci,2007,293:111-123.
[7]严煦世,范瑾初.给水工程[M].3版.北京:中国建筑工业出版社,1995.
Study on membrane fouling formation in the course of chiitooligosaccharides solution purification with nano-filtration
HAN Yongping, LI Yaqiu, GUO Dan
(College of Biochemical Engineering Beijing Union University,Beijing 10023,China)
Aimed at realizing the industrialization of the nanofiltration purification preparation of Chiitooligosaccharides solution,this paper introduces the research on the formation of membrane fouling in the course of purification Chiitooligosaccharides(COS)solution with nano-filtration(NF).The investigation into the effect of the electrolyte concentration on pollution of adsorption layer of the nanofiltration membrane,distribution of energy in nanofiltration run,and the effect of adsorption layer on electrolyte retention rate shows that there occurs a complex interactive influence between the concentration polarization caused by Na+、Ac-and COS adsorption layer on the membrane surface.In earlier stage of COS solution purification by NF,the concentration polarization mainly controls the mass transport process in NF membrane.The accumulating COS on membrane surface allows the adsorption layer structure to be gradually developed to become the control factor with the concentration polarization.The formation of colloidal adsorption layer on the NF membrane surfaces consists of a stagnant layer and a concentrated flowing layer which occurs as the main reason for desalting and deteriorating performance of NF membrane,necessitating the timely control and slowing down of the formation.
nano-filtration;chiitooligosaccharides;membrane fouling
TQ028.8
A
1671-0118(2012)04-0382-05
2012-07-06
韩永萍(1971-),女,山东省曹县人,副教授,博士,研究方向:膜分离科学与技术、天然产物的提取与分离,E-mail:hypyyt@163.com。
(编辑 徐 岩)
——2017年渗透压相关高考真题赏析

