环氧合酶-2抑制剂联合苦参碱逆转K562/AO2细胞多药耐药的研究
桂琳,李静,陈宝安,高峰,王筠,蔡晓辉
(1.东南大学医学院附属蚌埠第三人民医院血液科,安徽蚌埠 233000;2.东南大学附属中大医院血液科,江苏南京 210009)
白血病的多药耐药是导致临床上白血病化疗失败的主要原因之一,已经证实人P-糖蛋白(P-gp)的过表达与肿瘤的多药耐药的发生密切相关。最近已有报道显示,环氧合酶-2(COX-2)和肿瘤细胞的多药耐药基因(multidrug resistance associated protein,MRP)1表达可增加MDR1基因产物P-gp的表达[1]。COX-2是前列腺素合成过程中的一个主要限速酶,在多种上皮来源的肿瘤组织中高表达,而在正常组织中几乎不表达。有研究表明,COX-2过表达与实体瘤多药耐药密切相关,是实体瘤多药耐药重要的促进因素,但其确切的机制尚不清楚[2-3]。本研究通过四甲基偶氮唑盐(MTT)法、流式细胞术、RT-PCR和Western blotting方法检测COX-2抑制剂塞来昔布、苦参碱单独及联合应用对细胞凋亡,MDR1、P-gp等表达变化的影响,探索COX-2与肿瘤多药耐药的关系。
1 材料与方法
1.1 主要试剂与仪器
RPMI-1640培养基购自Gibco公司,青霉素和链霉素均为华北制药股份有限公司产品,塞来昔布为南京德宝生化器材有限公司提供,苦参碱注射液由辽宁玉皇药业有限公司提供,阿霉素(ADM)为浙江海正药业产品,MTT由美国Sigma公司提供,Annexin V-FITC细胞凋亡检测试剂盒是进口分装产品(原晶美产品),RT-PCR试剂盒是Fermentas公司产品,COX-2单抗和P-gp单抗均为Abcam产品,COX-2基因、MDR1和GAPDH等引物由上海捷瑞生物工程有限公司合成(序列查自PubMed)。COX-2上游为TCTGAAACCCACTCCAAACAC,下游为 GCCCTCGCTTATGATCTGTC。MDR1上游为TGGTTTGATGTGCACGATGTTGGG,下游为 AGATCAG CAGGAAAGCAGCACCTA。GAPDH(614 bp)上游为GCCACATCGCTCAGACAC,下游为CATCACGCCACAG TTTCC。
1.2 细胞与细胞培养
人慢性粒细胞白血病急性红白血病变细胞敏感株K562由本实验室长期保存,耐药细胞株K562/AO2细胞是经ADM逐步诱导、具有多药耐药MDR表型的稳定细胞系,由中国医学科学院血液学研究所提供。K562/AO2细胞维持增殖的ADM终浓度为1.0 mg·L-1。将细胞接种于含体积分数为10%小牛血清的RPMI-1640培养液,置于37℃、体积分数为5%CO2饱和湿度培养箱中,2~3 d传代1次。选取对数生长期细胞进行实验,实验前无药培养3 d。
1.3 实验分组
实验时取对数生长期细胞,计数活细胞数在98%以上,根据实验设计分组:(1)K562阴性对照组(未加药);(2)K562/AO2阳性对照组(未加药);(3)ADM干预的K562/AO2组;(4)苦参碱干预的K562/AO2组;(5)塞来昔布干预的K562/AO2组;(6)苦参碱联合塞来昔布干预的K562/AO2组;(7)苦参碱联合ADM干预的K562/AO2组;(8)塞来昔布联合ADM干预的 K562/AO2组;(9)苦参碱、塞来昔布联合ADM干预的K562/AO2组。
1.4 MTT法检测细胞毒性作用
取对数生长期人慢性粒细胞白血病急性红白血病变细胞敏感株K562及其耐药细胞株K562/AO2分别调整细胞浓度至约2×105ml-1,以每孔200μl接种于96孔细胞培养板中,在CO2体积分数为5%、饱和湿度、37℃孵箱中常规培养。2~4 h后加入不同浓度药物,每组设3个复孔,培养24或48 h后加入20μl MTT,继续培养4 h,弃上清,每孔加150μl二甲基亚砜(DMSO),充分溶解结晶物,平板振荡仪振荡10 min,用酶联免疫检测仪测定波长492 nm时的OD值,计算细胞抑制率,求出半数抑制剂量(IC50)。药物对细胞生长抑制率=(1-实验组吸光度A/对照组吸光度A)×100%;耐药倍数=耐药细胞IC50/敏感细胞IC50;增敏倍数=耐药细胞IC50/加逆转剂后IC50。
1.5 流式细胞术检测细胞凋亡率
将细胞悬液密度调成8×104ml-1,分别加入ADM、苦参碱、塞来昔布以及苦参碱联合塞来昔布、ADM。另设对照组(未加药),置37℃、体积分数为5%CO2的培养箱中培养48 h后1 ml冷PBS离心洗涤2 次(1 500 r·min-1,5 min),倒掉上清液,加入 500 μl结合缓冲液和5μl Annexin V-FITC重悬后室温下避光放置20 min,然后用流式细胞仪检测各组细胞凋亡率。每组实验重复3次,取均数。
1.6 RT-PCR方法检测MDR1、COX-2 mRNA
分别收集经ADM、苦参碱、塞来昔布单独及联合应用后48 h的K562/AO2的各组细胞及对照组细胞。用Trizol法提取各组总RNA,然后利用RT-PCR试剂盒进行逆转录反应生成cDNA,并取一定量cDNA加入目的基因引物片段进行PCR反应生成目的DNA基因复制产物,从而半定量测定目的基因mRNA的表达,未反应cDNA保存于-20℃。本实验PCR体系总体积为25μl,反应条件:94℃预变性2 min;94℃变性30 s,退火30 s(内参GAPDH退火温度为53℃,MDR1和COX-2基因退火温度为55℃),72℃延伸1 min,30个循环;72℃延伸7 min。以MDR1/GAPDH DNA和COX-2/GAPDH DNA光密度比值作为各组实验资料;每组实验重复3次,取均值。
1.7 Western blotting法检测细胞P-gp和COX-2蛋白的表达
分别收集经ADM、苦参碱、塞来昔布单独及联合应用后48 h的K562/AO2的各组细胞及对照组细胞后提取蛋白质,BCA法(BCA试剂盒购自碧云天公司)测定蛋白质含量。等量蛋白质采用十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)进行分离,然后转至PVDF膜上,室温下摇动封闭4 h后加入鼠抗人COX-2和P-gp抗体,在4℃过夜,室温下洗膜后加入碱性磷酸酶标记的羊抗小鼠IgG抗体,室温孵育1 h;洗去未结合的二抗,加新鲜配置的显色液,避光显色20 min后终止反应。P-gp和COX-2蛋白表达值为条带的灰度值除以β-actin内参校正;每组实验重复3次,取均值。
1.8 统计学处理
数据用±s表示,两样本均数比较用方差检验,采用统计软件SPSS 11.5进行统计学处理。显著性检验采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 逆转剂及逆转剂处理前后对K562细胞和K562/AO2细胞的毒性作用
ADM对K562/AO2细胞和K562细胞的IC50分别为 (33.31 ±2.51)、(0.40 ±0.03)μg·ml-1,耐药倍数为83.69倍。苦参碱对 K562的IC50为(1 290.33±53.45)μg·ml-1,对 K562/AO2 的 IC50为(1 342.33 ±33.50)μg·ml-1,塞来昔布对K562的IC50为 (45.97±1.05)μg·ml-1,对 K562/AO2 的 IC50为(45.68 ±0.15)μg·ml-1,二者差异无统计学意义。苦参碱在≤225 μg·ml-1,塞来昔布在≤11.5 μg·ml-1时对细胞无明显毒性作用(对细胞的生长抑制率<10%)。我们选用苦参碱200μg·ml-1、塞来昔布7.5μg·ml-1为单独及联合用药时的逆转浓度,通过实验发现二者联用时毒性并没有增加。苦参碱(200μg·ml-1)及塞来昔布(7.5μg·ml-1)单独及联合应用于K562/AO2细胞时,ADM 对 K562/AO2细胞的 IC50分别为 9.44、12.84、2.71 μg·ml-1,逆转倍数分别为 3.53、2.60、12.29倍。而对K562细胞IC50值并无明显影响(图1)。

图1 各组药物干预48 h后对K562/AO2细胞的抑制率
2.2 流式细胞术检测细胞凋亡率
225μg·ml-1苦参碱及11.5 μg·ml-1塞来昔布单独及联合应用,对于K562/AO2细胞均没有明显的毒副作用。我们选定苦参碱200μg·ml-1、塞来昔布7.5 μg·ml-1、ADM 2 μg·ml-1为作用浓度,对于K562/AO2细胞其阳性对照组凋亡率为(3.25±0.53)%,单用ADM组凋亡率为(4.81±1.25)%,苦参碱联合ADM组其凋亡率为(15.31±1.07)%,塞来昔布联合ADM组其凋亡率为(12.72±0.98)%,而苦参碱、塞来昔布与ADM联合应用时凋亡率为(29.82±0.23)%,可见应用逆转剂组凋亡率显著增高,且两逆转剂联合应用时凋亡率最高。见图2。
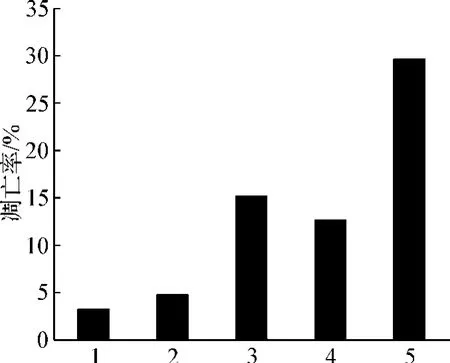
图2 各组药物干预K562/AO2细胞48 h后对凋亡率的影响
2.3 RT-PCR方法检测MDR1、COX-2基因
对照组K562细胞和K562/AO2细胞的MDR1 DNA条带与内参GAPDH条带灰度比值分别为(3.72±1.62)%和(127.90±1.78)%,两组差异有统计学意义(P<0.05)。对照组K562细胞和K562/AO2细胞的COX-2基因条带与内参GAPDH条带灰度比值分别为(1.47±0.86)%和(50.84±2.80)%,两组差异有统计学意义(P<0.05)。苦参碱、塞来昔布单独及联合应用ADM 48 h后,MDR1与GAPDH的比值分别为(70.76±9.65)%、(78.44±2.36)%和(30.57±5.99)%;苦参碱、塞来昔布单独及联合应用ADM 48 h后,COX-2基因与GAPDH的比值分别为(26.42±3.29)%、(24.56±1.13)%和(8.36±2.83)%。加用逆转剂后与对照组相比有明显差异,具有统计学意义,以两个逆转剂联用时最明显。见图3~5。
图3 各组药物干预K562/AO2细胞48 h后COX-2mRNA内参表达的变化

图4 各组药物干预K562/AO2细胞48 h后COX-2mRNA表达的变化
2.4 Western blotting法检测细胞P-gp和COX-2蛋白的表达
对照组K562细胞和K562/AO2细胞的P-gp条带与内参条带灰度比值分别为(2.02±0.47)%和(83.72±6.97)%,两组差异有统计学意义(P<0.05);对照组K562细胞和K562/AO2细胞的COX-2蛋白条带与内参条带灰度比值分别为(1.33±0.48)%和(83.18±5.49)%,两组差异有统计学意义(P<0.05)。苦参碱、塞来昔布单独及联合应用ADM 48 h后P-gp与内参的比值分别为(51.90±2.57)%、(40.62±4.51)%和(13.30±1.37)%;苦参碱、塞来昔布单独及联合应用ADM 48 h后COX-2蛋白与内参的比值为(50.82±6.30)%、(41.19±10.42)%和(13.75±6.12)%。加用逆转剂后与对照组相比差异具有统计学意义,以两个逆转剂联用时最明显。见图6。
3 讨 论
化学治疗是目前治疗恶性肿瘤,包括血液系统恶性肿瘤的主要手段之一。化疗过程中由于多数肿瘤细胞具有遗传不稳定性,易于突变而产生的MDR是造成化疗中断、导致治疗失败的主要因素之一,也是肿瘤细胞对化疗药物毒性损伤最重要的自我保护防御机制之一。
肿瘤细胞的MDR产生的机制是复杂多样的,可能的机制主要有:(1)药物外排;(2)抗细胞凋亡;(3)其他,包括药物代谢酶活性的变化(如GST、TopoⅡ、PKC)、DNA损伤修复能力增强、微环境耐药、激素受体量和亲和力改变等机制。目前较多的研究表明,肿瘤细胞产生MDR的主要原因是MDR1/P-gp的高表达。因而干预和逆转肿瘤细胞的MDR,提高化疗敏感性对恶性血液病的治疗有积极意义[4-5]。克服多药耐药的方法之一是使用逆转剂,逆转MDR能够使化疗失败的几率下降具有很高的临床价值,MDR逆转已成为目前国内外化疗药物研究的重要方向之一。

图5 各组药物干预K562/AO2细胞48 h对MDR1mRNA表达的影响

图6 各组药物干预K562/AO2细胞48 h蛋白表达情况
近年来的研究发现许多癌前病变和恶性肿瘤有COX-2的过度表达,COX-2同时具有环氧化物酶和过氧化物酶两种酶的活性,在肿瘤细胞的恶性进程中对细胞周期、细胞凋亡、肿瘤血管形成以及肿瘤的浸润、转移等均存在一定的关联性[6-7]。COX-2促进肿瘤发生的分子机制主要有:(1)促进肿瘤新生血管的生成;(2)刺激肿瘤细胞的增殖;(3)抑制肿瘤细胞的凋亡;(4)促进肿瘤的浸润和转移;(5)抑制机体的免疫反应;(6)参与前致物的活化。目前,COX-2及其抑制剂已成为抗肿瘤研究的又一热点,有研究报道COX-2抑制剂对细胞增殖的影响作用途径之一可能是通过调节P-gp的表达来实现[8]。COX-2抑制剂用于实体瘤的多药耐药研究已有报道,用于血液系统恶性肿瘤的多药耐药的研究报道不多。本研究将基于近年来应用单药苦参碱或COX-2抑制剂塞来昔布逆转肿瘤耐药的基础上采用两药联合应用的方法,进一步观察两药联合用于血液肿瘤时对多药耐药的影响。因中药本身具有抗癌作用或者可以通过调节机体免疫功能等协同化疗药物杀死肿瘤细胞,且中药又具有来源广泛、价格低廉、毒副作用小等特点,我们选用中西药联合作为逆转剂,通过两种药物的协同作用可以使单药的剂量减小,在获得更好的治疗效果的同时减少了毒副反应。
本研究中MTT法实验结果显示:苦参碱≤225μg·ml-1、塞来昔布≤11.5μg·ml-1对K562细胞系和K562/AO2细胞系均无直接细胞毒性。苦参碱200μg·ml-1、塞来昔布7.5μg·ml-1能明显增强 ADM对 K562/AO2细胞系的杀伤作用。流式细胞术检测细胞凋亡的实验结果表明苦参碱≤225μg·ml-1、塞来昔布≤11.5μg·ml-1能显著增加ADM(2μg·ml-1)对K562/AO2细胞的凋亡率,单独应用 ADM时其凋亡率为(4.81±1.25)%,苦参碱联合 ADM时凋亡率为(15.31±1.07)%,塞来昔布联合ADM时凋亡率为(12.72±0.98)%,苦参碱和塞来昔布联合ADM时凋亡率为(29.82±0.23)%。RT-PCR实验结果显示,K562/AO2细胞系的MDR1和COX-2mRNA高表达。苦参碱、塞来昔布单独加用ADM作用时均可不同程度地使MDR1和COX-2mRNA表达下调,联合应用时下调明显,且MDR1和COX-2mRNA的表达具有明显的一致性。在Western blotting法检测细胞P-gp和COX-2蛋白表达的实验中显示了和RT-PCR实验一致的结果。本研究显示的化疗药物可通过诱导COX-2的表达以及COX-2的表达与P-gp表达的相关性结果,为MDR产生机制的研究提供新的方向,且对MDR的逆转开辟了新的思路,COX-2选择性抑制剂的使用可能成为临床上逆转MDR的选择之一,有望提高抗肿瘤药物疗效。
[1]STEINBACH G,LYNCH PM,PNILLIPSRK,et al.The effect of celecoxib,a cyclooxygenase-2 inhibitor,in familial adenomatous poiyposis[J].N Engl JMed,2000,342(26):1946-1952.
[2]MENTER D G,SEHILSKY R L,DUBOIS R N.Cyclooxygenase-2 and cancer treatment:understanding the risk should be,worththereward[J].Clin Cancer Res,2010,16(5):1384-1390.
[3]张梦曦,顾康生.化疗药物与肿瘤细胞环氧化酶-2表达及多药耐药之间相互关系的研究进展[J].临床肿瘤学杂志,2009,14(4):377-380.
[4]寿倍明,陈宝安,周冬蕊,等.p16基因在K562/AO2细胞株表达情况的研究[J].东南大学学报:医学版,2008,27(3):151-153.
[5]杨晓华,沙慧芳,冯久贤,等.人肺腺癌紫杉醇耐药细胞株的建立及其特性研究[J].现代医学,2009,37(1):34-37.
[6]YU L,WU W K K,LI Z J,et al.Enhancement of doxorubicin cytotoxicity on human esophageal squamous cell carcinoma cells by indomethacinand4-[5-(4-Chlorophenyl)-1H-Pyrazol-1-yl]benzenesul-fonamide(SC236)via inhibiting P-glycoprotein activity[J].Mol Pharmacol,2009,75:1364-1373.
[7]WANG CH,ZHENGW B,QIANG O,et al.Effects of non-cytotoxic drugs on the growth ofmultidrug-resistance human gastric carcinoma cell line[J].Journal of Digestive Diseases,2009,10:91-98.
[8]FANTAPPIÈ O,SOLAZZO M,LASAGNA N,et al.Multiple drug-resistant cell lines,P-glycoprotein mediates celecoxib-Induced apoptosis[J].Cancer Res,2007,67:4915-4923.

