RhoB抑制慢性粒细胞白血病细胞的生长
姚红,朱晓苏,徐康萍,周海侠,赵昀
(1.苏州大学唐仲英血液学研究中心,江苏苏州 215123;2.苏州大学附属第一医院血液科,江苏苏州 215006)
人类慢性粒细胞白血病(chronic myeloid leukemia,CML)是源自造血干细胞的恶性血液肿瘤。格列卫能缓解慢性期CML患者的症状,但单一药物尚不能治愈。寻找新的靶点、设计新药物已成为CML研究领域的热点[1]。哺乳动物Rho家族属于小GTP结合蛋白,包括22个成员[2]。其中RhoA,Rac1和Cdc42已被广泛研究。大量研究发现Rho蛋白调控癌细胞的增殖、存活、浸润与血管新生[3]。例如,RhoA、RhoC 以及Rac1、Cdc42 促进肿瘤形成、癌细胞侵袭和转移[4]。RhoB是Rho家族中较为特殊的一员,在实体肿瘤中则作为抑制子或负性调控子。脂类修饰是调控RhoB功能的重要方式之一,RhoB蛋白能进行法尼基(F)和牻牛儿基牻牛儿基(GG)两种修饰,这与多数其它Rho蛋白仅能进行一种类型的脂类修饰不同[5]。这些研究为实体肿瘤的治疗提供了新思路。但是,目前RhoB在人CML中的作用及其机制尚不明确。本研究使用慢病毒在人CML细胞中过表达RhoB,研究其对CML细胞增殖能力的影响;使用几种与RhoB脂类修饰相关的突变体研究RhoB是否需要脂类修饰行使其生物学功能及何种类型的脂类修饰是RhoB生物学功能所必需的;探讨RhoB及各种脂类修饰变体对CML细胞周期进程的影响,初步揭示RhoB对调控CML细胞生长的作用机制,为CML的治疗提供实验基础及理论依据。
1 材料和方法
1.1 材料
1.1.1 细胞 人成巨核细胞白血病MEG-01细胞系(BCR-ABL阳性)购于上海中国科学院细胞库。CML患者骨髓样本来源于苏州大学附属第一医院。
1.1.2 主要试剂 Ex Taq DNA聚合酶、PMD19-T载体、T4DNA连接酶、EcoRⅠ、XhoⅠ、BglⅡ限制性内切酶均购于TaKaRa公司,碘化丙啶、RNase A和鼠抗人单克隆Actin抗体购于Sigma公司。PCR引物合成及基因序列检测均由上海生物工程公司完成。兔抗人RhoB多克隆抗体购于Santa Cruz Biotechnology公司。CD34细胞纯化试剂盒、纤粘连蛋白、甲基纤维素均购于StemCell Technologies公司。
1.1.3 主要仪器 流式细胞分析及分选仪(美国BD,Beckman Coulter),紫外凝胶成像仪(美国 Bio-Rad),垂直电泳仪和转印电泳仪(上海天能),PCR仪(德国Biometra),倒置显微镜(日本Olympus)。
1.2 实验方法
1.2.1 RhoB基因及其3个脂类修饰变体的克隆 参考NCBI网站公布的RhoB cDNA序列,设计如表1所示PCR引物[5]。PCR扩增出目的片段后使用T4DNA连接酶与PMD19-T载体连接,用BglⅡ将测序正确的目的基因切割纯化,再与线性化的Venus载体连接。用EcoRⅠ和XhoⅠ酶切鉴定连接正反向。

表1 RhoB基因及其3个脂类修饰变体PCR引物设计Tab 1 List of primer sequences
1.2.2 慢病毒的制备 将慢病毒表达载体通过磷酸钙沉淀的方式将其与其他3种包装质粒△R,VSV-G和Rev共转染293T细胞,收集转染后48和72 h的培养上清,0.22 μm滤膜过滤后进行分装,-80℃保存备用。将病毒上清进行1次超离心浓缩,获得超过100倍的浓缩病毒。
1.2.3 CML患者CD34+细胞的纯化与病毒侵染 将CML患者骨髓样本经密度梯度离心分离出骨髓单核细胞,利用免疫磁珠正向富集的方法纯化出CD34+细胞。细胞培养2 d后进行病毒侵染。先将浓缩病毒加到包被有纤粘连蛋白的96孔板中,4℃放置1~2 h后加入细胞,37℃共孵育12 h,PBS洗涤细胞3次后继续培养,72 h后进行流式分选,YFP+细胞用于实验。
1.2.4 细胞增殖和集落生成实验 细胞增殖实验:在24孔板中每孔种植5×104个YFP+细胞,培养的第3天和第6天分别进行细胞计数。集落生成(colonyforming cell,CFC)实验:在甲基纤维素中加入双抗、IMDM培养基和细胞,混匀后取1.1 ml接种到直径为3.5 cm小皿中,37℃培养,2周后进行集落计数。
1.2.5 细胞周期分析 取1×106YFP+的细胞,70%乙醇固定过夜,加入 RNase A(100 μg·ml-1),37 ℃孵育30 min,再加入碘化丙啶(40 μg·ml-1),流式细胞仪检测[6]。
1.2.6 蛋白质印迹法检测过表达的蛋白 收集2×106YFP+细胞,PBS清洗2次,加入蛋白裂解液,冰上裂解15 min,4℃ 14 000×g离心20 min,收集上清,进行蛋白定量。蛋白样品加入5×SDS加样缓冲液,100℃煮沸5 min,进行12%SDS-PAGE,转移至PVDF膜,5%脱脂奶粉室温封闭1 h,以合适的稀释比加入一抗4℃摇床过夜,TBST洗涤4次,加入辣根过氧化物酶标记的二抗,室温孵育1 h,最后用 ECL试剂显影[7]。
1.3 统计学分析
所有实验均重复3次以上,数据采用GraphPad Prism 5.0处理。结果以±s表示,组间比较采用t检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 基因克隆与载体构建
如图1A所示,基因测序结果证实我们成功获得野生型RhoB、脂类修饰缺失的变体RhoBC193G、只进行F修饰的变体RhoB-F(C-端残基CKVL突变为CAIM)及只进行GG修饰的变体RhoB-GG(C-端残基CKVL突变为CLLL)。并成功构建了表达RhoB及其变体的各类慢病毒载体,目的基因由SFFV(Spleen Focus Forming Virus)启动子驱动,YFP报告基因可示踪病毒转导的细胞(图1B)。蛋白质印迹实验显示RhoB及其变体均获得了成功表达(图1C)。

图1 基因克隆与载体构建A.Gene sequence data;B.Schematic structure of lentiviral vector;C.Western blotting to detect the protein expression Fig 1 Gene cloning and vector construction
2.2 RhoB抑制MEG-01细胞的增殖
如图2A所示,过表达RhoB后,培养第3天Venus组和RhoB组的细胞增殖并没有显著差异,而第6天RhoB组的细胞生长明显受到抑制(P<0.01)。另外,在集落生成实验中RhoB组的细胞集落生成能力与Venus组相比受到显著抑制(P<0.01),抑制率约为45%(图2B)。

图2 RhoB对MEG-01细胞增殖能力的影响A.Cell liquid culture;B.Colony-forming cell assayFig 2 The effect of RhoB on MEG-01 cell proliferation
2.3 RhoB抑制CML患者CD34+细胞的增殖
为了检测RhoB能否抑制CML病患CD34+细胞的增殖,随机选取3个CML初诊患者的骨髓样本并纯化出CD34+细胞进行集落生成实验。结果如图3所示,过表达RhoB后3个样本的集落生成能力与Venus组相比均明显受到抑制,平均抑制率约为90%。
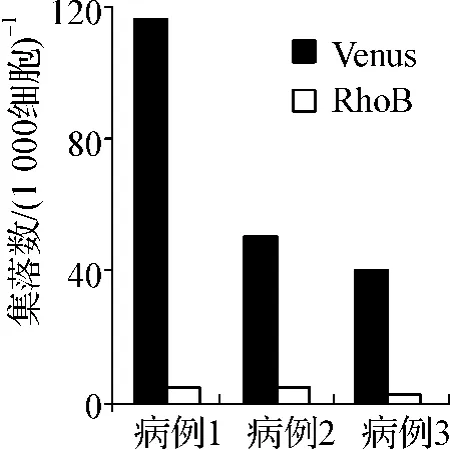
图3 RhoB对CML患者CD34+细胞增殖能力的影响Fig 3 The effect of RhoB on the proliferation of CD34+cells from CML patients
2.4 RhoB抑制MEG-01细胞生长需要脂类修饰
为了验证RhoB在MEG-01细胞中行使的抑制功能是否与其蛋白的脂类修饰相关,我们构建了RhoB的脂类修饰缺失变体RhoBC193G。结果发现,过表达RhoBC193G后细胞生长速度几乎与Venus组细胞一致,细胞总数无明显差异(P>0.05,图4A)。此外,RhoBC193G与Venus组相比集落生成能力也无显著差异(P >0.05,图4B)。
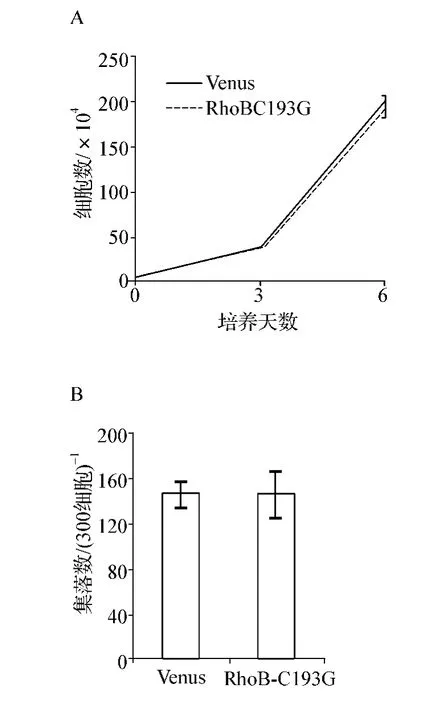
图4 RhoB抑制功能与其脂类修饰相关性A.Cell liquid culture;B.Colony-forming cell assayFig 4 The association of the inhibitory effect of RhoB with its lipid modification
2.5 F修饰或GG修饰抑制MEG-01细胞的增殖
为了检测RhoB在MEG-01细胞中行使其抑制作用与哪一种脂类修饰相关,我们在细胞中过表达只进行F修饰或只进行GG修饰的RhoB变体。结果发现,这两种脂类修饰变体单独过表达都可以显著抑制细胞的增殖(P<0.01,图5A)和集落生成能力(P<0.05,图5B)。
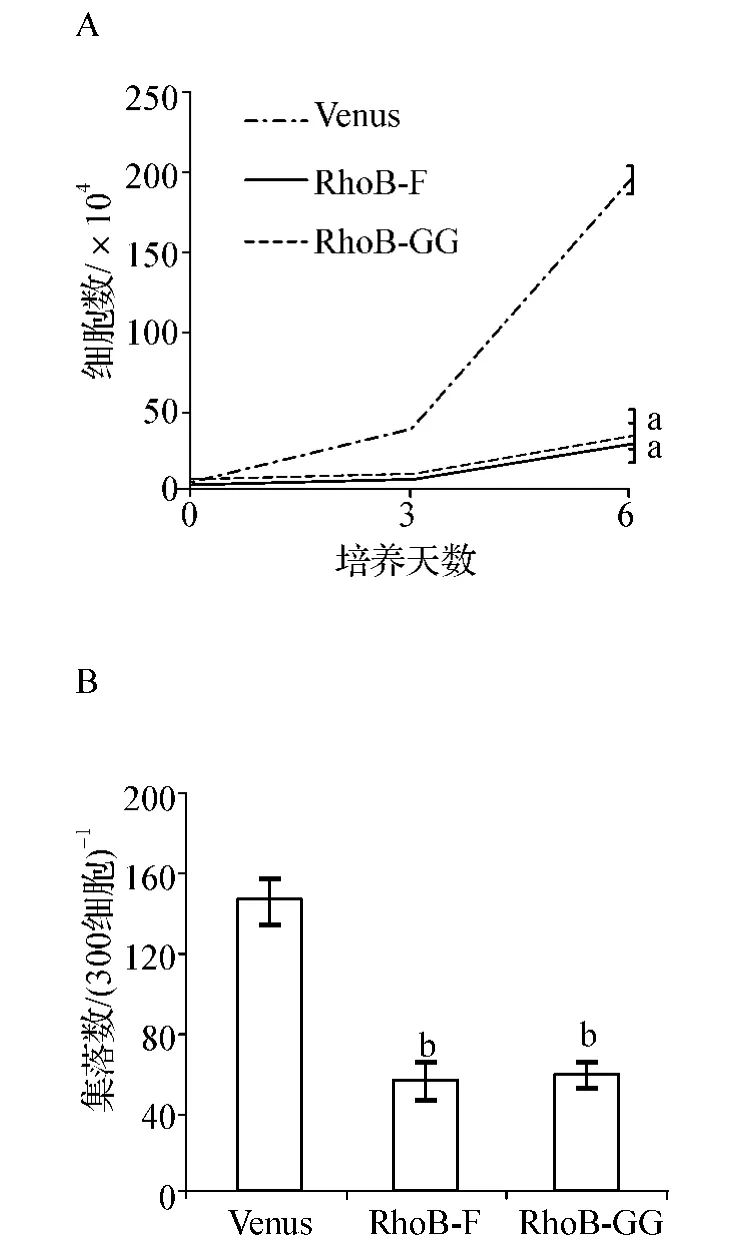
图5 单一脂类修饰对MEG-01细胞增殖的影响A.Cell liquid culture;B.Colony-forming cell assayFig 5 The effect of mono-lipid modification on the proliferation of MEG-01cells
2.6 RhoB 阻滞MEG-01细胞于G2/M期
为了初步探索RhoB抑制MEG-01细胞生长的机制,我们利用流式细胞仪检测过表达RhoB及其变体后MEG-01细胞的生长周期进程。结果(图6)发现,分别过表达RhoB或RhoB-F、RhoB-GG后,处于G0/G1期的细胞与Venus组相比明显减少(RhoB 34.58%±2.29%,RhoB-F 34.65% ±0.22%,RhoB-GG 39.71% ±1.12%,Venus 46.68% ±0.96%,P<0.05);而处于G2/M期的细胞则比Venus组显著增多(RhoB 30.16% ±2.05%,RhoB-F 33.3% ±1.58%,RhoB-GG 28.75% ±0.50%,Venus 18.21% ±1.59%,P<0.05)。相比之下,RhoBC193G组无论是处于G0/G1期(47.32% ±0.61%)还是 G2/M期(18.11% ±0.84%)的细胞百分比基本与Venus组一致。这些结果说明RhoB将MEG-01细胞阻滞在G2/M期。

图6 RhoB及其脂类修饰变体对MEG-01细胞周期的影响Fig 6 The effect of RhoB and its mutants on the cell cycle of MEG-01 cells
3 讨 论
Rho家族成员中RhoB较为特殊。许多Rho蛋白在恶性转化方面起正向调控作用,而RhoB的功能却恰恰相反。研究发现RhoB在尿路上皮细胞癌、鳞状细胞癌中表达显著降低,并且在肺部肿瘤恶化过程中伴随有RhoB基因的丢失[8-9]。RhoB基因敲除小鼠出生频率、发育和寿命都正常,但是使用DMBA/TPA进行化学处理诱导形成皮肤肿瘤时,这些小鼠的成瘤率更高[10]。利用裸鼠皮下成瘤模型,在卵巢癌细胞中过表达RhoB可以抑制肿瘤的生长[11]。这些结果说明RhoB在实体瘤中可能是肿瘤抑制基因。但是RhoB是否在恶性血液病CML中同样行使抑制功能却不得而知。通过细胞增殖和集落生成实验发现,CML细胞中过表达RhoB后细胞的增殖受到明显抑制。结果表明CML细胞中RhoB依然行使抑制功能。
RhoB表达水平因细胞周期而异,RhoB转录本半衰期是30 min,这要远远比Rho蛋白家族其它成员短[12]。这就表明RhoB的功能要求它的表达受到严格的调控。其中一项重要的调控就是RhoB蛋白的脂类修饰,细胞中的RhoB蛋白被特异性地进行了两种脂类修饰,F修饰和GG修饰。不同类型的脂类修饰可能导致RhoB蛋白在质膜、核膜、晚期内涵体等亚细胞水平不同的定位。RhoB-F蛋白大部分定位在质膜上,RhoB-GG蛋白则主要定位在晚期内涵体中[13]。一些研究表明RhoB-F、RhoB-GG这两种脂类修饰形式具有不同的生物学功能。在Ras转化的小鼠NIH3T3成纤维细胞中,RhoB和RhoB-GG起到抗转化、抗增殖、诱导凋亡的作用[14]。而RhoB-F能够选择性地维持内皮细胞和经辐照处理的细胞的存活[15-16]。另外,RhoB,RhoB-F和RhoB-GG能抑制胰腺癌、宫颈癌细胞的生长[5]。本研究中,我们在MEG-01细胞中过表达RhoBC193G,发现失去脂类修饰后,细胞增殖与Venus组相比并无明显差异,表明脂类修饰是RhoB抑制MEG-01细胞增殖所必需的。MEG-01细胞中分别过表达RhoB-F和RhoB-GG后细胞增殖也同样受到抑制,表明单种脂类修饰仍然能够维持RhoB在MEG-01细胞中的抑制功能。另外,细胞周期检测发现RhoB,RhoB-F,RhoB-GG都可将MEG-01细胞阻滞在G2/M期,而RhoBC193G过表达的细胞周期进程却与Venus组细胞一致,表明RhoB蛋白的脂类修饰影响MEG-01细胞的周期进程,进而抑制细胞的增殖。
综上所述,本研究的功能学实验结果和细胞机制分析说明RhoB抑制CML细胞的生长,并且RhoB蛋白进行任何一种脂类修饰均能在CML细胞中行使抑制功能,同时经过两种脂类修饰或是单种脂类修饰的RhoB均可阻滞CML细胞于G2/M期。关于RhoB如何在MEG-01细胞中行使抑制功能进一步的分子机制还不明确,深入探索其分子机制将有助于CML治疗方法的研究和靶向药物的筛选。
[1]SHERBENOU D W,DRUKER B J.Applying the discovery of the Philadelphia chromosome[J].J Clin Invest,2007,117:2067-2074.
[2]MULLOY J C,CANCELAS J A,FILIPPI M D,et al.Rho GTPases in hematopoiesis and hemopathies[J].Blood,2010,115:936-947.
[3]PRENDERGAST G C.Actin'up:RhoB in cancer and apoptosis[J].Nat Rev Cancer,2001,1:162-168.
[4]HUANG M,PRENDERGAST G C.RhoB in cancer suppression[J].Histol Histopathol,2006,21:213-218.
[5]CHEN Z,SUN J,PRADINES A,et al.Both farnesylated and geranylgeranylated RhoB inhibit malignant transformation and suppress human tumor growth in nude mice[J].J Biol Chem,2000,275:17974-17978.
[6]吴平平,苏昀,金治,等.RhoA蛋白通路在DLC-1基因调控人结肠癌HT29细胞周期中的作用及其机制[J].东南大学学报:医学版,28(4):247-251.
[7]曹倪豪,陈明.BTG1在肾透明细胞癌组织中的表达及对786-O细胞株增殖和凋亡的影响[J].东南大学学报:医学版,2011,30(4):583-587.
[8]VOLANIS D,ZARAVINOS A,KADIYSKA T,et al.Expression profile of Rho kinases in urinary bladder cancer[J].J BUON,2011,16:511-521.
[9]MAZIERES J,ANTONIA T,DASTE G,et al.Loss of RhoB expression in human lung cancer progression[J].Clin Cancer Res,2004,10:2742-2750.
[10]LIU A X,RANE N,LIU J P,et al.RhoB is dispensable for mouse development,but it modifies susceptibility to tumor formation as well as cell adhesion and growth factor signaling in transformed cells[J].Mol Cell Biol,2001,21:6906-6912.
[11]COUDERC B,PRADINES A,RAFII A,et al.In vivo restoration of RhoB expression leads to ovarian tumor regression[J].Cancer Gene Ther,2008,15:456-464.
[12]ZALCMAN G,CLOSSON V,LINARES-CRUZ G,et al.Regulation of Ras-related RhoB protein expression during the cell cycle[J].Oncogene,1995,10:1935-1945.
[13]WHERLOCK M,GAMPEL A,FUTTER C,et al.Farnesyltransferase inhibitors disrupt EGF receptor traffic through modulation of the RhoB GTPase[J].J Cell Sci,2004,117:3221-3231.
[14]MAZIERES J,TILLEMENT V,ALLAL C,et al.Geranylgeranylated,but not farnesylated,RhoB suppresses Ras transformation of NIH-3T3 cells[J].Exp Cell Res,2005,304:354-364.
[15]ADINI I,RABINOVITZ I,SUN J F,et al.RhoB controls Akt trafficking and stage-specific survival of endothelial cells during vascular development[J].Genes Dev,2003,17:2721-2732.
[16]MILIA J,TEYSSIER F,DALENC F,et al.Farnesylated RhoB inhibits radiation-induced mitotic cell death and controls radiation-induced centrosome overduplication[J].Cell Death Differ,2005,12:492-501.

