草酸对微生物还原高岭土中铁的作用机制
何秋香,郭敏容,陈祖亮
1.福建农林大学资源与环境学院,福建 福州 350002
2.福建省龙岩高岭土有限公司,福建 龙岩 364000
3.福建师范大学化学与材料学院,福建 福州 350007
高岭土是一种重要的非金属矿物,具有良好的可塑性、耐火性、分散性,其广泛用于造纸、陶瓷、搪瓷、耐火材料、化学、环保、农业等领域[1]。自然界中,高岭土因含某些着色杂质而影响其自然白度和烧成白度,其中以三价氧化铁形式存在的铁矿物是最常见的杂质。目前常见的除铁方法主要有物理法和化学法,物理法(物理分选)对提高高岭土的白度和杂质的脱出有一定的局限性[2];化学法是利用高岭土本身的分散性及吸附的色素离子的物化特性,用特定的化学试剂与高岭土反应,通过漂洗、过滤,去除色素离子,来提高产品白度[3]。化学法虽然可以有效去除这些杂质,但成本较高,且容易出现二次污染,此外,有些化学物质还可能影响高岭土的理化性质[4]。研究发现,用硫酸和盐酸加温除铁时,虽然可提高白度,但会导致高岭土晶格的破坏,难以保持高岭土的晶型和物理性能[5]。杨晓杰等[6]对高岭土浸出除铁试验的研究发现,铁的溶解分为两个阶段:第一阶段溶解速度很快,主要为样品中存在的可溶性铁氧化矿物的溶出;第二阶段溶解速度很慢,主要为铝硅酸盐矿物晶格中呈类质同象替代的微量铁质的溶解。
研究发现,高岭土中Fe(Ⅲ)的去除主要有微生物除铁法和有机酸除铁增白法[7]。微生物除铁法[8]通过微生物代谢糖类产生不同的有机酸如草酸、柠檬酸等来实现除铁过程;有机酸除铁法常用的是草酸,草酸除铁工艺国内外已经有很多研究。王平[9]在高岭土中加入5%~10%的草酸,100℃水浴加热1.5 h,高岭土白度由79.5%提高至85%;进一步的研究表明,草酸能在不影响高岭土晶格结构和物理化学性质的条件下溶解矿物表面与晶格联系最牢固的铁离子。Panias等[10]研究草酸的作用机理和铁溶解动力学,证明草酸与矿粒表面的Fe(Ⅲ)反应生成几种络合物,草酸浸铁过程中形成表面络合物的溶解机理有别于无机酸对铁矿物的溶解。笔者通过微生物试验和化学试验,比较了草酸浓度对微生物以及化学还原高岭土中Fe(Ⅲ)所起的作用,同时利用ESEM,EDS等分析手段观察微生物处理和化学处理前后矿物形貌和结构的变化,以期为高岭土除铁提供新途径。
1 材料与方法
1.1 材料
试验所用高岭土由福建龙岩高岭土有限公司提供。该高岭土自然白度60.8%,1280℃烧成白度83.8%,325目(粒径为46 μm),水洗。其主要化学成分:Al2O3,37.11%;Fe2O3,0.96%;K2O,0.38%;Na2O,0.01%;SiO2,48.50%;TiO2,0.18%;CaO,0.01%;MgO,0.01%;烧失量,12.83%。为了保证样品干燥,使用前经105℃烘干处理,在干燥器中自然冷却至室温[11]。
从高岭土中筛选出铁还原菌(DIRB),以其作为菌种。经16S rRNA测序,鉴定该菌种为蜡状芽孢杆菌(Bacillus cereus/Bacillus thuringiensis),球状芽孢杆菌(Lysinibacillus sphaericus/Bacillus sphaericus)和蕈状芽孢杆菌(Bacillus mycoides)的混合菌[12]。
基础培养液:5.0 g牛肉膏,10.0 g蛋白胨,5.0 g NaCl,1000 mL 蒸馏水,调节 pH 为7.0~7.2,于121℃灭菌20 min。用于培养铁还原菌富集菌液[12]。
1.2 方法
根据Guo等[12]的研究得出混合菌还原高岭土中Fe(Ⅲ)的最佳条件:矿浆浓度为10%,菌液加入量为5%,温度为30℃,pH为6,时间为7~10 d,葡萄糖为1 g。采用厌氧培养的方法,按照添加和不添加微生物以及不同草酸浓度,进行高岭土中Fe(Ⅲ)还原试验。为了获取单因素的影响结果,试验中未添加任何氮源、钾盐等。
1.2.1 微生物处理
250 mL锥形瓶中各加入10 g的高岭土,1 g的葡萄糖,100 mL蒸馏水,添加草酸制成不同草酸浓度(分别为 0,0.1,0.2,0.3,1.0 和 1.5 g/L)的高岭土培养液。各高岭土培养液于121℃高温灭菌20 min,冷却至室温,在洁净工作台接种,各加入5 mL的铁还原菌富集菌液(A600为0.5),向锥形瓶内充氮气以除去残留的氧气,瓶口用橡胶塞密封,通过橡胶塞用注射器收集反应过程中产生的气体,置于30℃生化培养箱中培养10 d,每个条件做三个平行样。每天测定一次Fe(Ⅲ)还原量,连续测10 d,探讨草酸浓度对微生物还原高岭土中Fe(Ⅲ)的影响,以及微生物处理高岭土中Fe(Ⅲ)还原量随时间的变化。
1.2.2 化学处理
250 mL锥形瓶中各加入10 g高岭土,100 mL蒸馏水,添加草酸制成不同草酸浓度(分别为1.0,1.5,9.0和13.0 g/L)的高岭土培养液,于121℃高温灭菌20 min,冷却至室温,置于30℃生化培养箱中培养10 d,每个条件做三个平行样。培养期间每天测定一次Fe(Ⅲ)还原量,连续测10 d,探讨草酸浓度对高岭土中Fe(Ⅲ)还原量随时间变化的影响。
化学处理试验期间同时测定溶液中pH和ORP。
1.2.3 微生物处理和化学处理前后高岭土的表征
1.2.3.1 环境扫描电镜(ESEM)分析
利用荷兰Philips-FEI公司/XL30环境扫描电镜[11]表征微生物和化学处理前后高岭土的微观结构,分析处理前后高岭土的形貌变化。
1.2.3.2 能谱仪(EDS)分析
EDS是根据不同元素的X射线光子特征能量不同对成分做的一种定性半定量分析,采用EDS分析微生物处理和化学处理前后高岭土矿物微观区域的元素分布。
1.3 测试方法
Fe(Ⅲ)还原量的测定:采用邻菲啰啉分光光度法[13]测定溶液中的总铁,用Fe(Ⅱ)浓度表示。取3 mL反应后高岭土培养液,经3500 r/min离心5 min,吸取0.2 mL上清液至25 mL比色管中,加入盐酸羟胺溶液1 mL,NaAc-HAc缓冲溶液5 mL,邻菲啰啉试剂3 mL,加水至刻度线,摇匀。显色10~15 min,在波长为510 nm处测量吸光度(722N型可见光光度计,上海精密科学仪器有限公司)。根据标准工作曲线(y=5.3117x-0.0002),计算高岭土中Fe(Ⅲ)的还原量。
菌体的定量:采用722N型可见光光度计测定A600。
pH和ORP采用精密pH计(PHS-3C型,上海精密科学仪器有限公司)和氧化还原电位(ORP)测定仪(ORP-421型,上海康仪仪器有限公司)测定。
2 结果和讨论
2.1 草酸浓度对微生物还原Fe(Ⅲ)的影响
笔者前期试验结果表明,草酸对Fe(Ⅲ)还原的促进作用比较明显[14],许多文献表明草酸是微生物代谢过程中可能产生的有机酸之一[1,15-17]。以不添加草酸的异化铁还原菌(DIRB)组作为对照,探讨了草酸浓度对微生物还原高岭土中Fe(Ⅲ)的影响,结果如图1所示。
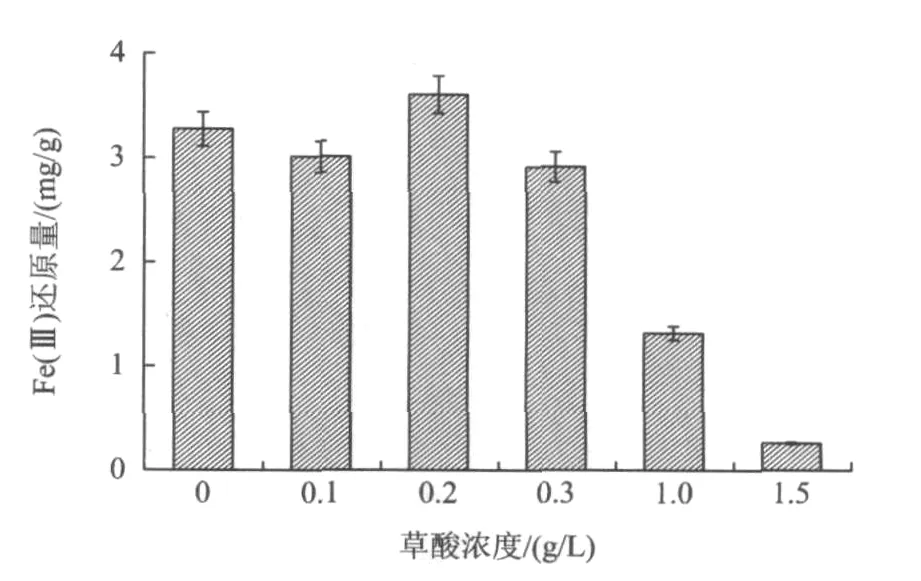
图1 草酸浓度对微生物还原Fe(Ⅲ)的影响Fig.1 Effect of different concentration of oxalic acid on iron content leached
由图1可知,与对照(0 g/L)相比,在微生物存在的情况下,加入0.2 g/L草酸时Fe(Ⅲ)的还原量最大(3.6 mg/g),草酸浓度过高或过低对Fe(Ⅲ)的还原都有抑制(还原量低于对照),当草酸浓度为1.5 g/L时Fe(Ⅲ)的还原被抑制,Fe(Ⅲ)还原量最低。草酸具有良好的传递电子能力,可以作为微生物的电子传递体,一些铁还原菌不但可利用纤维素等有机物,还可利用各种有机酸和烃类化合物及芳香族化合物作为能源,草酸也可以作为微生物可利用的碳源[18]。所以当溶液中存在低浓度草酸时,微生物可以利用草酸作为生长需要的碳源,此时微生物的活性提高,Fe(Ⅲ)的还原量增加;而当草酸浓度为1.5 g/L时,由于溶液中pH过低,微生物的生长活性被抑制。有研究[1]表明,草酸浓度低时高岭土中Fe(Ⅲ)与草酸的络合作用不明显,高岭土培养液中检测到的Fe(Ⅱ)是由于草酸的浸出作用所致。
草酸浓度对微生物和化学还原高岭土中Fe(Ⅲ)的影响如图2所示。由图2可知,草酸浓度为1.0~1.5 g/L是微生物活性的分界点,对比草酸浓度为1.5 g/L时微生物处理和化学处理发现,草酸完全抑制了微生物的活性,其微生物处理和化学处理的Fe(Ⅲ)还原量相当;草酸浓度为1.0 g/L时微生物处理较化学处理的Fe(Ⅲ)还原量高,但和对照相比Fe(Ⅲ)还原量降低很多,说明微生物在草酸浓度为1.0 g/L时仍有活性,此时化学浸出作用不明显,草酸浓度达到1.5 g/L时微生物的活性完全被抑制,转为化学浸出作用。
从图2(a)可以发现,对照及草酸浓度为0.1~0.3 g/L时,Fe(Ⅲ)的还原量从第2天起到第8天迅速增加,草酸浓度为0.2 g/L时对Fe(Ⅲ)的还原作用最好,而草酸浓度为0.1和0.3 g/L都对Fe(Ⅲ)的还原有轻微的抑制作用。当草酸浓度为1.0 g/L时,抑制作用明显,草酸浓度达到1.5 g/L时,完全抑制了微生物的活性,溶液中仅为化学浸出作用。
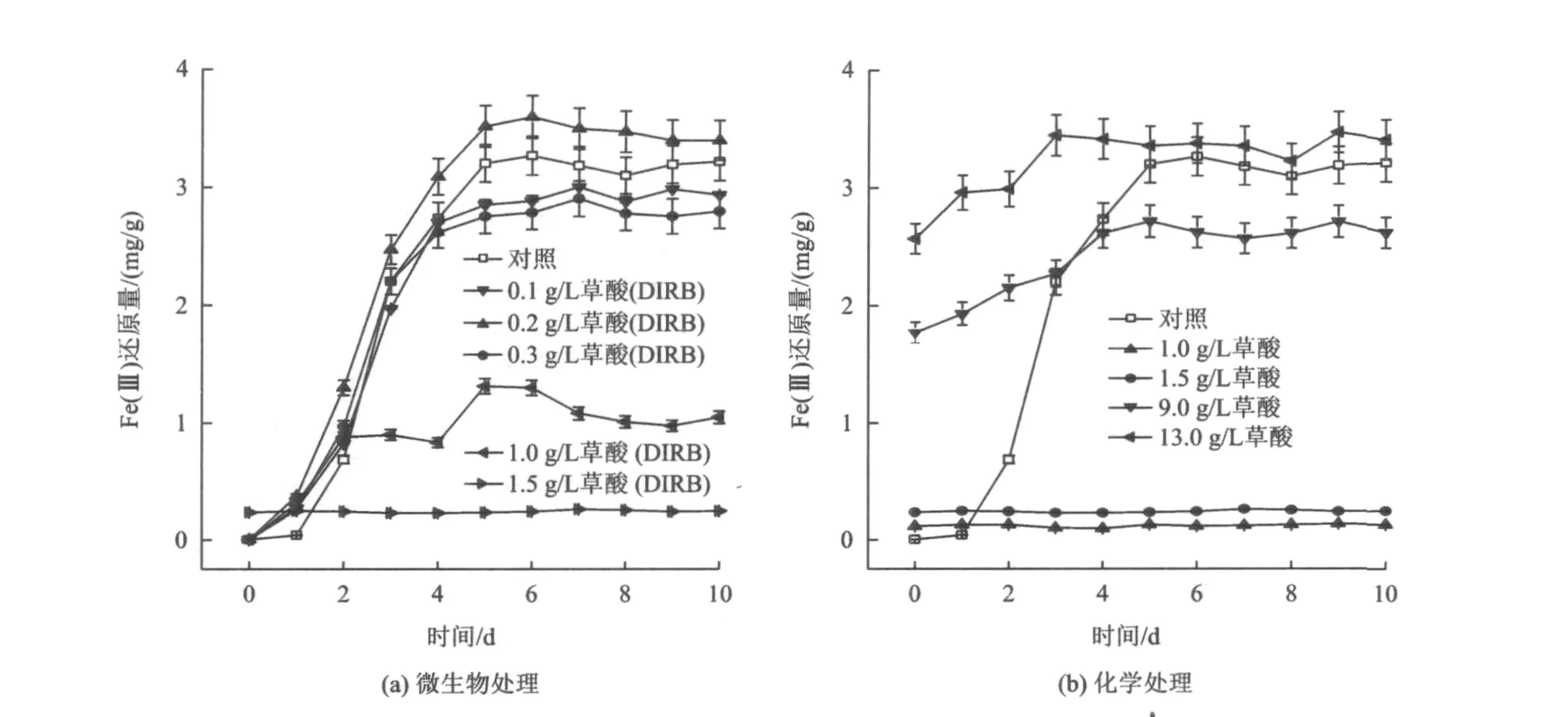
图2 草酸浓度对微生物和化学还原高岭土中Fe(Ⅲ)的影响Fig.2 The effect of different concentration of oxalic acid on iron impurity reducing with chemical and biological methods
在草酸浓度较高时,由于酸度过高不适于该铁还原菌的存活,则以化学作用为主。黄念东等[19]的研究表明:当pH大于1.2时,由于铁不能以离子的形式存在,难与草酸形成络合物,所以除铁效果差;而当pH小于1.2时,用盐酸溶液进行浸出,溶液中的含铁量仅为28 mg/L,说明草酸的高浸铁能力是草酸根具有络合能力决定的,并不是盐酸作用所致,盐酸在此的主要作用是控制溶液的pH[19]。化学浸出试验〔图2(b)〕发现,随着草酸浓度的增大,Fe(Ⅲ)的还原量也逐渐增加,当草酸浓度达到13.0 g/L时,1天后Fe(Ⅲ)还原量与微生物处理4天后Fe(Ⅲ)还原量相当。其原因是还原量随草酸浓度增加,根据络合反应3C2O24-+Fe3+→[Fe(C2O4)3]3-可知,溶解1 mol/L Fe(Ⅲ)需要3 mol/L草酸根离子[19],所以草酸浓度越高,溶铁能力越强。
图3反映了Fe(Ⅲ)溶出过程中溶液中pH和ORP随时间的变化。由图3(a)可知:当溶液中有微生物发酵作用时[20],随着反应的进行,对照组 pH由初始的5.30降为4.20左右,而草酸浓度为1.0 g/L的试验组,其pH由初始3.84升高到4.10,5 d后两组pH基本都维持为4.15,与笔者前期对小分子有机酸的研究结果相同[14],说明微生物在代谢糖类的过程中产生HCO3-和H+,随着反应的进行,有机酸的累积和缓冲作用使得pH保持不变[21];此外,草酸浓度为1.5和13.0 g/L的化学浸出试验,由于没有微生物的代谢作用,其pH在Fe(Ⅲ)还原过程中维持在3.50和1.50,基本不发生变化。
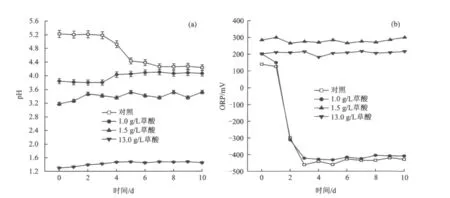
图3 化学处理高岭土培养液中pH和ORP随时间的变化Fig.3 The variations of pH and ORP with chemical method
由图3(b)可知,在浓度为1.5和13.0 g/L草酸的化学浸出试验中,随着作用时间的延长,Fe(Ⅲ)的浸出量逐渐增加,显示ORP的变化趋势与pH的变化趋势相吻合。可能是有机酸把不溶性的氧化铁溶解为可溶性的铁,溶液中并未发生生物还原,溶液的pH及ORP基本维持恒定,ORP>200 mV。而对照组及草酸浓度为1.0 g/L的微生物试验,由于微生物的生长和对碳源的代谢作用,使溶液的pH发生变化,同时使ORP降至-450 mV,微环境逐渐转为还原态[20],有利于 Fe(Ⅲ)还原。
2.2 处理前后高岭土的特性
2.2.1 ESEM表征
微生物处理和化学处理前后高岭土结构的扫描电镜如图4所示。

图4 高岭土扫描电镜Fig.4 Environmental scanning electron microscopy(ESEM)
从图4(a)可以看出,高岭土块状结构较多,针状结构少;从图4(b)可以看出,微生物处理后矿物块状结构基本变为针状结构,这可能是高岭土晶体浸泡、解离、散开造成的,没有次生矿物产生[12];从图4(c)可以看出,高岭土仍可看见清晰的片状结构,表面分布比较多的针状结构;从图4(d)可以看出,化学作用后多为针状结构,片状结构分布较少。有研究[22]表明,微生物能够大大加快矿物风化和转化反应的进程,钨矿石经硅酸盐细菌作用8 d,有9%的钨被溶出,进一步通过扫描电镜分析发现,经硅酸盐细菌作用后,矿物边缘模糊不清,表面凹凸不平,有明显溶蚀痕迹,而未被作用的颗粒则棱角分明。所以在微生物与高岭土作用的过程中,微生物使块状晶体破碎,其对矿物的生物风化作用促使高岭土向次生矿物转化[16]。但由于风化时间较短,DIRB还未使矿物转化为次生矿物[23]。
2.2.2 EDS分析
微生物处理和化学处理前后高岭土的EDS分析如图5所示。
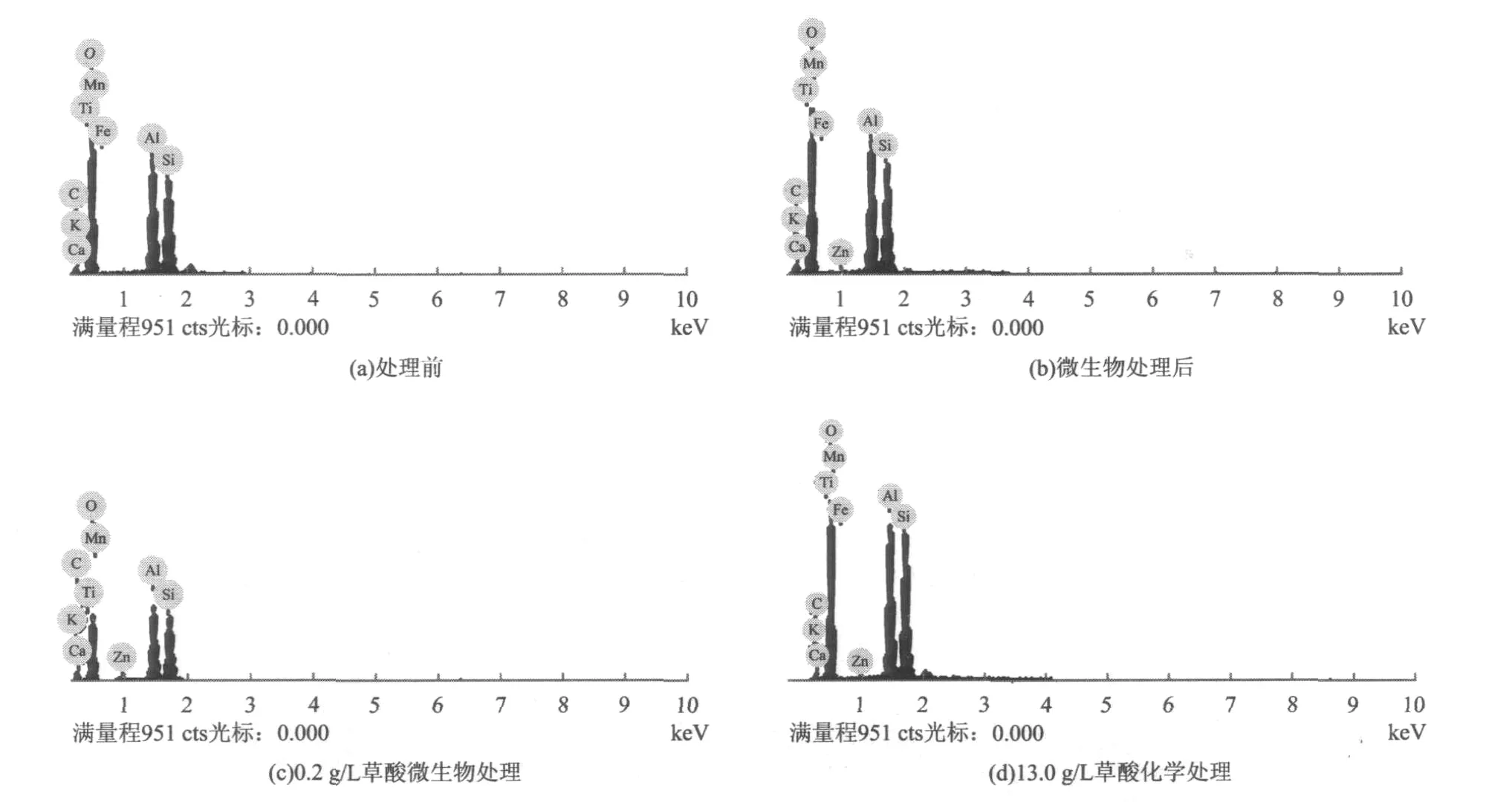
图5 高岭土在微生物和化学处理前后的能谱Fig.5 Energy-dispersion microanalysis(EDS)
从图5(a)和图5(b)可以看出,矿物中存在着Si,Al,O,Mg,Na,Fe 和 C 等,其中高岭土微生物处理前后主要元素成分和处理前大致一样,并没有发生很大的变化,而Fe(Ⅲ)浓度明显减少,由0.39%降为0.22%;从图5(b)和图5(c)对比发现,矿物经过微生物添加0.2 g/L草酸处理后主要成分和图5(b)相差不大,但图5(c)基本没有检测到铁元素的能谱,说明在0.2 g/L草酸微生物处理后Fe(Ⅲ)的还原效果更明显;从图5(d)可以看出,成分中C的浓度明显减少,Fe(Ⅲ)浓度由0.39%降为0.26%,这表明生物还原能在不破坏矿物结构的情况下有效地减少Fe(Ⅲ),而草酸的化学浸出作用与盐酸、硫酸等强酸溶剂的酸浸漂白法相比,具有一定的优势,它能在不破坏矿物重要成分的情况下,在较短的时间内去除高岭土中的Fe(Ⅲ)。
3 结论
(1)在微生物存在的情况下加入浓度为0.2 g/L的草酸,对Fe(Ⅲ)的还原效果最好,草酸浓度过高或过低都对Fe(Ⅲ)的还原有抑制作用,当草酸浓度为1.5 g/L时,微生物活性完全被抑制,此时Fe(Ⅲ)的还原量最低。
(2)化学浸出作用随着草酸浓度的增加,浸出量逐渐增大,当草酸浓度达到13.0 g/L时,化学处理1天后Fe(Ⅲ)的还原量与微生物处理4天后相当。
(3)经过EDS,ESEM对高岭土微生物和化学处理前后的扫描比较,表明微生物可以侵入高岭土的内部结构,并将内部的铁去除,高岭土铁的生物还原可能是矿物的生物风化过程;高岭土添加草酸的微生物处理法结合了传统的化学漂白法的时间短、速度快和微生物还原法的常温下处理,具有不改变矿物化学结构和主要成分的优点,应用前景很好。
[1]HOSSEINI M R,PAZOUKI M,RANJBAR M,et al.Bioleaching of iron from highly contaminated kaolin clay by Aspergillus niger[J].Applied Clay Sci,2007,37:251-257.
[2]董文辉,苏昭冰,刘媛媛,等.高岭土漂白实验研究[J].中国非金属矿工业导刊,2008(1):23-26.
[3]侯太鹏.高岭土除铁增白实验研究[J].非金属矿,2001,24(4):32-35.
[4]袁欣,袁楚雄,钟康年,等.非金属矿物的微生物加工技术研究(Ⅳ):高岭土的微生物增白研究[J].中国非金属矿工业导刊,2006(6):43-44.
[5]蔡丽娜,胡德文,李凯琦,等.高岭土除铁技术进展[J].矿冶,2008,4,51-54.
[6]杨晓杰,张荣曾,陈开惠.高岭土浸出除铁试验及铁、铝溶解动力学分析[J].选煤技术,2004(4):43-45.
[7]AMBIKADEVI V R,LALlTHAMBK A M.Effect of organic acid on ferric iron removal from iron-stained kaolinite[J].Applied Clay Sci,2000,16(3):133-145.
[8]CAMESELLE C,RICART M T,NU'NEZ M,et al.Iron removal from kaolin:comparison between‘in situ’and‘two-stage’bioleaching processes[J].Hydrometallurgy,2002,68(1/2/3):97-105.
[9]王平.那龙高岭土煅烧研究初探[J].广西煤炭,1995,13(3):148-150.
[10] PANIASD,TAXIARCHOU M,PASPALIARISI,etal.Mechanisms of dissolution of iron oxides in aqueous oxalic acid solutions[J].Hydrometallurgy,1996,42:257-265.
[11]何秋香,郭敏容,陈文瑞,等.影响高岭土中Fe(Ⅲ)生物还原的因素[J].矿物学报,2011,31(2):296-301.
[12]GUO M R,LIN Y M,XU X P,et al.Bioleaching of iron from kaolin using Fe(Ⅲ)-reducing bacteria with various carbon nitrogen sources[J].Applied Clay Sci,2010,48:379-383.
[13]国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:368-370.
[14]HE Q X,HUANG X C,CHEN Z L.Influence of organic acids,complexing agents and heavy metals on the bioleaching of iron from kaolin using Fe(Ⅲ)-reducing bacteria[J].Applied Clay Sci,2011,51:478-483.
[15]AGHAIE E,PAZOUKI M,HOSSEINI M R,et al.Response surface methodology(RSM)analysis of organic acid production for kaolin beneficiation by Aspergillus niger[J].Chem Eng J,2009,147:245-251.
[16]ŠTYRIAKOVÁ I,ŠTYRIAK I,MALACHOVSKY P.Nutrients enhancing the bacterial iron dissolution in the processing of feldspar raw materials[J].Ceramics-Silikáty,2007,51:202-209.
[17]LOVLEY D R,HOLMES D E,NEVIN K P.Dissimilatory Fe(Ⅲ)and Mn(Ⅳ)reduction[J].Adv Microbiol Physiol,2004,55:259-287.
[18]LOVLEY D R,WOODWARD J C.Mechanisms for chelator stimulation of microbial Fe(Ⅲ)-oxide reduction[J].Chemical Geology,1996,132:19-24.
[19]黄念东,夏畅斌.某高岭土细尾矿酸浸除铁的研究[J].矿产综合利用,2000(3):9-10.
[20]LEE E Y,CHO K S,WOOK R H.Microbial refinement of kaolin by iron-reducing bacteria[J].Applied Clay Sci,2002,22(1/2):47-53.
[21]ARSLAN V,BAYAT O.Removal of Fe from kaolin by chemical leaching and bioleaching[J].Clays and Clay Minerals,2009,57:787-794.
[22]李莎,李福春,程良娟.生物风化作用研究进展[J].矿产与地质,2006,20(6):577-582.
[23]GUO M R,HE Q X,LIN Y M,et al.Removal of Fe from kaolin using dissimilatory Fe(Ⅲ)-reducing bacteria[J].Clays and Clay Minerals,2010,58(4):527-534. ○

