健康双生子外周血CD4 + 和CD8 + T 细胞亚群相对计数遗传度研究
严 恺 魏 欣 董 菊 蔡文萍 孙 荷 石小翔 李 雁 侯 红 严卫丽
已有证据表明如病毒感染[1,2]、自身免疫性疾病[3]等环境因素可影响CD4+、CD8+T 细胞的数量及功能变化,当然也伴随作用于淋巴细胞的生成及发展的遗传因素[4]。结合环境与遗传因素考虑,双生子研究可被用来定量估计影响表型的遗传及环境效应大小。Hall 等[5]于2000 年针对成年健康人群研究得出了CD4+、CD8+T 细胞的遗传度,同时认为加性遗传效应对成年人群CD4+、CD8+T 细胞亚群数量有着重要影响。随后该团队又在2002 年选取不同染色体上的基因位点进一步证实了先前的研究结论,即发现这些基因与CD4+和CD8+T 细胞的数量或功能变化存在关联[6]。因机体感染可能引起体内T 细胞数量的波动[1],Clapperton 等[7]选择在无病原体级环境下饲养的健康猪群进行研究,以普通级环境下饲养的猪群作为对照,观察无病原体环境下猪群的免疫状况。在无病原体影响下计算得到的猪淋巴细胞遗传度可能更趋于真实,因此针对健康人群的CD4+、CD8+T 细胞遗传度的研究更为有意义。关于幼儿人群的淋巴细胞遗传度研究,国内外尚未见相关报道。本文基于双生子研究,应用Mx 软件及构建结构方程模型的方法,来探讨幼儿双生子人群CD4+、CD8+T细胞的遗传度,定量分析影响CD4+和CD8+T 细胞的遗传和环境效应。
1 方法
1.1 样本量计算 本研究是以满1 周岁双生子为研究对象的经典双生子研究,探索导致幼儿外周血CD4+和CD8+T 细胞相对计数变化的遗传和环境因素。样本量及把握度计算通过Mx 软件(Michael C. Neale,Department of Psychiatry,Virginia Institute for Psychiatric and Behavioral Genetics,Virginia Common Wealth)完成。按照α =0. 05、β=0.80 计算,参考国外报道成年人群CD4+和CD8+T 细胞的遗传度40% ~60%[5,6],所需样本量为29 对双生子,但因本研究选取的人群为刚年满1 周岁的幼儿双生子人群,并且考虑到样本中含有汉族和维吾尔族,与既往研究不同,故保守估计遗传度仅为0.3 的情况下,所需样本量为135 对双生子。
1.2 收集样本医院和时间 为保证纳入双生子研究对象能达到样本量需要,选择了新生儿年出生数量居新疆乌鲁木齐市前5 位的医院(新疆医科大学第一附属医院、乌鲁木齐市妇幼保健医院、新疆维吾尔自治区人民医院、中国人民解放军乌鲁木齐总医院和乌鲁木齐市第一人民医院)作为研究现场。估测上述5 所医院新生儿年出生数量,样本收集时间应持续2 年。
1.3 纳入标准 ①2009 年3 月1 日至2011 年3 月1 日出生的双生子;②父母民族同为汉族,或同为维吾尔族;③孕期保健,孕妇分娩,双生子生后1、3、6 个月和1 周岁时体格生长(身高、体重、胸围、头围)等指标评估,双生子1 周岁时抚养情况调查均在研究现场完成;④出生时已按0-1-6方案全程接种乙肝疫苗者;⑤双生子同时参加1 周岁生长发育体检。
1.4 排除标准 ①双生子中仅存留一子或均未存活者;②无法与纳入对象直系亲属取得联系者;③接种疫苗产地、类型或剂量未依据中国计划免疫方案执行(如采用非卫生部统一配备的进口疫苗、非常规重组酵母乙肝疫苗、超过常规注射剂量);④研究对象直系亲属不愿参加体检者;⑤父母有乙肝感染史;⑥研究对象出生时病案中提示出生缺陷者;⑦1 周岁内患重大疾病且未愈者;⑧1 周岁体检时处患病状态者。
1.5 医学伦理 本研究于立项前已通过新疆医科大学第一附属医院伦理委员会审查。所有研究对象在1 周岁体检时向其父母说明研究目的及内容,并征得其父母亲(一方或双方)的同意,由父母亲代研究对象决定是否参加本研究。
1.6 问卷调查 问卷包括7 部分,①一般情况:双生子出生序列、性别、出生日期和民族等;②母亲孕期状况:末次月经时间、孕次、血型和体重增加状况等;③母亲分娩状况:麻醉方式、分娩方式和产程、剖腹产原因和产后出血状况等;④双生子出生时信息:健康状况、体重和身高等;⑤双生子生长发育状况:1、3、6 个月及1 周岁时的体重和身高等;⑦双生子1 周岁内抚养情况:喂养方式、母乳喂养时间、抚养环境、患病史和辅食摄入时间等。其中一般情况、母亲分娩状况和双生子出生时状况等信息来源于各个医院在档病案,由经统一培训的调查员填入问卷。母亲孕期状况及双生子生长发育状况等信息在研究对象满1 周岁体检时由研究人员对母子保健本上信息进行登记或面对面的询问方式获得。
1.7 体格检查 根据“1995 年中国九市7 岁以下儿童体格发育调查研究”方法测量身长、体重、头围和胸围[8],身长采用上海金羊衡器厂生产的卧式标准测量床,读数精确至0.1 cm;体重采用最大载重为15 kg 的上海金羊婴幼儿专用杠杆式磅秤,以kg 为单位,读数精确至0.1 kg;头围和胸围采用软尺测量,读数均精确至0.1 cm。
1.8 实验室检测 使用真空负压EDTA-K3 抗凝管采集双生子新鲜全血2 mL,于当日送新疆医科大学第一附属医院科研中心流式细胞实验室测定CD4+和CD8+T 细胞相对计数。
1.8.1 主要材料与仪器 针对淋巴细胞表面分化抗原不同选择不同荧光素标记的单克隆抗体:CD4 异硫氰酸荧光素(FITC)标记的小鼠抗人单克隆抗体(批号IM0448U,克隆号13B8.2),8℃保存;CD8 藻红蛋白(PE)标记的小鼠抗人单克隆抗体(批号IM0452U,克隆号B9.11),8℃保存;溶血素为OPtilyse®C 免洗红细胞裂解试剂(A11894),常温下保存,均由美国Beckman-Coulter 和法国Immunotech SAS 公司生产。Coulter 流式细胞仪专用IsoFlow 鞘液和Coulter Clenz 清洗液(美国Beckman-Coulter 公司)。EPICS-Altra®四色流式细胞仪及其配套的计算机软件数据处理系统,带自动进样装置及配套数字信号处理技术(美国Beckman-Coulter®公司)。
1.8.2 实验步骤 使用直接免疫荧光标记全血溶血法,测定研究样本外周血淋巴细胞及其亚群,按说明书操作。通过流式细胞仪分析应用Cell Quest 软件荧光散点图分别计数5 000 个淋巴细胞,标记出CD4+和CD8+T 细胞的百分率。
1.9 卵型鉴定 微卫星DNA 基因分型技术由上海晶能生物公司实验室完成。采用美国GentraDNA 提取试剂盒,从EDTA 抗凝血中提取 DNA;使用 ABI 公司的AmpliTaqGoldRDNA 试剂盒,在ABI GeneAmpR9700 型PCR扩增仪上复合扩增15 个STR 位点(D3S1358、TH01、
D21S11、D18S51、Penta E、D5S818、D13S317、D7S820、D16S539、CSF1PO、Penta D、vWA、D8S1179、TPOX、FGA)以及性别标记Amelogenin;取扩增产物于ABI PRISMR3100 型DNA 遗传分析仪上电泳,最后用GeneMapperR Versions 3.1软件分析数据和自动分型,进行鉴定。每个微卫星标记扫描的结果有两个峰值,如为同卵纯合子,两个峰值应相同,反之为异卵杂合子。因此性别和15 个STR 位点基因型全部一致者判定为同卵双生子(MZ),而性别不同和(或)有一个或以上的位点基因型不同者判为异卵双生子(DZ)。该方法卵型鉴定的可靠性达99.6%以上[9]。
1.10 统计学方法 双生子的所有数据使用Access 2003数据库软件采取双人双机方式录入,在录入数据检查核对无误后进行逻辑核对,以确保原始数据录入的准确性。应用Stata 11. 0 软件(Stata Corp LP,College Station,TX,USA)对双生子各组的一般信息和相关体型指标进行统计描述并进行相关性分析;应用Mx 软件包构建结构方程模型,并计算遗传度[10]。首先分别计算MZ、DZ 两个同胞间待分析性状的组内相关系数rMZ和rDZ,并进行比较,当rDZ≥1/2rMZ时拟合适用于ACE 模型,而相反当rDZ<1/2rMZ时提示存在显性遗传作用,拟合应选用ADE 模型。采用Mx 软件构建单一性状的ACE 或ADE 模型,得到χ2、P、AIC(Akaike' s Information Criterion)和 RMSEA (Root Mean Squared Error Approximation)值等。其中,χ2值结合P 值来检验模型间差异的显著性,当P >0.05 时表明拟合的两者模型间差异无统计学意义,即两者模型间都可视为相对稳定。AIC 值<0 表示达到了较好的拟合效果,而且AIC 越小拟合效果越好。RMSEA 值通过排除样本量对拟合效果的影响来判断拟合优度,RMSEA <0.10 表明拟合较好,<0.05 表明拟合非常好。最后,结合专业知识分析遗传效应、共同环境效应及非共同环境效应各组分的作用,选择出指标最佳并且合适的模型得到各通径系数值及遗传度,进而比较遗传和环境因素对外周血CD4+和CD8+T 细胞的影响程度。
2 结果
2.1 双生子一般情况 研究期间符合纳入标准,并经过排除标准排除后进入分析的双生子共172 对,其中MZ 82 对,DZ 90 对,男性84 对,女性52 对,性别互异43 对。父母双方均汉族151 对,均为维吾尔族21 对。表1 显示MZ 和DZ组一般特征比较差异均无统计学意义,CD4+T 细胞相对计数差异有统计学意义(P=0.049 0),但两组数值都在正常参考值范围内,差异并无生物学意义,CD8+T 细胞和CD4+/CD8+T 细胞两组比较差异均无统计学意义(P >0.05)。
2.2 CD4+、CD8+T 细胞亚群与围生期、生长发育指标的相关性 表2 显示,孕妇孕龄、孕期体重增加、Apgar 评分、母乳喂养时间和1 周岁时身高增长量与CD4+、CD8+T 细胞相对计数存在弱相关性,其中Apgar 评分在MZ 组和DZ组与CD4+T 细胞相对计数均呈弱正相关性(rMZ=0.16,rDZ=0.14,P <0.05),其余指标均未能在两组中同时出现显著相关结果。
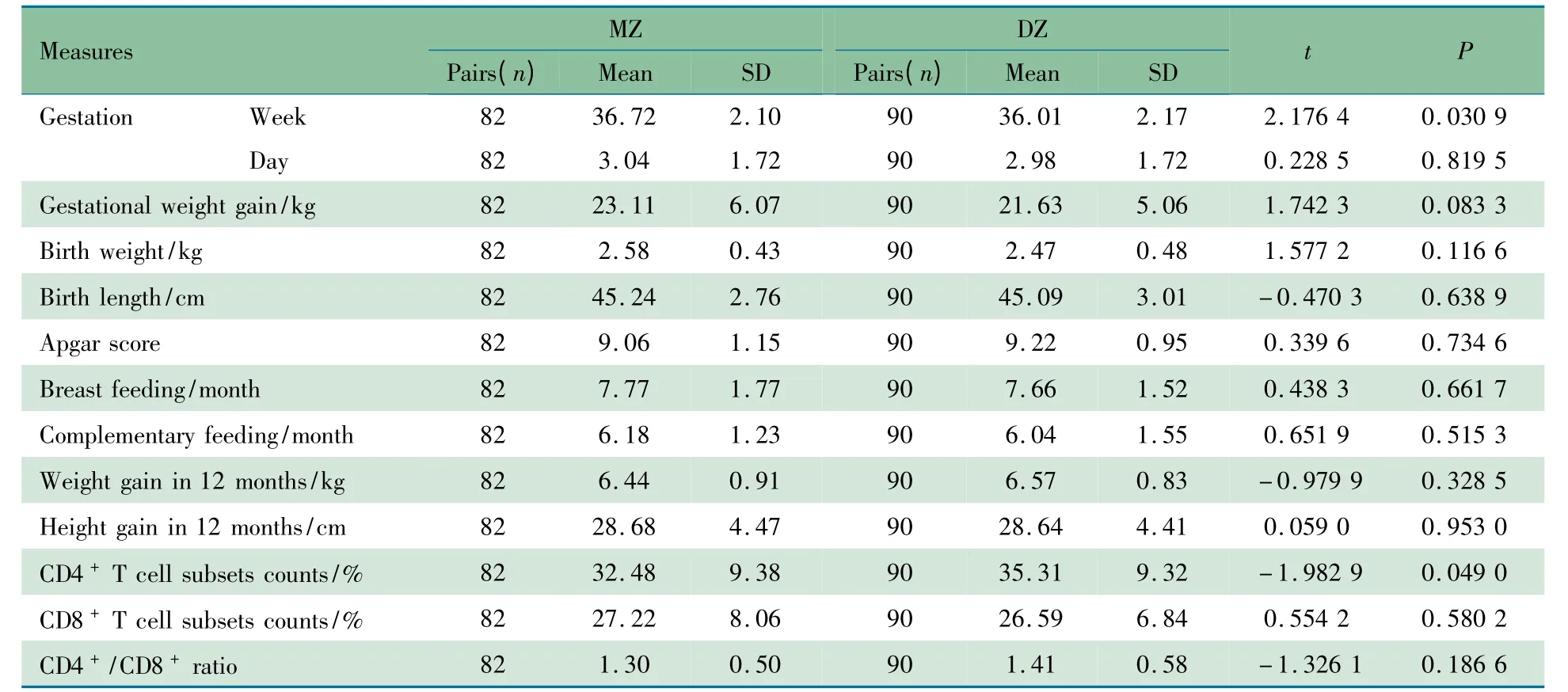
表1 双生子一般特征和CD4 +、CD8 + T 细胞亚群状况Tab 1 General characteristics and CD4 + and CD4 + T cell subsets of twins
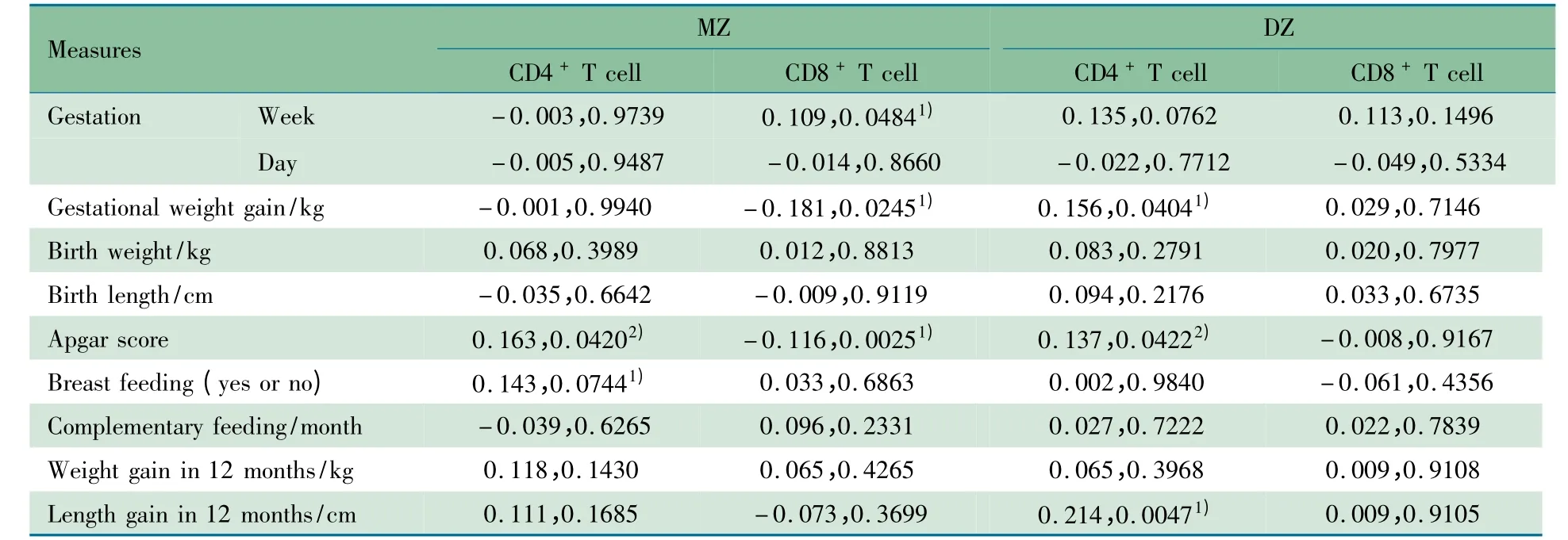
表2 双生子CD4 +、CD8 + T 细胞亚群与围生期、生长发育指标的相关性(r,P 值)Tab 2 Correlations of CD4 + and CD8 + T cell subsets with perinatal period and growth variables for overall MZ and DZ twins(r,P value)
2.3 遗传度全模型/子模型选择及遗传度计算 由于双生子之间并非独立样本,在计算遗传度之前,先将CD4+和CD8+T 细胞亚群数据以出生先后顺序进行分组,经Shapiro-Wilk 正态性检验后,各组数据均符合正态分布(P >0.05),可以用结构方程模型进行遗传度拟合。CD4+T 细胞:rMZ=0.288 6,rDZ=0.232 6,且rDZ>1/2rMZ,适用包括加性基因、共享环境和非共享环境的ACE 模型(全模型)及其嵌套模型(子模型)。CD8+T 细胞:rMZ=0. 090 4,rDZ=0.283 9,且rDZ>1/2rMZ,其遗传度计算选择ACE 模型进行拟合。
表3 显示,在CD4+T 细胞遗传度模型拟合中,ACE、AE 模型拟合成功(RMSEA <0.1,P >0.05),CE、E 模型并不符合拟合要求,未完成最佳拟合。ACE 和AE 模型间△χ2的比较差异无统计学意义(P =0.200),提示在模型中剔除共同环境效应C 后对模型的拟合优度无显著影响。考虑到AE 为精简模型,故选择AE 模型为最终拟合模型。由此得到CD4+T 细胞亚群的遗传度为61.8%(95%CI:38.3% ~74. 8%),非共享环境效应为38. 2% (95% CI:20.4% ~52.8%)。在CD8+T 细胞遗传度模型拟合中,ACE 和AE 模型拟合成功,根据相关模型属性RMSEA、AIC和△χ2的判定,选择AE 模型为遗传度拟合的最佳模型,获得CD8+T 细胞亚群的遗传度为57.3%(95%CI:34.5% ~70.2%),非共享环境效应为42. 7% (95% CI:26. 2% ~61.9%)。
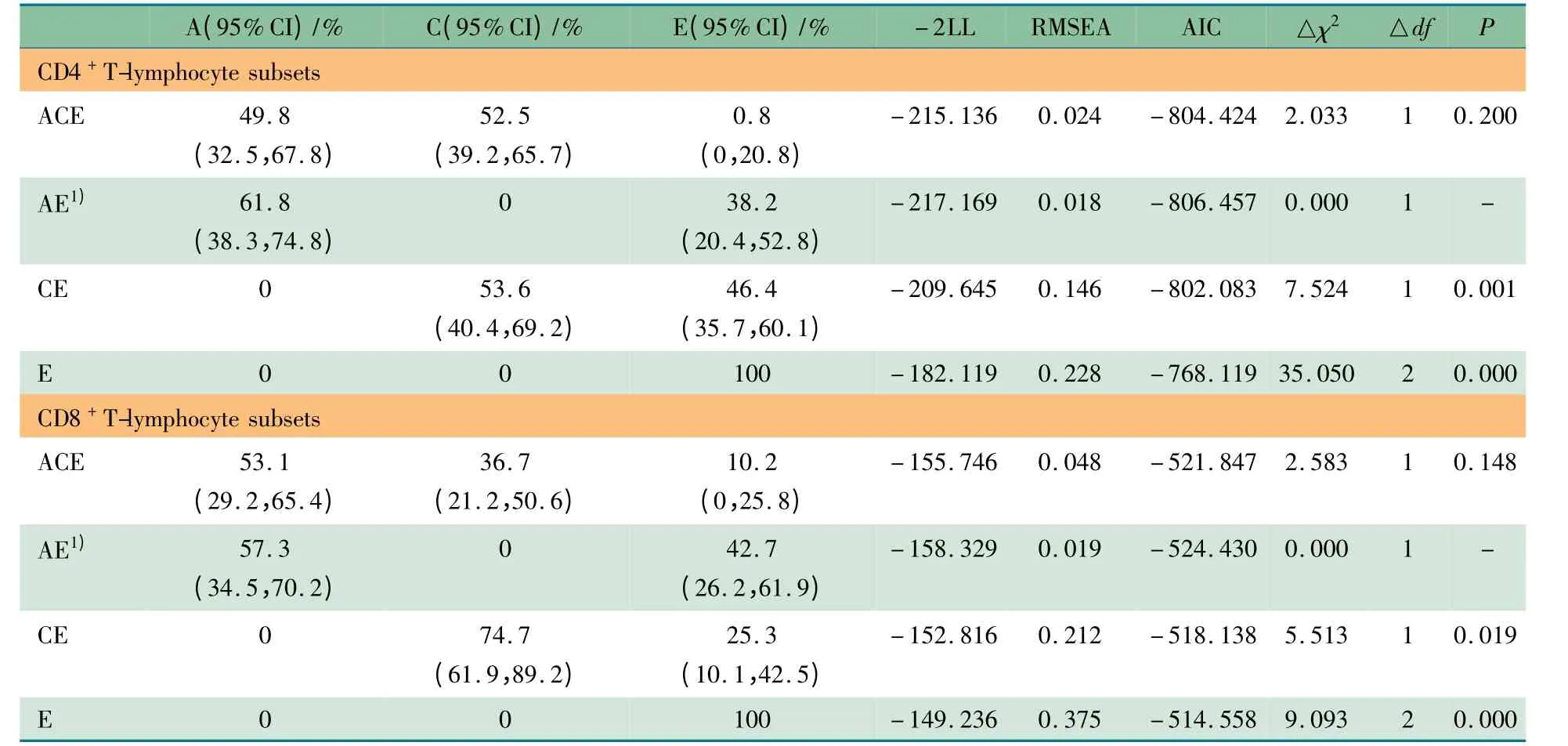
表3 CD4 +和CD8 + T 细胞亚群遗传度模型选择及计算Tab 3 Best-fitting univariate models choosing and heritability estimating for CD4 + and CD8 +T cell subsets
3 讨论
在有效的卵型鉴定基础上,本研究应用单因素结构方程模型[10],对双生子对间对内表型相似性及差异的比较,定量估计刚满1 周岁幼儿外周血CD4+、CD8+T 细胞的遗传和环境效应大小。已有多项研究表明,CD4+和CD8+T细胞数值未见显著性别差异[3,11,12],故本研究在计算遗传度的过程中未将性别与年龄作为隐变量进行处理,单纯选择了单因素连续变量且仅包含双生子样本的结构方差模型进行分析。在选择ADE 与ACE 模型之前,通过组内相关系数的分析,根据模型选择原则[10],发现CD4+和CD8+T细胞亚群的组内相关系数rDZ均>1/2rMZ,未提示针对变量存在显性遗传作用(rDZ≤1/2rMZ),因此最终选定ACE 模型实施拟合并将最后得到的嵌套模型(子模型)与全模型进行逐一比较,之后根据模型选择原则确定AE 为最佳的模型。
本研究结果显示,CD4+和CD8+T 细胞遗传度分别为61.8%和57.3%,两种细胞的遗传度均稍高于Hall 等[5,6]的研究结果(CD4+T 细胞遗传度56%,95% CI:41% ~68%;CD8+T 细胞遗传度57%,95%CI:43% ~67%)。可能与以下因素有关:①本研究选择1 周岁健康幼儿双生子作为研究对象,获得的是同一年龄的研究对象表型,较年龄表型不一的人群更出色;②1 岁幼儿处于人体生长发育早期,其周围所暴露的环境因素数量有限,且作用时间较短,环境因素影响表型的作用相对较小,与成年人群相比,该表型能更真实的体现遗传效应大小。
模型拟合中依据最佳模型判定标准,在允许剔除共享环境因素之后,非共享环境效应分别占38.2%与42.7%。与遗传度相反的是,幼儿影响CD4+和CD8+T 细胞数值的非共享环境效应要小于成人。已有研究提示不同年龄的成人外周血CD4+和CD8+T 细胞数量存在显著差异,从新生儿期到成年过程中CD4+T 细胞的表达可能是一个正常生理性逐渐增加的过程[16]。有研究检测58 份胎儿脐血中CD4+和CD8+T 细胞数值低于成人水平[17]。提示年龄是影响CD4+和CD8+T 细胞表达的因素之一。本研究统一选取1 周岁幼儿作为研究对象,排除了年龄对CD4+和CD8+T 细胞亚群数值的影响,获得的1 周岁表型遗传度更加接近于真实值。
本研究观察到影响CD4+和CD8+T 细胞表达的不仅只有年龄因素。与相关环境因素的相关性分析显示,MZ组孕妇孕龄和CD8+T 细胞相对计数呈弱负相关;DZ 组孕龄与CD4+T 细胞相对计数呈弱正相关。本研究结果与国外一项有关影响早产儿CD4+和CD8+T 细胞表达的环境因素研究[18]结果相吻合,该研究显示早产儿CD8+、CD4+/CD8+T 细胞比值与孕龄、出生体重呈正相关,孕龄<32 周组中的CD8+T 细胞数量较孕龄≥32 周组减少,提示孕龄未达足月可能会引起免疫功能下降;该研究还提示体重增长较低的早产儿CD4+T 细胞数量较低。本研究显示,1 岁体重增加与CD4+T 细胞相对计数存在弱正相关,与文献[18]研究结果相符。晚近研究显示,出生时存在窒息缺氧史的儿童体内可出现T 细胞亚群紊乱,导致CD4+T 细胞减少[19]。本研究观察到Apgar 评分与CD4+T 细胞相对计数呈弱正相关,验证了上述文献的结论,但其具体影响机制仍尚待研究。
本研究结果中有意义的提示有3 点,①根据模型信息反馈,遗传因素作用要比环境因素对幼儿外周血CD4+和CD8+T 细胞亚群相对计数的影响更大;②再次证实了遗传因素和环境因素共同影响幼儿外周血CD4+和CD8+T 细胞亚群相对计数;③幼儿CD4+和CD8+T 细胞遗传度要高于成年人群。本研究的局限性:①机体免疫功能水平可通过较多指标进行反映,研究只选取了CD4+和CD8+T 细胞相对计数作为表型,未涉及检测其他具有重要临床意义的免疫功能水平指标;②研究中未对淋巴细胞绝对计数进行检测,无法确定其他潜在因素对CD4+和CD8+T 细胞的影响,如幼儿体内潜在的细菌或病毒感染;③对于探索导致幼儿体内淋巴细胞亚群变化的遗传-环境因素的研究,以外周血中CD4+和CD8+T 细胞相对还是绝对计数水平作为指标还有待明确;④本研究仅分析了孕妇围生期及幼儿生命早期生长发育的相关环境因素,在后续研究中可建议对其他因素进行整合作进一步系统性研究来深化研究结论。
致谢 感谢新疆医科大学第一附属医院、乌鲁木齐市妇幼保健医院、新疆维吾尔自治区人民医院、中国人民解放军乌鲁木齐总医院和乌鲁木齐市第一人民医院儿童保健科对本研究历时2 年的现场工作给予的大力支持,以及新疆医科大学第一附属医院检验中心向本研究提供的实验技术平台;感谢余莉华医生、张雪实验师等人在本项目实验室指标检测环节给予的积极配合;对在《新生儿乙肝疫苗接种后弱无应答的双生子研究》课题进行过程中付出过辛勤劳动的全体研究人员致以敬意。
[1]Rehermann B,Nascimbeni M. Immunology of hepatitis B virus and hepatitis C virus infection. Nat Rev Immunol,2005,5(3):215-229
[2]Bunders M,Thorne C,Newell ML,et al. Maternal and infant factors and lymphocyte,CD4 and CD8 cell counts in uninfected children of HIV-1-infected mothers. AIDS,2005,19(10):1071-1079
[3]Uppal SS,Verma S,Dhot PS. Normal values of CD4 and CD8 lymphocyte subsets in healthy Indian adults and the effects of sex,age,ethnicity,and smoking. Cytometry B Clin Cytom,2003,52(1):32-36
[4]Clementi M,Forabosco P,Amadori A,et al. CD4 and CD8 T lymphocyte inheritance. Evidence for major autosomal recessive genes. Hum Genet,1999,105(4):337-342
[5]Hall MA,Ahmadi KR,Norman P,et al. Genetic influence on peripheral blood T lymphocyte levels. Genes Immun,2000,1(7):423-427
[6]Hall MA,Norman PJ,Thiel B,et al. Quantitative-trait loci on chromosomes 1,2,3,4,8,9,11,12,and 18 control variation in levels of T and B lymphocyte subpopulations. Am J Hum Genet,2002,70(5):1172-1182
[7]Clapperton M,Diack AB,Matika O,et al. Traits associated with innate and adaptive immunity in pigs:heritability and associations with performance under different health status conditions. Genet Sel Evol,2009,41(1):54
[8]Li H(李辉),Yan GF,Zhang X. A survey on the physical growth of children under 7 years in the urban and suburban rural areas of nine cities of China in 1995. National Medical Journal of China(中华医学杂志),1998,78(3):187-191
[9]Yang MJ,Tzeng CH,Tseng JY,et al. Determination of twin zygosity using a commercially available STR analysis of 15 unlinked loci and the gender-determining marker amelogenin-a preliminary report. Hum Reprod,2006,21(8):2175-2179
[10]Neale M,et al. Mx:Statistical Modeling . Richmond,VA:Department of Psychiatry. Virginia Institute for Psychiatric and Behavior Genetics,Virginia Commonwealth University,2003
[11]Seder RA,Ahmed R. Similarities and differences in CD4 + and CD8 + effector and memory T cell generation. Nat Immunol,2003,4(9):835-842
[12]Tsokos GC. Systemic lupus erythematosus. New Engl Med J,2011,365(22):2110-2121
[13]Ferreira MA,Mangino M,Brumme CJ,et al. Quantitative trait loci for CD4:CD8 lymphocyte ratio are associated with risk of type 1 diabetes and HIV-1 immune control. Am J Hum Genet,2010,86(1):88-92
[14]Marçais A,Jeannet R,Hernandez L,et al. Genetic inactivation of Ikaros is a rare event in human T-ALL. Leuk Res,2010,34(4):426-429
[15]Alkhatib A,Werner M,Hug E,et al. FoxO1 induces Ikaros splicing to promote immunoglobulin gene recombination. J Exp Med,2012,209(2):395-406
[16]Vithayasai V,Sirisanthana T,Sakonwasun C,et al. Flow cytometric analysis of T-lymphocytes subsets in adult Thais.Asian Pac J Allergy Immunol,2011,15(3):141-146
[17]Kagina BM,Abel B,Scriba TJ,et al. Specific T cell frequency and cytokine expression profile do not correlate with protection against tuberculosis after bacillus Calmette-Guerin vaccination of newborns. Am J Respir Crit Care Med,2010,182(8):1073-1079
[18]Routes JM,Grossman WJ,Verbsky J,et al. Statewide newborn screening for severe T-cell lymphopenia. JAMA,2009,302(22):2465-2470
[19]Hotoura E,Giapros V,Kostoula A,et al. Tracking changes of lymphocyte subsets and pre-inflammatory mediators in full-term neonates with suspected or documented infection. Scand J Immunol,2011,73(3):250-255

