肾小球系膜区IgM沉积在儿童原发性肾小球疾病中的意义
朱碧溱 丁 洁
肾小球系膜区IgM沉积由Vande Putte等[1]于1974年首次描述。1978年 Bhasin等[2]和 Cohen等[3]分别报道了有关系膜区以IgM沉积为主的系膜增殖性肾小球肾炎,并根据这种特殊的免疫病理改变将其正式命名为系膜IgM肾病。此后有关系膜区IgM沉积意义的报道陆续出现。但至今仍然是一个饱受争议的话题。有一部分学者认为系膜区IgM沉积仅是一种免疫病理现象,不具有单独的病理意义和致病性。Vilches等[4]研究64例微小病变型肾病患者,并根据系膜区有无IgM沉积将研究对象分为两组,随访4.5年发现两组的临床表现、对治疗的反应以及预后差异均无统计学意义。Yang等[5]研究100例原发性肾病综合征(NS)患者,认为系膜区IgM沉积与肾组织形态学改变无特定联系。也有学者认为系膜区IgM沉积有特殊意义,不仅影响NS对激素的反应,而且是病变程度较重的标志。既往研究多侧重于临床指标的观察或关注肾脏病理的改变,且有关儿童原发性肾小球疾病中肾小球系膜区IgM沉积的报道亦不多。本研究结合临床和病理回顾性分析伴肾小球系膜区IgM沉积的儿童原发性肾小球疾病的特点,并试图更系统和全面地评价肾小球系膜区IgM沉积在儿童原发性肾小球疾病中的意义。
1 方法
1.1 诊断标准 由于本研究为回顾性分析,在收集病例中需要明确界定与本文相关疾病的诊断标准。①原发性肾小球疾病诊断标准:包括肾小球肾炎、NS、孤立性血尿或蛋白尿,均参照2001年中华医学会儿科学分会肾脏病学组制定的诊断标准[6]。②血尿:尿中红细胞≥3·HP-1[7]。③高血压:3次或以上平均收缩压和(或)舒张压≥同性别、年龄和身高正常儿童血压的P95[8]。④肾功能不全:GFR <90mL·min-1·1.73 m-2[9]。⑤终末期肾病(ESRD):GFR<15mL·min-1·1.73 m-2,需要肾替代治疗(血液透析、腹膜透析或肾移植)的阶段[10]。
1.2 纳入和排除标准 同时满足以下条件者被纳入:①北京大学第一医院(我院)儿科住院并行肾穿刺活检的患儿;②临床及病理学诊断符合原发性肾小球疾病;③排除诊断为急性链球菌感染后肾小球肾炎、继发性肾脏疾病包括狼疮性肾炎、紫癜性肾炎、乙肝病毒相关性肾炎、Alport综合征等患儿。
1.3 资料提取 利用我院病案查询系统,回顾性总结全部纳入病例的临床资料,应用EpiData软件进行数据的录入和管理。①临床表现:有无水肿、肉眼血尿及高血压等。②实验室检查:尿液常规、24h尿蛋白定量、肾早期损伤指标(尿微量白蛋白、转铁蛋白、NAG酶及α1微球蛋白)、SCr、尿酸、BUN、肌酐清除率、血总蛋白、血白蛋白、血总胆固醇、血清免疫球蛋白(IgM、IgG、IgA)及血补体C3、C4水平等。③肾脏病理学资料:重阅纳入患儿肾脏病理诊断报告,采集光镜结果中有关系膜细胞及基质增生程度、肾小球硬化及球囊粘连、新月体形成、肾小管萎缩、间质病变以及小动脉病变描述的信息。采集免疫荧光报告中IgM和其他免疫球蛋白(IgG、IgA、C3、C1q、FRA)的沉积部位、形态、分布及免疫荧光强度等信息。采集电镜报告中电子致密物部位、分布、大小及数目等信息。④治疗:从病史中采集激素和其他免疫抑制剂应用情况及其疗效,降压药应用信息等。⑤随访:从病史中采集随访过程中蛋白尿、血尿缓解情况,SCr、BUN和肌酐清除率等实验室检查指标。
1.4 分组 为进一步分析伴肾小球系膜区IgM沉积可能存在的临床意义,根据免疫荧光下肾小球系膜区有无IgM沉积进行分组,将肾小球系膜区IgM沉积≥+且IgM免疫荧光强度≥其他免疫球蛋白荧光强度的患儿作为IgM沉积组,其余患儿为对照组。
1.5 激素疗效评价 参照2009年中华医学会儿科学分会肾脏病学组制定的儿童常见肾脏疾病诊治指南[11]:①激素敏感型NS:泼尼松足量治疗≤4周尿蛋白转阴者;②激素耐药型NS:泼尼松足量治疗>4周尿蛋白仍阳性者;③激素依赖型NS:对激素敏感,但连续两次减量或停药2周内复发者。
1.6 统计学分析 采用SPSS 19.0软件进行统计分析。正态分布计量资料以±s表示,采用单因素方差分析或t检验进行比较。偏态分布计量资料采用中位数±四分位间距(M±Q)描述,组间比较采用kruskal-wallis法或Mann-Whitney U检验比较,多组间变量的两两比较应用Bonferroni法。计数资料以百分比表示,采用 χ2检验或Fisher精确概率法比较。(P<0.05)为差异有统计学意义。

图1 研究对象纳入及排除流程图Fig 1The flow chart of including and excluding procedure
2 结果
2.1 一般情况2005年6月至2011年6月在我院儿科住院并行肾穿刺活检的患儿618例,125例临床及病理学诊断均符合原发性肾小球疾病患儿进入分析(图1)。IgM沉积组76例,对照组49例。
2.2 临床资料IgM沉积组76例以NS起病62例(81.6%),单纯血尿起病6例(7.9%),单纯蛋白尿起病4例(5.3%),蛋白尿合并血尿起病4例(5.3%)。对照组49例以NS起病30例(61.2%),蛋白尿合并血尿起病12例(24.5%),单纯蛋白尿起病4例 (8.2%),单纯血尿起病3例(6.1%)。对照组蛋白尿合并血尿起病比例显著高于IgM沉积组(P=0.002)。
如表1所示,IgM沉积组平均24h尿蛋白水平显著高于对照组(P=0.025),对照组血尿比例显著高于IgM沉积组(P=0.002)。IgM沉积组SCr、BUN和sIgM水平显著低于对照组(P分别为0.002、0.041和0.038),余临床表现和实验室指标两组差异均无统计学意义。
表1 IgM沉积组和对照组临床表现和实验室检查指标比较±s)Tab 1 Comparison of the clinical and laboratorydata in IgMdeposit group and control group± s)

表1 IgM沉积组和对照组临床表现和实验室检查指标比较±s)Tab 1 Comparison of the clinical and laboratorydata in IgMdeposit group and control group± s)
NotesSG:IgM deposit group;CG:control group;M:male;F:female;TP:total protein;Alb:albumin;T.chol:total cholesterol;sIgG:serum mmunoglobulin G;sIgA:serum immunoglobulin A;sIgM:serum immunoglobulin M;mALB:micro albumin;TRF:transferrin;NAG:N-acetyl-beta-D-glucosaminidase;α1M:α1-microglobulin;1)age was described as±s,other measurement data were described as M±Q
?
2.3 肾组织病理学改变125例原发性肾小球疾病患儿中局灶节段性肾小球硬化45例(36.0%),系膜增生性肾小球肾炎24例(19.2%)。IgM沉积组局灶节段性肾小球硬化比例显著高于对照组(48.7%vs 16.3%);对照组膜性肾病比例显著高于IgM沉积组(22.5%vs 1.3%),其他病理类型构成在两组间差异均无统计学意义(表2)。
两组病理指标比较见表3。IgM沉积组肾小球硬化、小动脉病变发生率显著高于对照组(P分别为0.002和0.039),基底膜增厚发生率显著低于对照组(P=0.000)。
IgM沉积组肾穿刺时病程中位数为5个月,光镜下73例有系膜细胞及基质增生,其中69例为轻度或轻-中度,2例为中-重度,2例未描述。66例免疫荧光下系膜区IgM沉积以颗粒状沉积为主,9例为团块状,1例未描述;IgM(+)17例(22.4%),(++)34例(44.7%),(+++)17例(22.4%),(++++)8例(10.5%)。IgM沉积同时伴IgG沉积9例(11.8%),伴IgA沉积18例(23.7%),伴C3沉积23例(30.3%),伴C1q沉积8例(10.5%),伴FRA沉积10例(13.2%)。电子致密物检出率63%(29/46例)。
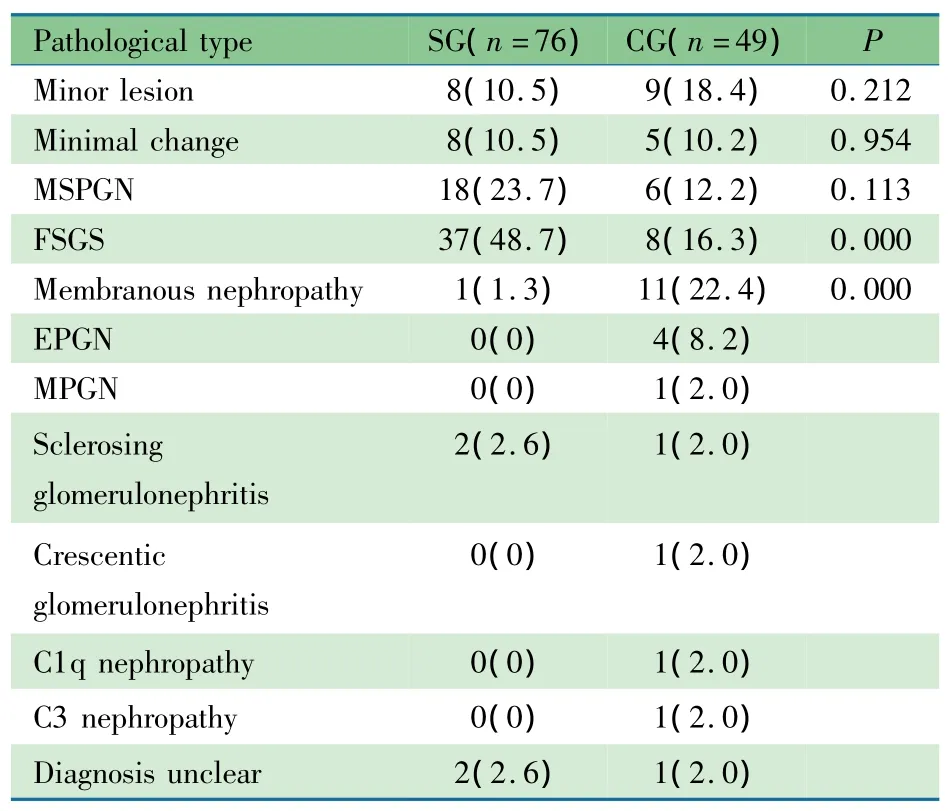
表2 IgM沉积组和对照组不同病理类型比较[n(%)]Tab 2 Comparison ofdifferent pathological types in IgMdeposition group and control group[n(%)]

表3 IgM沉积组和对照组不同病理指标比较[n(%)]Tab 3 Comparison of pathological parameters between IgMdeposition group and control group[n(%)]
2.4 激素治疗效果IgM沉积组66/76例(86.8%)达肾病水平蛋白尿并应用激素治疗,其中激素敏感4/66例(6.1%),激素依赖9/66例(13.6%),激素耐药53/66例(80.3%),与对照组差异无统计学意义(P=0.364)。IgM沉积组不同病理类型对激素治疗反应差异无统计学意义(P=0.094),微小病变和局灶节段性肾小球硬化患儿激素耐药发生率差异无统计学意义(表4)。
2.5 随访125例原发性肾小球疾病患儿中有随访资料者69例,随访时间2~78个月,中位时间12个月。随访过程中两组蛋白尿、血尿及肾功能指标差异均无统计学意义(表5)。IgM沉积组8例发生肾功能不全,包括4例局灶节段性肾小球硬化,2例系膜增生性肾小球肾炎,1例微小病变,1例硬化性肾炎;对照组2例发生肾功能不全,其中1例膜性肾病,1例系膜增生性肾小球肾炎。

表4 IgM沉积组和对照组激素治疗效果比较[n(%)]Tab 4 Comparison of response to steroid treatment between IgMdeposition group and control group[n(%)]

表5 IgM沉积组和对照组随访指标比较[n(%),M±Q]Tab 5 Comparison of follow-up between IgMdeposition group and control group[n(%),M ±Q]
2.6 重复肾活检IgM沉积组3/76例临床诊断NS的男性患儿因激素耐药或激素依赖行重复肾活检。3例2次肾活检免疫荧光均以IgM沉积为主。首次肾活检例1和2均诊断为系膜增生性肾小球肾炎,例3诊断为局灶节段性肾小球硬化。例1间隔5.5年、例2间隔1年行重复肾活检,2例均进展为局灶节段性肾小球硬化;例3间隔2年行重复肾活检,光镜下病理改变虽无进展,但随访过程中患儿肾病仍未缓解。3例重复肾活检时肌酐清除率较首次肾活检时进一步下降(表6)。

表6 3例患儿2次肾活检时实验室和病理学检查结果Tab 6 Clinical andhistological findings of 3 patients underwent repeated renal biopsy
3 讨论
本研究回顾性分析了125例原发性肾小球疾病患儿,并根据肾小球系膜区有无IgM沉积分为IgM沉积组和对照组,IgM沉积组76例,占60.8%。回顾国外文献报道,Sarah等[12]和Zeis等[13]的研究显示原发性 NS系膜区 IgM 沉积阳性检出率分别为34.1%和22.3%。易著文等[14]研究61例原发性NS患儿,其中伴肾小球系膜区IgM沉积42例(68.8%)。本研究IgM阳性检出率与国内文献报道相近,但高于国外文献报道,分析原因,一方面不除外与国内外人群种族差异有关,但仅根据目前几篇单中心研究尚不足以下定论;另一方面有可能与各医疗机构肾穿刺指征不尽相同有关,是否肾穿刺标准的差异可能会导致IgM阳性检出率产生偏倚?从本研究有限的病例数分析中尚难以得出结论。
本研究发现IgM沉积组24h尿蛋白定量水平显著高于对照组,提示伴肾小球系膜区IgM沉积患儿蛋白尿程度相对较重。Kishimoto等[15]报道180例系膜增生性肾小球肾炎,发现IgM沉积组蛋白尿水平,高血压、毛细血管襻粘连及重复的发生率显著高于无IgM沉积组,而在肾小球滤过率、血清白蛋白水平及CH50方面均显著低于无IgM沉积组,认为系膜增生性肾小球肾炎系膜区IgM沉积有助于判断肾小球损伤及肾功能不全程度。此外本研究显示IgM沉积组血IgM水平显著高于对照组,与Lin等[16]的报道类似,提示血IgM水平升高可能与肾小球系膜区IgM沉积存在某种关系。在抗原诱导的体液免疫中IgM是最先产生的抗体,在免疫应答早期即发挥作用,并在细胞因子的作用下转换为IgG。有学者认为IgM肾病发病可能与IgM向IgG转换障碍有关[17]。IgM肾病患者可能存在T细胞功能异常及系膜细胞免疫清除功能失调,进而影响IgM向IgG转换,导致血IgM升高,IgG降低,从而促进IgM或IgM复合物在肾小球系膜区沉积,进而引起局部炎症反应[18~20]。
本研究IgM沉积组和对照组在病理类型分布上有一定的差异。IgM沉积组局灶节段性肾小球硬化所占比例最高,其次为系膜增生性肾小球肾炎;对照组膜性肾病所占比例最高,其次为微小病变。提示系膜区伴IgM沉积者的病理改变可能更重。IgM沉积组肾小球硬化及小动脉病变发生率显著高于对照组,基底膜增厚发生率显著低于对照组,考虑可能与IgM沉积组局灶节段性肾小球硬化、对照组膜性肾病比例较高有关。在以后的研究中如将各种病理类型独立出来,再根据有无IgM沉积进行分组比较病理指标可能更有临床意义。
有文献[21~25]报道,微小病变患者激素敏感率可达93%~98%,而局灶节段性肾小球硬化激素敏感率仅有17%~30%。本研究中两组患儿激素耐药发生率均较高,进一步比较IgM沉积组各种病理类型对激素治疗的反应,显示微小病变与局灶节段性肾小球硬化病理类型对激素治疗反应差异无统计学意义,与上述文献报道不一致。而Sarah等[12]的研究提示伴系膜区IgM沉积的微小病变和局灶节段性肾小球硬化对激素治疗的反应无显著差异,提示IgM沉积可能是微小病变程度较重的标志物。
本研究平均随访16个月,两组患儿在蛋白尿及肾功能方面差异无统计学意义,可能与本研究随访时间较短有关。Sarah等[12]总结170例激素依赖或耐药的肾病患儿,55例系膜区有IgM沉积,随访1~204个月(平均30个月),其中微小病变组肾功能不全发生率为17%,ESRD发生率为13%,预后不同于既往经典的微小病变;局灶节段性肾小球硬化组肾功能不全发生率为46%,ESRD发生率为31%。
本研究有3例伴系膜区IgM沉积的患儿行重复肾活检,除1例首次肾活检已诊断局灶节段性肾小球硬化外,另外2例在第2次肾活检时均转化为局灶节段性肾小球硬化,提示可能系膜区IgM沉积是肾病患儿病理进展的一个标志。Zeis等[13]研究亦提示系膜区有IgM沉积的微小病变和系膜增生性肾小球肾炎患儿病理进展为局灶节段性肾小球硬化的概率更高。有报道在重复肾活检中IgM肾病转化为局灶节段性肾小球硬化的比例为33%~100%[26~28]。IgM肾病转化为局灶节段性肾小球硬化的机制目前尚不清楚。有学者推测可能是因为IgM沉积或其他因素引起的系膜激活以及增殖进而进展至局灶节段性肾小球硬化[13]。系膜区IgM沉积是否能预示肾脏病理进展仍有待更多的重复肾活检病例研究加以佐证。
本研究首次结合临床及病理评价了肾小球系膜区IgM沉积在中国儿童原发性肾小球疾病中的意义,发现伴肾小球系膜区IgM沉积者尿蛋白程度更重,肾脏病理改变亦更突出。对于伴系膜区IgM沉积的原发性肾小球疾病患儿应密切关注并加强随访,警惕其进展为局灶节段性肾小球硬化的可能。由于本研究纳入的病例尚有限、IgM沉积组和对照组中各种病理类型所占比例不均衡、尚缺乏长期随访等不足,对于肾小球系膜区IgM沉积的临床意义仍需大样本前瞻性研究充分阐明。
[1]Van de Putte LBA,DeLaRiviere GB,Van Breda Vriesman PJC,et al.Recurrent or persistent hematuria,sign of mesangial immune-complex deposition.N Engl J Med,1974,290(21):1165-1170
[2]Bhasin,HK,Abuelo JG,Nayak R,et al.Mesangial proliferative glomerulonephritis.Lab Invest,1978,39(1):21-29
[3]Cohen AH,Border WA,Glassock RJ.Nephrotic syndrome with glomerular mesangial IgM deposit.Lab Invest,1978,38(8):610-619
[4]Vilches AR,Turner DR,Cameron JS,et al.Significance of mesangial IgM deposition in 'minimalchange'nephrotic syndrome.Lab Invest,1982,46(1):10-15
[5]Ji-Yun Y,Melvin T,Sibley R,et al.No evidence for a specific role of IgM in mesangial proliferation of idiopathic nephrotic syndrome.Kidney Int,1984,25(1):100-106
[6]The Subspecialty Group of Nephrology,Society of Pediatrics,Chinese Medical Association(中华医学会儿科学分会肾脏病学组).Clinical classification,diagnosis and treatment of glomerular diseases in children.Chin J Pediatr(中华儿科杂志),2001,39(12):746-749
[7]Grossfeld GD,Wolf JS,Litwin MS,et al.Evaluation of asymptomatic microscopic hematuria in adults:the American Urological Association best practice policy recommendations.PartI:definition, detection, prevalence, and etiology.Urology,2001,57(4):599-603
[8]National High Blood Pressure Education Program Working Group on High Blood Pressure in Children and Adolescents.The fourth report on the diagnosis,evaluation,and treatment of high blood pressure in children and adolescents.Pediatrics,2004,114(2):555-576
[9]Schwartz GJ,Haycock GB,Edelmann CM Jr,et al.A simple estimate of glomerular filtration rate in children derived from body length and plasma creatinine.Pediatrics,1976 ,58(2):259-263
[10]National Kidney Foundation.K/DOQI clinical practice guidelines for chronic kidney disease:evaluation,classification,and stratification.Am J Kidney Dis,2002,39(2 S1):1-266
[11]]The Subspecialty Group of Nephrology,Society of Pediatrics,Chinese Medical Association( 中华医学会儿科学分会肾脏病学组) . Evidence-based guidelines on diagnosis and treatment of childhood common renal diseases ( Ⅰ ) Evidence-bused guideline on diagnosis and treatment of steroid-sensitive,relapsing /steroid-dependent nephrotic syndrome ( for trialimplementation) . Chin J Pediatr( 中华儿科杂志) ,2009,47( 3) : 167-170
[12]]Swartz SJ,Eldin KW,Hicks MJ,et al. Minimal change disease with IgM + immunofluorescence: a subtype of nephrotic syndrome. Pediatr Nephrol,2009,24( 6) : 1187-1192
[13]Zeis PM,Kavazarakis E,Nakopoulou L et al.Glomerulopathy with mesangial IgM deposits:Long-term follow up of 64 children.Pediatr Int,2001,43(3):287-292
[14]Zeng ZF(曾智凤),Yi ZW,Wu XC et al.Analysis on the relationship between IgM deposition and pathology features of refractory nephrotic syndrome in 61 children.J Clin Res(医学临床研究),2008,25(4):607-609
[15]]Kishimoto H,Arakawa M. Clinico-pathological characterization of mesangial proliferative glomerulonephritis with predominant deposition of IgM. Clin Exp Nephrol,1999,3( 2) : 110-115
[16]]Lin CY,Chu CM. Studies of circulating immune complexes and lymphocyte subpopulations in childhood IgM mesangial nephropathy. Nephron,1986, 44( 3) : 198-203
[17]Lin CY,Chen CH,Lee PP. In vitro B-lymphocyte switch disturbance disturbance from IgM into IgG in IgM mesangial nephropathy.Pediatr Nephrol,1989,3( 3) : 254-258
[18]Myllymäki J,Saha H,Mustonen J,et al.IgM nephropathy:clinical picture and long-term prognosis.Am J Kidney Dis,2003,41(2):343-350
[19]Lawler W,Williams G,Tarpey P,et al. IgM associated primary diffuse mesangial proliferative glomerulonephritis. J Clin Pathol,1980, 33( 11) : 1029-1038
[20]Cavallo T,Johnson MP. Immunopathologic study of minimal change glomerular disease with mesangial IgM deposits.Nephron,1981,27( 6) : 281-284
[21]Saha TC,Singh H.Minimal change disease:a review.South Med J,2006,99(11):1264-1270
[22]Eddy AA,Symons JM.Nephrotic syndrome in childhood.Lancet,2003,362(9384):629-639
[23]Tarshish P,Tobin JN,Bernstein J,et al.Prognostic significance of the early course of minimal change nephritic syndrome.J Am Soc Nephrol,1997,8(5):769-776
[24]International Study of Kidney Disease in Children.The primary nephrotic syndrome in children.Identification of patients with minimal change nephrotic syndrome from initial response to prednisone.J Pediatr,1981,98(4):561-564
[25]Gipson DS,Gibson K,Gipson PE,et al.Therapeutic approach to FSGS in children.Pediatr Nephrol,2007,22(1):28-36
[26]Little MA,Dorman A,Gill D,et al.Mesangioproliferative glomerulonephritis with IgM deposition:clinical characteristics and outcome.Ren Fail,2000,22(4):445-457
[27]O'Donoghue DJ,Lawler W,Hunt LP,et al. IgM-associated primary diffuse mesangial proliferative glomerulonephritis:natural history and prognostic indicators. Q J Med,1991,79( 288) : 333-350
[28]Saha H,Mustonen J,Pasternack A,et al.Clinical Follow-up of 54 patients with IgM Nephropathy.Am J Nephrol,1989,9(2):124-128

