胎儿心肌病诊断治疗现状
王 川 综述 周开宇 华益民 审校
心肌病(cardiomyopathies,CM)是一组临床表现、病因、发病机制和自然史各异的异质性疾病,整体预后不良,不同类型CM有其各自的临床过程和预后特点。为了能够更好地进行CM的分类治疗和管理,WHO和国际心脏病学会(ISFC)于1980年制定了CM分类标准[1]。随着诊疗手段的进步和对疾病认知的深入,WHO及ISFC于1995年修改更新了CM的定义和分类[2]。伴随心血管疾病分子生物学研究时代的来临,美国心脏病学会(ACC)和美国心脏病协会(AHA)于2006年发布了最新的CM定义和分类的专家共识[3],进一步推进了CM诊断治疗规范化。
胎儿医学,尤其是胎儿心脏病学的进步使胎儿期心血管疾病逐渐走入儿童心脏科、超声科和产科医生的视野。胎儿心肌病(FCM)是指在胎儿时期就出现临床表现的心肌本身的病变,与先天性、瓣膜性、冠状动脉性心脏病、心包等病变无关的一组异质性疾病,在胎儿期心血管疾病中所占比例较小,整体预后不良。该组疾病在胎儿期的发病情况、发病原因及临床分类和特点如何?其自然史和预后有何特点?相关诊断治疗现状如何?面临一个FCM病例,应当怎样提供恰当的临床咨询?基于CM分类标准及专家共识[1~3],结合胎儿时期疾病诊断治疗特点,本文就FCM上述相关问题进行文献综述。
1 FCM分类、流行病学和病因
1.1 FCM分类 由于产前诊断手段有限,故目前主要根据胎儿超声心动图特征将FCM分为胎儿扩张性心肌病(FDCM)、胎儿肥厚性心肌病(FHCM)、胎儿限制性心肌病(FRCM)、胎儿心肌致密化不全(FINVM)和胎儿心内膜弹力纤维增生症(FEFE)。
本文以“fetus and cardiomyopathy”为关键词检索PubMed(1950年至 2011年12月)、EMBASE(1974年至2011年12月)、Cochrane图书馆(2011年12月);以“胎儿和心肌病”为关键词检索中国生物医学文献数据库(1978年至2011年12月)、中国期刊全文数据库(1994年至2011年12月),检索出FCM诊断治疗的相关研究均列入表1。
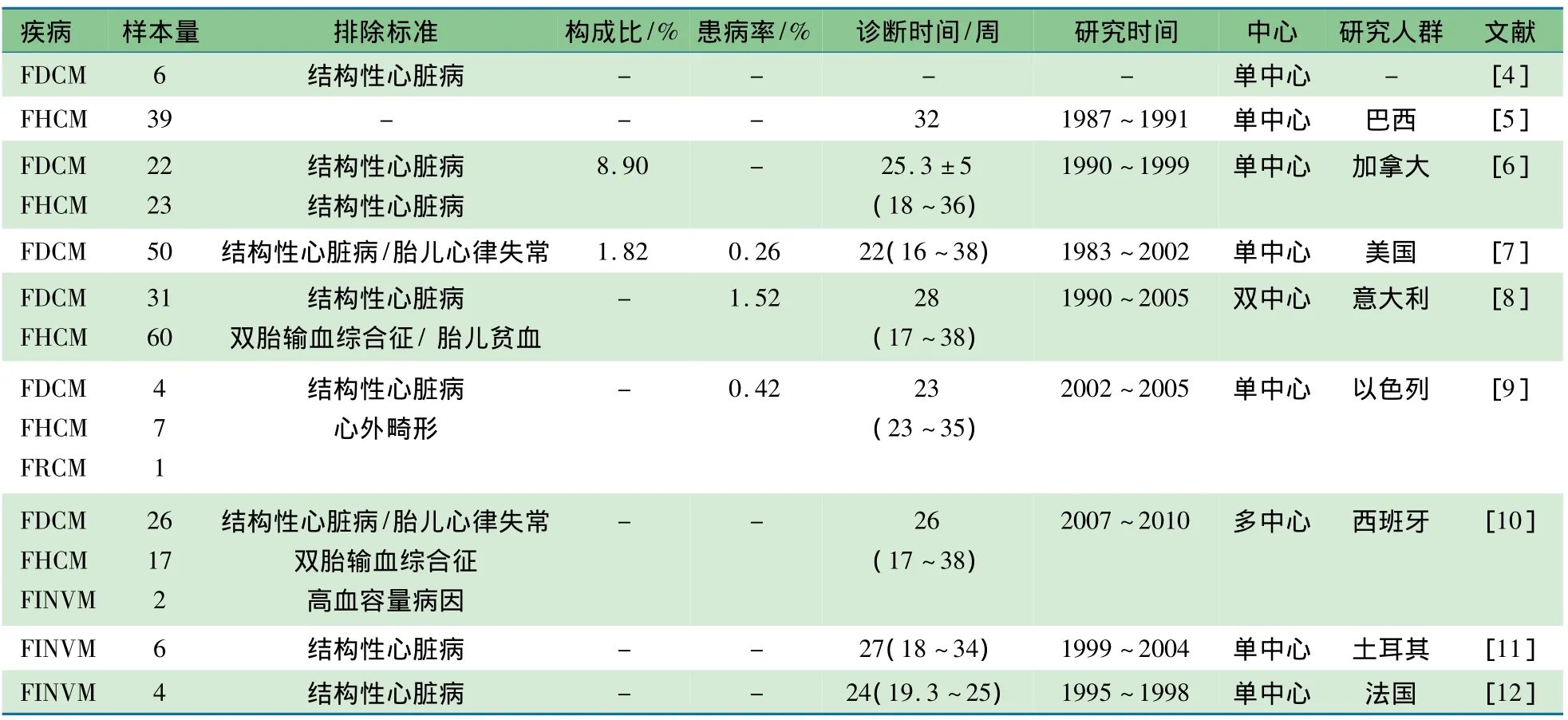
表1 近年来胎儿心肌病相关研究情况
1.2 FCM流行病学 因不同文献间的研究人群、样本量、纳入排除标准和研究时段等方面均存在较大差异,FCM在胎儿期心血管疾病中的构成比及其准确患病率很难确定。一系列研究表明[6,8,9,13~15],在有先天性心脏病(CHD)高危因素的人群中,FCM患病率为0.42% ~1.70%,占产前心血管疾病的构成比为6.70%~8.90%。FCM患胎在宫内的病死率约为20%,甚至更高[16,17]。表1中纳入的研究中,FCM病死率在胎儿期为23.11%,新生儿期为28.42%,与上述研究结果基本相符。
FDCM是一类由遗传及非遗传因素所致的复合型CM,在CHD高危人群中的患病率为0.25% ~0.52%[7~9]。在有CHD高危因素的人群中,FHCM患病率为0.14%~1.00%[8,9]。FRCM是以心内膜及心内膜下心肌纤维化、增生,附壁血栓形成,心腔缩小、甚至闭塞,心室充盈障碍和顺应性下降,心脏舒张功能严重受损而收缩功能保持正常或轻度受损为特征的原因不明的CM。相较FDCM及FHCM而言,FRCM患病率极低,目前无相关患病率的报道。FINVM是由于胚胎发育初期正常心内膜形成停止、疏松的心肌组织致密化过程障碍所致的罕见的CM,在CHD高危人群中的患病率为0.70%[11]。FEFE以心内膜弹力纤维和胶原纤维增生为特征性表现。Lurie等[18]认为FEFE并不是一种疾病,而是心内膜继发于各种因素的一种反应性增生。
1.3 FCM病因 总体而言,FCM病因及发病机制尚不确切,现有文献报道FCM的常见病因如下。
1.3.1 母体 ①糖尿病:孕母罹患各种类型糖尿病,尤其是妊娠早期胰岛素依赖型糖尿病与FHCM密切相关。Zielinsky等[5]报道39例 FHCM中,36例孕母患有不同类型糖尿病;②妊娠早期病毒(巨细胞病毒、细小病毒、风疹病毒、柯萨奇病毒、腺病毒、疱疹病毒)和弓形虫等感染可导致FDCM及FEFE的发生;③免疫性疾病:如孕母罹患系统性红斑狼疮,特别是母体血清抗SSA/SSB阳性,该抗体可通过胎盘进入胎儿体内引起心内膜的病变,可能导致FDCM及FEFE的发生,同时该抗体还可影响传导系统从而导致心脏传导阻滞[19]。
1.3.2 胎儿 ①胎儿染色体及基因异常:一些因染色体或基因异常导致的先天性综合征[6,8,9,11,20]或遗传代谢性疾病[7,11,21],如 Noonan 综合征(先天性侏儒痴呆综合征)及Pompe综合征(糖原累积症Ⅱ型)常合并FCM;②胎儿贫血:细小病毒感染导致的贫血和地中海贫血等可导致FDCM 和 FHCM 发生[6,7,9];③双胎输血综合征(TTTS):Pedra等[6]研究报道,37例TTTS中有18例受血胎儿被诊断为FHCM,这可能与受血胎儿体内血容量过多、胎盘向受血胎儿过多分泌生长因子及血管肽等有关。
1.3.3 家族性 Pedra等[22]研究表明,有心肌病家族史的胎儿群体中CM再发率为15.35%(4/26);而Fesslova等[23]研究认为,相较于FDCM,FHCM有着更明显的遗传倾向,FHCM及FDCM的再发率分别为11.11%(5/45)和0(0/25);其中一级和二级亲属患有肥厚性心肌病(HCM)时,FHCM再发率分别为11.80% ~20.00%和8.30%。
2 FCM诊断
FCM产前诊断手段有限,超声心动图能够对胎儿期心脏形态、结构、功能和节律等提供可靠全面的判断,因而是目前产前诊断FCM的主要工具。胎儿心磁图是一种通过记录由胎儿心脏电活动导致的磁场变化来监测胎儿心电活动的非侵入性技术,与胎儿MR不同的是,它并不发出磁场或能量。由于心磁图对PQRST波形记录准确,使得胎儿心磁图近年来在胎儿心脏节律诊断方面(特别是对于先天性房室传导阻滞、长QT间期综合征)有了较大的应用前景,可用于FCM并发心律失常的产前检查及诊断。此外,在取得家属同意的前提下,也可通过羊水穿刺、脐动脉穿刺等途径来获得胎儿标本从而对FCM做出更全面的诊断。对于孕期怀疑而未能明确病因者应在出生后及时诊断以便早期干预(如某些感染性、代谢性疾病)。如出现胎儿死亡或出生后死亡,在征得家属同意后尽量行尸检以明确病因。
研究表明FCM发病越早,其预后越差,故对于FCM的诊断应越早越好[20]。关于FCM早期诊断的孕龄报道不一,有报道认为在孕 16 周即可诊断[7]。有研究表明[6,8],FCM发病时间可早可晚,有的甚至在出生后才发病,所以初次胎儿超声心动图筛查正常并不能排除FCM可能性,特别是对有高危因素者应该进行早期、连续筛查,持续随访,早期诊断。
完整的FCM诊断应包括疾病类型、病因、结构、功能、心脏节律、并发症和合并疾病等多方面内容,这一综合诊断对于治疗方案选择及预后判断极其重要。
2.1 FCM疾病类型诊断FCM诊断时需排除先天性、瓣膜性、冠状动脉性心脏病、心包及全身病变。各类型FCM诊断标准如下:
2.1.1 FDCM ①胎儿超声心动图表现:单个或双心室扩张,舒张末期内径超过相应孕龄水平的97.50%;心室收缩功能受损[缩短率(FS)<28%];无心室壁或室间隔肥厚[6,8,9](图 1A ~ D);②右心室受累为主:Sivasankaran 等[7]研究显示FDCM单纯右室受累17例,单纯左室受累9例,双室受累24例,可能与胎儿时期右心室为优势心室有关;③发病存在男女差异:有研究[13]报道50例FDCM,男女患病率为2.4∶1;④病因以特发性及家族遗传性最为常见,继发性因素中以病毒感染及母体抗SSA/SSB阳性为主。
2.1.2 FHCM ①胎儿超声心动图表现:心肌壁或室间隔不协调肥大、增厚(图 1E,F),超过相应孕龄水平的97.50%;②有明显的家族遗传倾向,继发因素常见的有母体各型糖尿病、TTTS、胎儿贫血和心外畸形等。
2.1.3 FRCM 胎儿超声心动图表现:以心腔狭小为特征,可见心室舒张末期内径和容量缩小,心内膜回声增强,可有钙化点,严重者心尖闭塞;LVEF及FS明显降低,可探及附壁血栓;室间隔和左室后壁厚度对称性增加,运动幅度明显减小;心房扩大,房室瓣关闭不全,二尖瓣叶多呈多层反射或瓣尖气球样改变(图1G)。
2.1.4 FEFE ①胎儿超声心动图表现:左室扩大、心内膜增厚、收缩功能下降(图1H);②病因未明,可能与宫内病毒感染、某些CHD引起心室压力过高(如主动脉瓣狭窄)、母体自身免疫性疾病、心内膜局部缺血、黏多糖增多症等疾病相关。
2.1.5 FINVM 病因迄今不明,多呈家族性,近年基因学研究认为可能与Xq28染色体上的G4.5基因突变有关。当超声心动图发现心室内有明显突出的肌小梁和与左室腔交通且深陷的小梁间隙共存的特征性表现时,可提示FINVM 的可能(图 1I,J)。
2.2 FCM病因诊断 由于标本采集困难及伦理问题等原因,胎儿方面病因检查较难进行,母体病因可通过取得母体相关标本来证实,但往往也难以查明具体原因。因此,大多数FCM的病因往往只有在出生后才能进一步检查。
2.3 心脏结构及心外合并症诊断 一系列研究表明[6,8,9,11],各 种 病 因 导 致 的 FDCM 或 FINVM 均 可 合 并FEFE的发生,尤其是继发于母体自身免疫性疾病的FDCM则更为常见,而FEFE发生与否对于治疗选择及预后判断有重要影响。研究表明[6,8],合并神经系统、肾脏等心外畸形的FCM预后很差。所以在诊断FCM时对于其心脏结构及全身器官系统畸形的排查非常重要。
2.4 心脏功能诊断 ① 收缩功能不全:当室壁心肌纤维FS<28%时,考虑存在收缩功能不全。② 舒张功能不全:符合以下至少2个条件时可诊断为舒张功能不全:a.E/A值(舒张早期心室充盈速度最大值与舒张晚期心室充盈速度最大值之比)<相同孕龄水平均值的2个标准差;b.左室等容舒张时间(IVRT)>相同孕龄水平均值的2个标准差;c.下腔静脉或肝静脉反向血流速度>20 cm·s-1;d.脐静脉搏动。③心室整体功能评价:Tei指数评价心室整体功能的敏感度、特异度、整体性、简便和可重复性等方面均具有优势,且不受心室几何形态及心率的影响;当Tei指数>相应孕龄各心室数值的上限时,考虑存在心室功能不全。心血管整体评分(CVPS)是较为完善的胎儿心力衰竭半定量评价指标[23,24],由胎儿水肿、心脏功能、心胸面积比(C/T)、脐静脉和静脉导管血流频谱以及脐动脉血流频谱5个项目组成,每个项目2分,总分10分。CVPS分值下降提示胎儿心功能不全,CVPS≥7分,能取得良好的早期效果,一旦CVPS≤5分,则失去了早期干预的价值,甚至这种干预是有风险的[24,25]。

图1 FCM胎儿超声心动图所见
2.5 心脏节律诊断FDCM及FINVM常并发胎儿心律失常[6,8,9,11],其中以室上性心动过速(SVT)及房室传导阻滞(AVB)最为常见,室性心动过速(VT)较为少见,其余类型心律失常未见报道。并发胎儿心律失常的患胎预后往往较差。
3 FCM治疗现状及预后判断
目前可供选择的FCM治疗方案少、不成熟且疗效不肯定,下面在病因分析中将会提到这些有限的手段。除了孕母糖尿病相关FHCM以外,FCM整体预后较差,临床上可根据其初次发病孕龄、受累心室、疾病类型、病因、心脏节律、功能、并发症和合并症等方面的情况来进行综合判断。
3.1 初次发病孕龄 研究表明初次发病孕龄越早,其预后往往越差[20]。
3.2 受累心室Sivasankaran等[7]研究表明,FDCM在宫内以右室受累为主,但存活者中以右室受累为主者出生后预后往往较好,这可能与出生后优势心室的转变有关。
3.3 疾病类型 有研究表明[4,6~9],FHCM 整体预后好于FDCM,胎儿及新生儿期病死率分别为33.30% ~51.70%和60.00%~82.30%;由于FRCM胎儿时期患病率低且较难诊断,目前仅见1例报道,且终止妊娠,故对于预后无法判断;FINVM整体预后报道不一,有研究表明胎儿及新生儿期病死率为 50.00% ~75.00%[11,26],但 Menon 等[27]研究中的5例FINVM均存活。
3.4 病因
3.4.1 糖尿病 研究[6,8,10]表明继发于孕母妊娠前即患有糖尿病的FHCM预后相对较差(存活率为83.3%),而继发于母体妊娠期糖尿病的FHCM在严格控制母体血糖的情
况下存活率可达100%,且心脏结构功能大多能在出生后3~6个月恢复正常。
3.4.2 病毒和弓形虫感染 研究[7,8,10]分别报道了 12、11和3例继发于感染的FDCM,存活率分别为33.3%(4/12)、27.2%(3/11)和33.3%(1/3),其中包括巨细胞病毒7例、柯萨奇病毒10例、细小病毒7例、HIV 1例、弓形虫1例。在治疗选择上,目前仅有使用磺胺嘧啶或乙胺嘧啶来治疗弓形虫感染的报道[28],也有文献报道可尝试用IVIG、激素胎儿脐静脉穿刺直接给药的方式来治疗[6],虽其疗效并不确定,但对有明显孕期感染史且有明显心功能受损的病例可尝试使用。
3.4.3 母体自身免疫性疾病 Pises等[19]研究认为,母体抗SSA/SSB阳性可导致胎儿先天性心脏传导阻滞、窦性心动过缓、心肌炎、心肌病和 EFE,并可合并存在。研究[4,15]纳入的10例继发于母体自身免疫性疾病的FDCM均合并FEFE和(或)AVB,存活率为16.7% ~25%,由此可见此类FDCM整体预后较差。在治疗选择上,IVIG、甲泼尼龙(2 mg·kg-1)胎儿脐静脉穿刺直接给药、母体口服地塞米松(4 mg qd)、β受体激动剂(如特布他林2.5~7.5 mg,q 6 h)及出生后起搏器植入等可供选择[6,11,29]。
Hutter等[30]研究表明,因母体自身免疫性疾病导致FEFE或(和)AVB的患胎中,5% ~10%出生后在儿童时期易发展成为扩张性心肌病(DCM),但如果在孕早期发现,并给予了相应的干预措施,可避免胎儿期或出生后DCM的发生。该研究报道了70例继发于母体自身免疫性疾病的AVB/FEFE胎儿,其中46例为完全性房室传导阻滞(CAVB),24例为CAVB与FEFE并存;67例给予地塞米松,26例给予β受体激动剂,14例FEFE给予了IVIG,平均随访5.9年,治疗组无1例发展成为DCM,但42%于出生后安装了永久起搏器。由此可见对于母体血清抗Ro/La阳性者,孕期应进行FEFE或AVB筛查,发现后给予早期干预,避免胎儿期或出生后DCM发生。
3.4.4 胎儿贫血 在继发于贫血的FCM中,细小病毒感染引起者预后明显差于其他因素(如地中海贫血、母体抗C抗体阳性、胎儿母体输血和原因不明),但宫内输血可改善部分患胎预后[6,7,9]。
3.4.5 TTTS Pedra等[6]研究中,有 37例胎儿被诊断为TTTS,其中18例受血胎儿被确诊为 FHCM,存活率为33.3%(6/18),对6例存活者的随访中发现,5例患胎均于出生时心脏结构功能恢复正常,仅有1例于出生后有双室肥厚,但在3个月后也自行好转;Yinon[9]研究中有1例继发于TTTS的FDCM报道,患胎于28周早产,出生后2 d心脏功能恢复正常。由此可见,继发于TTTS的FCM预后较差,但在出生后病因解除后,心脏结构及功能可恢复正常。在治疗的选择上,可通过多次羊膜腔穿刺以减轻宫内压从而改善子宫胎盘循环或胎儿镜下选择性激光电凝治疗来改善部分患胎预后。
3.4.6 家族性心肌病 本文纳入的研究中,共报道了家族性 19 例 FDCM 和 7 例 FHCM[6~9,11],其存活率分别为5.26%(1/19,存活者于3岁时心脏结构功能恢复正常)、71.4%(5/7,其中1例终止妊娠,1例于出生后诊断为细胞色素氧化酶缺乏,于生后38 d死亡,其余存活随访至5~14岁),可见家族性FHCM预后明显好于家族性FDCM。
3.4.7 特发性 在一系列研究[6~9,11]分别报道了特发性FDCM 39例及FHCM 22例,其存活率分别为23.08%(9/39)和68.18%(15/22),由此可见特发性FHCM预后明显好于特发性FDCM。关于特发性FCM出生后转归情况,Weng等[31]的研究共纳入18例特发性DCM患儿,分为死亡组(13例)与存活组(5例),诊断年龄从胎儿时期至13岁不等(均数为3个月),随访12 d至48个月,总病死率为72.22%(13/18),有11例在等待心脏移植过程中死于重度心力衰竭,其中存活者1年生存率为50%,4年生存率为28%,而心律失常或左室射血分数(LVEF)降低是判断其预后的独立危险因素。
综上,FCM的诊断应尽量明确病因,这对于FCM治疗的选择以及预后的判断有着重要的意义,相对于原发性FCM、家族遗传性及特发性FCM,继发性FCM预后往往较好,且部分有可选择的治疗方案。
3.5 心脏结构F EFE继发于各种类型的FDCM及FINVM的报道屡见不鲜,但继发于FHCM未见报道;这与Paul等[18]研究中的描述相符,而是否合并FEFE可被视为判断FCM预后好坏的危险因素,这似乎在某种程度上可以解释FHCM较FDCM及FINVM有着更好的预后。
3.6 心脏功能 多项研究[4,6,7,10]表明房室瓣反流、心脏收缩功能不全、舒张功能不全和Tei指数均是判断FCM预后的独立危险因素,在合并上述任何一种情况时,FCM病死率可高达75%以上。Pedra等[6]的研究表明舒张功能不全相对于收缩功能不全与胎儿死亡有着更强的相关性(舒张功能不全:OR=8.481,95%CI:1.075~66.93,收缩功能不全:OR=1.207,95%CI:0.128 ~11.416),且在判断舒张功能不全的指标中,下腔静脉或肝静脉反向血流速度>20 cm·s-1及脐静脉搏动与胎儿死亡更相关;而Ferrer等[10]研究同样表明相较于其他指标,如合并房室瓣反流、Tei指数增大、下腔静脉/肝静脉血流谱异常、脐静脉搏动,FCM有着更高的病死率。
3.7 心脏节律 ①SVT或VT可见于各种原因导致的FDCM或FINVM,如合并上述心律失常时,患胎预后往往较差;②AVB则仅见于继发于母体自身免疫性疾病的FCM,且常合并FEFE的发生,Pises等[19]研究表明母体自身免疫性疾病引起的FEFE与CAVB有着明显的相关性,FEFE在胎儿AVB的病因中仅占5%,却占其死亡的33%,且在免疫介导的CAVB中占其死亡的83%,所以继发于FEFE的AVB预后往往极差。
治疗选择方面,Sivasankaran等[7]报道了1例并发SVT的FDCM,孕期使用氟卡尼转复,并在出生后使用多种抗心律失常药物后,于出生后18 d恢复窦性,但关于其转律后FDCM转归如何未见描述。而对于CAVB的治疗,Pedra等[6]的研究表明,当胎儿心率<55·min-1时,母体口服地塞米松(4 mg·d-1)及β受体激动剂后胎儿心脏功能可好转,至于孕期给予抗心律失常治疗对于其预后有无帮助、心脏结构能否逆转在各研究中均未见描述,但鉴于心律失常对于血液动力学的影响,尝试性使用可以缓解部分患胎的症状。
3.8 合并症 研究表明[6~9],如合并心外畸形,胎儿预后极差,病死率可高达100%。Fesslova等[8]的研究中共纳入FHCM 60例,根据病因分为继发于糖尿病组、合并心外畸形组和特发性组,其病死率分别为11.8%、72.7%和12.5%。治疗选择方面,对合并心内或心外畸形者,出生后可行手术矫正,但术后存活率低,且FHCM发病越早,病死率越高[20]。而对于一些遗传代谢性疾病[21,32](如肉毒碱缺乏症、Pompe综合征),胎儿时期或出生后连续给予替代治疗,可改善其预后,其中存活者在出生后心脏结构功能可恢复正常。
3.9 并发胎儿水肿 胎儿水肿是判断胎儿预后的一个重要指标[4,6~8,10],FCM 合并胎儿水肿时,患胎病死率可高达100%,Pedra等[6]研究显示胎儿水肿是FCM死亡的危险因素(OR=1.322,95%CI:0.067~26.296)。在并发胎儿水肿时,CVPS动态监测可为不同患胎的转归提供较多的信息,Hofstaetter等[25]研究纳入102例水肿胎儿,死亡组与存活组CVPS差异有统计学意义,且在连续监测CVPS后发现,死亡组CVPS随着孕龄的增加而逐渐降低,而存活组则逐渐增高。治疗选择方面,可尝试性使用胎儿胸腔穿刺、心包穿刺、腹腔穿刺或母体口服地高辛,但疗效甚微[8]。Boldt等[33]研究纳入 FDCM及FHCM各7例,在给予上述治疗后,结果表明治疗组与非治疗组预后无明显差异。
本文研究的文献中,关于FCM各研究的样本纳入标准不同,部分研究将继发于心脏畸形的病例也纳入分析,并且由于FCM诊断标准的准确度等原因,使FCM的诊断一定程度上受到了主观因素的影响,可能导致关于FCM的病死率及在先天性心血管疾病中的构成比在不同文献报道中差异较大。此外,国内关于FCM的相关报道较少,可能与FCM患病率较低、对诊断标准把握不足及医师的认识水平有限等有关。FCM治疗手段有限,产前明确诊断的大部分病例预后不良,因此进一步研究FCM病因,切实有效地做好相关三级预防工作显得尤为重要。
[1]Report of the WHO/ISFC task force on the definition and classification of cardiomyopathies.Br Heart J,1980,44(6):672-673
[2]Richardson P,McKenna W,Bristow M,et al.Report of the 1995 world health organization/international society and federation ofcardiology task force on the definition and classification of cardiomyopathies.Circulation,1996,93(5):841-842
[3]Maron BJ, TowbinJA, Thiene G, et al.Contemporary definitions and classification of the cardiomyopathies.Circulation,2006,113(14):1807-1816
[4]Schmidt KG,Birk E,Silverman NH,et al.Echocardiographic evaluation of dilated cardiomyopathy in the human fetus.Am J Cardiol,1989,63(9):599-605
[5]Zielinsky P.Role of prenatal echocardiography in the study of hypertrophic cardiomyopathy in the fetus.Echocardiography,1991,8(6):661-668
[6]Pedra SR, Smallhorn JF, Ryan G, et al.Fetal cardio myopathies:pathogenic mechanisms,hemodynamic findings,and clinical outcome.Circulation,2002,106(5):585-591
[7]Sivasankaran S,Sharland GK,Simpson JM.Dilated cardiomyopathy presenting during fetal life.Cardiol Young,2005,15(4):409-416
[8]Fesslova V,Mongiovi M,Pipitone S,et al.Features and outcome of fetuses with myocardial disease:two centre study.J Cardiovasc Med,2010,7(S1):39
[9]Yinon Y,Yagel S,Hegesh J,et al.Fetal cardiomyopathy--in utero evaluation and clinical significance.Prenat Diagn,2007,27(1):23-28
[10]Ferrer Q,Arevalo S,Rueda F,et al.Fetal Cardiomyopathy multicentre study:A ethiology and clinical outcome.Cardiol Young,2011,21(S):79-80
[11]Ozkutlu S,Bostan O,Karagoz T,et al.Prenatal diagnosis of isolated non-compaction of the ventricular myocardium:study of six cases.Pediatr Int,2007 ,49(2):172-176
[12]Moura C,Hillion Y,Daikha-Dahmane F,et al.Isolated noncompaction of the myocardium diagnosed in the fetus:two sporadic and two familial cases.Cardiol Young,2002,12(3):278-283
[13]Fesslova V,Bellotti M,Pirozzi I.Myocardial disease in utero:features and outcome in 24 cases.J Mat and Fet Invest,1993,3:249-254
[14]Fesslova V,Nava S,Villa L.Evolution and long term outcome in cases with fetal diagnosis of congenital heart disease:Italian multicentre study.Heart,1999,82(5):594-599
[15]Fesslová V,Villa L,Kustermann A.Long-term experience with the prenatal diagnosis of cardiac anomalies in high-risk pregnancies in a tertiary center.Ital Heart J,2003,4(12):855-864
[16]Rowe RD,Freedom RM,Mehrizi A,et al.The neonate with congenital heart disease in Card iomyopathies.Saunders WB&Co.,Philapdelphia,Pa,USA,2nd edition.1081
[17]Maron BJ,Robert WC.Cardiomyopathies in the first two decades of life in Pediatric Cardiovascular Disease.M.A.Engle,Ed Davis FA,Philadelphia,Pa,USA,1981.35
[18]Lurie PR. Changing concepts of endocardial fibroelastosis.Cardiol Young,2010,20( 2) : 115-123
[19]Pises N,Acherman RJ,Iriye BK,et al. Positive maternal anti-SSA/SSB antibody-related fetal right ventricular end ocardial fibroelastosis without atrioventricular block, reversal ofendocardial fibroelastosis. Prenat Diagn,2009,29( 2) : 177-178
[20]Bonnet D,Lyonnet S,Vouhe P.Characteristics and outcome of hypertrophic cardiomyopathy in Noonan,Costello,and cardiofacio-cutaneous syndromes European.Heart J,2011,32:588
[21]Hamdan MA,El-Zoabi BA,Begam MA,et al.Antenatal diagnosis of pompe disease by fetal echocard iography:impact on outcome after early initiation of enzyme replacement therapy.J Inherit Metab Dis,2010,1:1-7
[22]Pedra SR,Hornberger LK,Leal SM,et al.Cardiac function assessment in patients with family history of nonhypertrophic cardiomyopathy:a prenatal and postnatal study.Pediatr Cardiol,2005,26(5):543-552
[23]Fesslova V,Brankovic J,Piazza L,et al.Recurrence rate of cardiac disease in cases with family history of cardiomyopahty referred echocardiography.Cardiol Young,2010,20(S):54
[24]Hua YM,Zhou KY.Evaluation and treatment of fetal heart failure.J Clin Pediatr,2011,29(7):609-612
[25]Hofstaetter C,Hansmann M,Eik-Nes SH,et al.A cardiovascular profile score in the surveillance of fetal hydrops.J Matern Fetal Neonatal Med,2006,19(7):407-413
[26]Moura C,Hillion Y,Daikha-Dahmane F,et al.Isolated noncompaction of the myocardium diagnosed in the fetus:two sporadic and two familial cases.Cardiol Young,2002,12(3):278-283
[27]Menon SC,O'Leary PW,Wright GB,et al. Fetal and neonatal presentation of noncompacted ventricular myocardium: expanding the clinical spectrum. J Am Soc Echocardiogr,2007,20( 12) : 1344-1350
[28]Bennet P,Nicolini U.Fetal infections.In:Fisk NM,Moise KJ,Eds.Fetal therapy:invasive and transplacental.Cambridge,Mass:Cambridge University Press,1997.92-116
[29]Raboisson MJ,Fouron JC,Sonesson SE,et al. Fetal Doppler echocar diographic diagnosis and successful steroid therapy of Luciani-Wenckebach phenomenon and end ocar dial fibroelastosis related to maternal anti-Ro and anti-La antibodies. J Am Soc Echocar diogr,2005, 18( 4) : 375-380
[30]Hutter DM,Hornberger L,Cuneo B,et al. Does prenatal antiinflammatory treatment prevent from late-onset dilated cardiomyopathy ( DCM) in children with immune-mediatedcongenital complete AV block ( CAVB ) ? results of a retrospective multicenter experience. Cardiol Young,2010,20( S) : 54-55
[31]Weng KP,Lin CC,Huang SH,et al.Idiopathic dilated cardiomyopathy in children:a single medicalcenter's experience.J Chin Med Assoc,2005,68(8):368-372
[32]Steenhout P,Elmer C,Clercx A,et al. Carnitine deficiency with cardiomyopathy presenting as neonatal hydrops: successful response to carnitine therapy. J Inherit Metab Dis,1990,13( 1) : 69-75
[33]Boldt T,Andersson S,Eronen M.Etiology and outcome of fetuses with functional heart disease.Acta Obstet Gynecol Scand,2004,83(6):531-535

