树脂纳米零价铁催化过硫酸钠降解甲基橙的研究
崔广华,程 俊,秦 黎
(1.河北联合大学 化学工程学院,河北 唐山 063009;2.中国环境管理干部学院,河北 秦皇岛 066004)
树脂纳米零价铁催化过硫酸钠降解甲基橙的研究
崔广华1,程 俊2,秦 黎1
(1.河北联合大学 化学工程学院,河北 唐山 063009;2.中国环境管理干部学院,河北 秦皇岛 066004)
采用树脂负载零价纳米铁(NZVI-resin)作为铁源,活化过硫酸钠,产生硫酸根自由基氧化降解偶氮染料甲基橙。考察了温度、NZVI-resin加入量、pH值及过硫酸钠的浓度等因素对甲基橙降解率的影响,并对其降解动力学规律作了初步探讨。结果表明:降解反应遵循准一级反应动力学,在pH=3.0、Fe0=0.2 g·L-1、Na2S2O8=1.33 g·L-1的条件下,30mg·L-1的甲基橙溶液降解率为99.7%。
离子交换;零价纳米铁;硫酸根自由基;甲基橙;降解
染料废水的成分复杂,具有高浓度、高色度,水质变化大的特点,累积在环境中的染料污染物,如偶氮染料在微生物的作用下能够产生芳香胺类中间产物,具有强烈的“三致” (致癌、致畸、致突变)效应和潜在的环境风险,对生态环境造成显著的负面影响[1]。最近,以硫酸根自由基SO4·-为主的新型高级氧化技术开展起来,硫酸根自由基具有与羟基自由基相当的氧化还原电位(反应式如下),硫酸根自由基在中性的条件下也有较高的氧化,并且针对某些污染物具有专一性[2]。

纳米材料修复技术是环境污染修复领域颇具潜力的新方法,其中纳米零价铁由于能够快速有效地转化多种环境污染物而成为研究和应用的重点。其粒径小,具有较大的表面积及表面能,因而具有优良的表面吸附和较高的化学反应活性,可以被直接注入污染场所,在地下水修复中具有独特的优势[3,4]。
本研究利用环境友好的树脂纳米零价铁活化过硫酸盐产生硫酸根自由基,氧化降解偶氮类化合物甲基橙。这些内容的研究对于进一步理解树脂纳米零价铁/过硫酸盐体系的作用机制,以及为处理难降解有机废水提供了可行的新方法和技术。
1 实验
1.1 试剂和仪器
AMBERLITE IR120 Na型强酸性阳离子交换树脂(罗门哈斯公司,美国)、浓盐酸(36%)、FeSO4·7H2O、KBH4、甲基橙、浓硫酸 (98%)、过硫酸钠、FeCl3(无水)均为分析纯试剂。
BS224S电子分析天平(北京赛多利斯仪器系统有限公司)、DF-101S集热式恒温磁力搅拌器(郑州长城科工贸有限公司)、TU-1901紫外-可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 离子交换树脂负载纳米铁的制备
利用液相还原法制备[5,6]:取50 g阳离子交换树脂,分别用10%食盐水和4mol·L-1的盐酸进行处理,将树脂表面的钠离子交换为H+,再用足够的去离子水将盐酸清洗干净。然后将FeSO4·7H2O和处理过的树脂按质量比3∶5加到水溶液中,磁力搅拌下交换一天,保证所有的Fe2+交换到阳离子树脂表面。
将交换有Fe2+的阳离子树脂置于冰水浴中的500 ml烧杯中,然后在搅拌下缓慢滴加0.2 mol·L-1KBH4溶液,树脂迅速由浅黄色变为深灰色,反应过程中有大量H2生成,反应式如下:
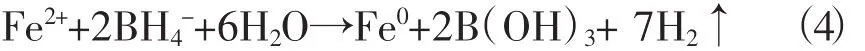
反应完成后,再次清洗深灰色的树脂,以去除表面剩余的KBH4。最后用无水乙醇清洗,将所制得的树脂在N2氛围中保存。
通过分光光度计测得铁的固载量为210mg Fe/g树脂。
1.3 甲基橙的降解实验
取一定量的甲基橙,用蒸馏水配制成浓度为30mg·L-1来模拟甲基橙废水。取75 ml甲基橙溶液置于圆底烧瓶中,用0.10 mol·L-1NaOH/H2SO4调节溶液的pH,然后将烧瓶置于有温控探头的集热式恒温磁力搅拌器中,在烧瓶中加入一定量的NZVI-resin,搅拌10min后加入Na2S2O8。每隔一定时间迅速取样于比色皿中,用TU-1901紫外-可见分光光度计在λmax=466 nm处测定甲基橙的吸光度,用于计算甲基橙的降解率[7,8]。
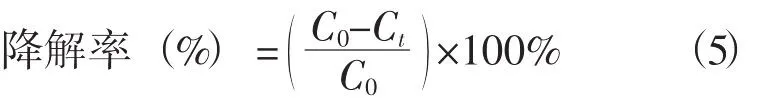
式中C0——甲基橙的初始浓度(mg·L-1);Ct——反应一定时间甲基橙的浓度(mg·L-1)。
2 实验结果与讨论
2.1 NZVI-resin的加入量对甲基橙降解率的影响
Fe2+可以催化过硫酸盐产生硫酸根自由基,所以能够提高污染物的降解率。在甲基橙初始浓度为30mg·L-1、过硫酸钠浓度为0.8 g·L-1条件下,考察了零价铁加入量在0~0.4 g·L-1(由树脂负载纳米零价铁折算成Fe0的含量)范围内变化时对甲基橙降解率的影响,如图1所示。
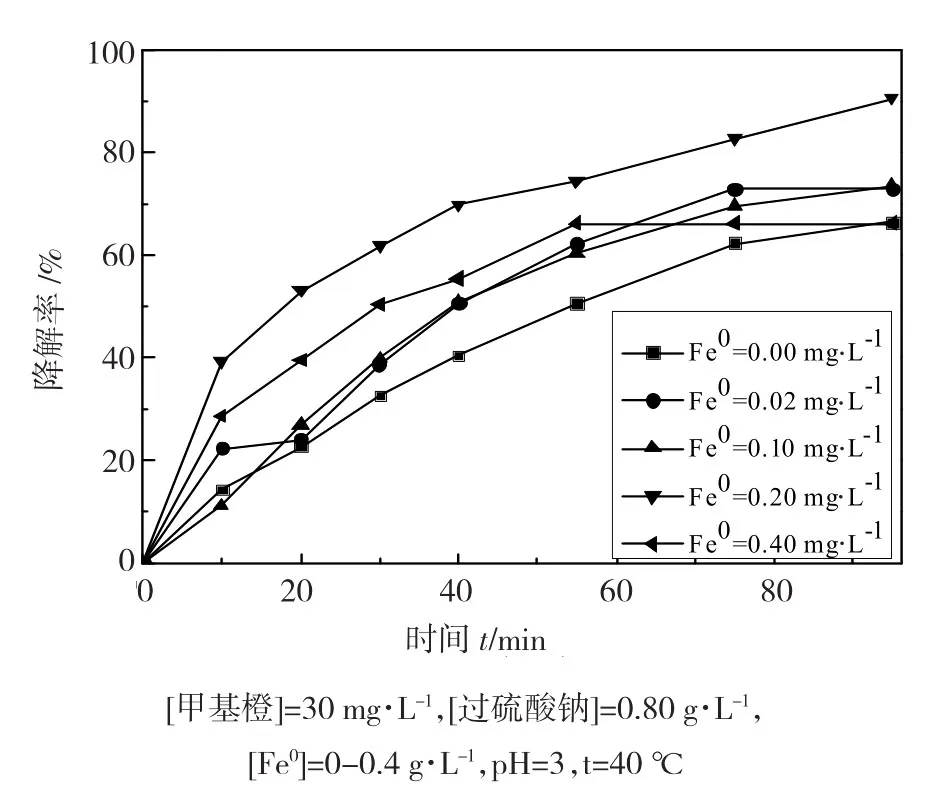
图1 树脂负载纳米铁的加入量对过硫酸钠氧化降解甲基橙的影响
从图1中可知,当零价铁加入量在0~0.2 g·L-1范围时,随着零价铁加入量的增加,甲基橙的降解率逐渐增加,这是由于溶液中树脂纳米铁量的增加增大了其总的比表面积以及新鲜表面和污染物接触的机会,且产生了更多的SO4·-,因此加快了反应的进行[9];当零价铁加入量为0.2 g·L-1(树脂纳米零价铁为0.071 4 g)时,甲基橙的降解率最大为90.60%。但是随着零价铁加入量的进一步增加,甲基橙的降解效率反而有降低的趋势。这表明,高浓度的Fe2+会作为SO4·-的自由基清除剂,如反应式(6) 所示。可见,在此体系中零价铁加入量有一个最佳值,零价铁的加入量过低或过高都不利于甲基橙的降解。同时对比实验也证实无零价铁存在的条件下,甲基橙降解率比较低。
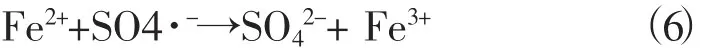
2.2 不同价态的铁对甲基橙降解率的影响
为了比较树脂纳米零价铁与不同价态铁离子对甲基橙降解效率的影响,考察了亚铁离子和三价铁离子在过硫酸钠体系对甲基橙降解率的影响(如图2所示)。

图2 Fe0、Fe2+和Fe3+对甲基橙降解率的影响
由图2可知,与亚铁离子和三价铁离子活化过硫酸钠降解甲基橙相比,零价铁体系表现出极大的优势,甲基橙降解率显著提高。反应85min后,甲基橙在Fe(Ⅱ) /过硫酸钠和Fe(Ⅲ) /过硫酸钠体系的降解率分别为61.2%和48.9%;而在过硫酸钠/NZVI-resin体系,甲基橙降解率几乎达到了100%。而且,三价铁在零价铁表面可被还原成亚铁离子,反应能循环进行。
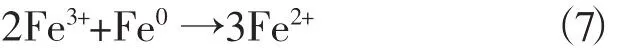
2.3 过硫酸钠浓度对甲基橙降解率的影响
Na2S2O8是体系中产生SO4·-的主体,所以本实验考察了过硫酸钠初始浓度对甲基橙降解率的影响,其浓度在0.80~1.47 g·L-1范围内变化,结果如图3所示。
图3 过硫酸钠浓度对甲基橙降解率的影响
从图3可以看出,当过硫酸钠的加入量为1.33 g·L-1时,反应85min后,甲基橙的降解率达到99.7%,而当继续增加时,过硫酸钠却抑制了甲基橙的降解,使甲基橙的降解率逐渐下降,类似于Fenton反应,过量的H2O2不利于有机物的降解[10]。这说明加入较高浓度的过硫酸钠,并不能显著地提高甲基橙降解效率,过硫酸钠也有一个适宜浓度值。
2.4 pH值对甲基橙降解率的影响
pH对有机污染物的降解反应起着关键作用,本实验通过改变甲基橙溶液初始pH值,探讨pH值对30mg·L-1的甲基橙溶液降解效果的影响,结果如图4所示。
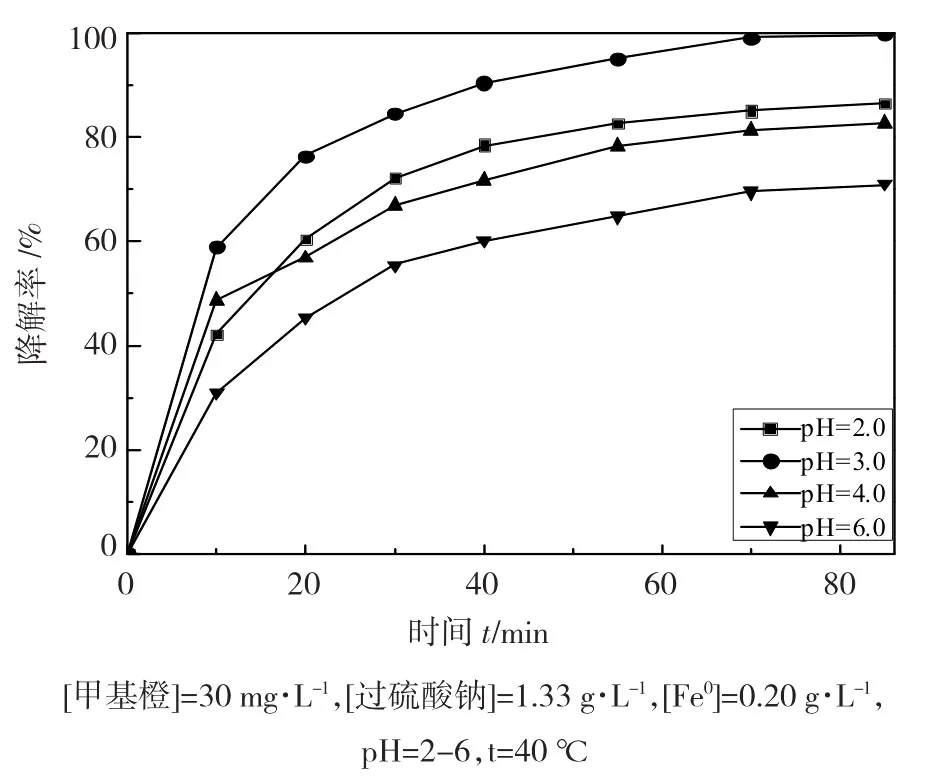
图4 不同pH对甲基橙降解率的影响
从图4可以看出,在pH<4.0范围内,甲基橙的降解均达到较好的效果,最佳pH值为3.0,降解率为99.7%;但当pH<3.0或pH>5.0时,甲基橙降解率都有所下降,pH>5.0时下降尤为迅速。这是因为[11]在较低的pH值下,大量H+的存在导致树脂纳米零价铁腐蚀速度加快,Fe0氧化成Fe2+,Fe2+在过硫酸钠溶液中生成硫酸根自由基,如反应式(8)、(9),加快了甲基橙的降解;但在弱酸性或碱性条件下,容易生成铁的氢氧化物钝化层并沉积于树脂纳米零价铁表面,降低了催化剂的活性,表现为反应速率低,且去除效果差。显然,酸性条件下有利于硫酸根自由基的生成,从而有利于甲基橙的降解。但是,过强的酸性条件会加剧树脂表面纳米铁的溶解和剥落,降低材料的使用寿命
2.5 温度对甲基橙降解率的影响
本实验在30~70℃下进行,探讨了温度对30mg·L-1的甲基橙溶液降解效果的影响,结果如图5所示。可以看出,甲基橙降解率随反应温度的升高而显著增加。反应70min后,在30℃下,甲基橙降解率为84.7%;随着温度的升高,在70℃下,甲基橙降解率为100%,得到了完全降解。当温度升高时,可以通过热活化过硫酸盐产生SO4·-。相比之下,同实验条件下,没有加入过硫酸钠的体系甲基橙降解率几乎没有任何变化。
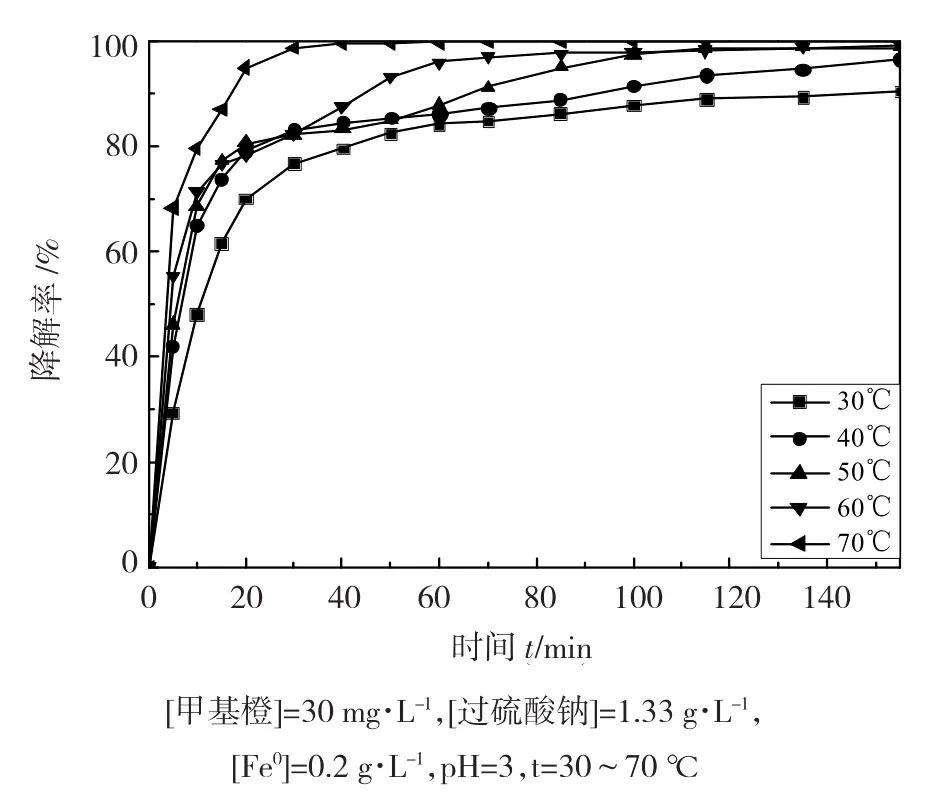
图5 温度对过硫酸钠氧化降解甲基橙的影响
实验结果表明,反应温度对过硫酸钠分解产生硫酸根自由基的影响很大,反应温度越高,吸收的能量越多,O-O键越容易断裂,产生的硫酸根自由基越多,对氧化降解甲基橙越有利,如反应式 (12) 所示:
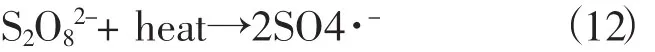
根据实验结果,可以看出甲基橙的降解符合准一级动力学方程,通过阿伦尼乌斯方程,计算出纳米树脂零价铁/过硫酸钠体系反应的活化能,方程式如(13) 所示:
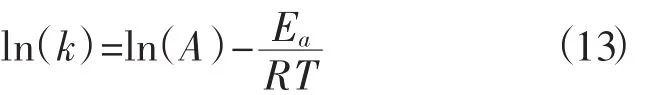
其中,A:前因子;Ea:反应活化能(J·mol-1);R:理想气体常数(8.314 J·mol-1·K-1);T:反应的绝对温度(K)。
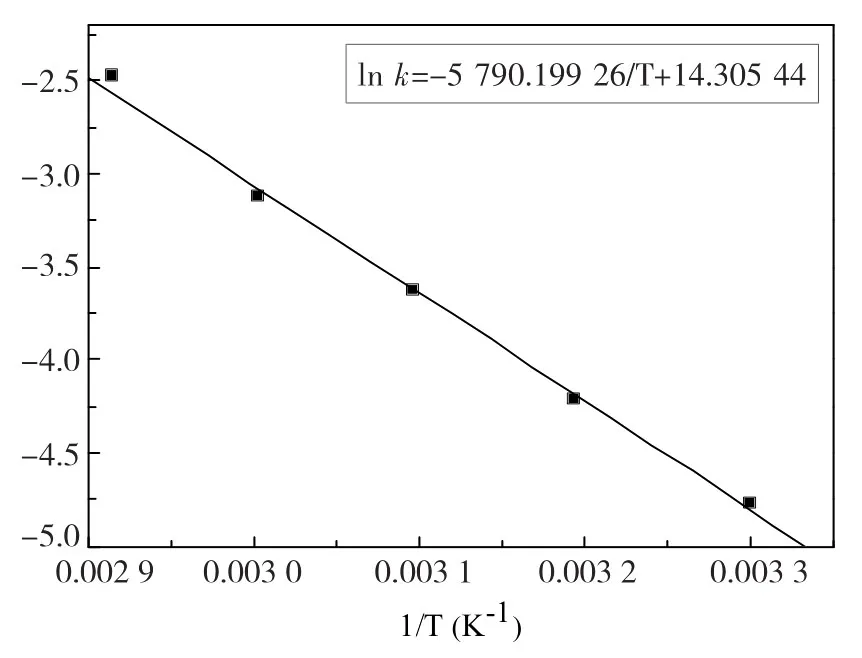
图6 温度对甲基橙降解反应速率常数的影响
由图6看出,ln k~1/T呈良好的线性关系,由此得出活化能为49.14 KJ·mol-1。可见,在加热过硫酸钠体系中,升高反应温度对甲基橙的降解速率有很大的促进作用。
3 结论
以树脂为载体制备的树脂纳米零价铁对偶氮染料甲基橙进行降解,活性较高,反应速率快,降解反应遵循准一级动力学。以树脂作为载体,具有制备方法简单,不需要复杂的前处理过程等优势,而且在降解过程中不会产生二次污染。
在NZVI-resin/过硫酸钠体系中,随着温度的升高,甲基橙降解率显著提高。反应70min后,70℃下,甲基橙降解率为100%。
在40℃、pH=3.0的条件下,随着NZVI-resin加入量的增加,溶液中亚铁离子浓度随之增加,当Fe0的浓度为0.2 g·L-1(树脂纳米铁为0.071 4 g)时,甲基橙的降解率最高为90.6%。
随着过硫酸钠浓度增大,甲基橙降解率先增加最后趋于平稳。在40℃、pH=3.0、Fe0=0.2 g·L-1的条件下,Na2S2O8最适宜的浓度为1.33 g·L-1。
[1]刘琰,孙德智.高级氧化技术处理染料废水的研究进展[J].工业水处理,2006,26(6):1-5.
[2]杨世迎,陈友媛,胥慧真,等.过硫酸盐活化高级氧化新技术[J].化学进展,2008,20(9):1433-1438.
[3]SHU H.Y,CHANG M.C,CHEN C.C,et al.Using resin supported nano zero-valent iron particles for decoloration of Acid Blue 113 azo dye solution[J].J.Hazard.Mater.2010,184(1-3):499-505.
[4]樊明德,袁鹏,陈天虎,等.蒙脱石载体对“核-壳”结构零价铁纳米颗粒制备及其尺寸控制的影响与机理[J].科学通报,2010,55(9):827-834.
[5]赵宗山,刘景富,邰超,等.离子交换树脂负载零价纳米铁快速降解水溶性偶氮染料[J].中国科学B辑:化学,2008,38(1):60-66.
[6]郭延辉,樊静,王建玲,等.树脂固载纳米铁对偶氮染料直接湖蓝5B的脱色性能研究[J]. 环境工程学报,2010,4(2):337-341.
[7]JING F,YAN H.G,WANG J.J,et al.Rapid decolorization of azodye methyl orange in aqueous solution by nanoscale zerovalent iron particles[J].J.Hazard.Mater.2009,166(2-3):904-910.
[8]HASSAN H,HAMEED B.H.Degradation of Acid Red 1 by heterogeneous Fenton-like reaction using Fe-ballclay catalyst[J].International Conference on Environment Science and Engineering,2011,8:232-236.
[9]常春,祝凌燕,朱淑真.纳米零价铁对γ-HCH的降解效果及机理研究[J]. 中国环境科学,2010,30(2):167-173.
[10]HUSSAIN I,ZHANG Y.Q,HUANG S.B,et al.Degradation of p-chloroaniline by persulfate activated with zero-valent iron[J].Chemical Engineering Journal,2012,203:269-276.
[11]GOMATHIDEVI L,GIRISH KUMAR S,MOHAN REDDY K,et al.Photo degradation of Methyl Orange an azo dye by Advanced Fenton Process using zero valent metallic iron:Influence of various reaction parameters and its degradation mechanism[J].J.Hazard.Mater.,2009,164(2,3):459-467.
Research on Degradation of M ethyl Orange by Sodium Persulfate Activated with Resin Supported Nano Zero-valent Iron
CuiGuanghua1, Cheng Jun2,Qin Li1
(1.College of Chemical Engineering, Hebei United University, Tangshan Hebei 063009, China;2.Environmental Management College of China, Qinhuangdao Hebei 066004, China)
The article adopted the resin with nano zero-valent iron complex (NZVI-resin) as a source of iron to activate sodium persulfate and generate sulfate free radical which may oxidize degradation of methyl orange azo dye.The effects of temperature,the dosages of NZVI-resin,pH,the concentration of sodium persulfate on methyl orange degradation were also examined.In addition,its degradation kinetics was discussed.The results showed that the degradation of methyl orange followed the first order kinetics.And in the initial pH=3, Fe0=0.2 g·L-1,Na2S2O8=1.33 g·L-1,the degradation efficiency of methyl orange solution with a concentration of 30mg·L-1could reach 99.7%.
ion exchange resin; nano zero-valent iron; sulfate free radical; methyl orange;degradation
X703.1
A
1008-813X(2012)05-0046-05
10.3969/j.issn.1008-813X.2012.05.014
2012-08-28
崔广华(1965-),男,河北辛集人,毕业于河北大学化学与环境科学学院物理化学专业,博士,教授,主要研究新型环境功能材料设计与制备。

