类芬顿试剂液相氧化法脱硝的实验研究
范春贞,李彩亭,路 培,张 星,赵伟伟,陶沙沙 (1.湖南大学环境科学与工程学院,湖南 长沙 410082;2.湖南大学环境生物与控制教育部重点实验室,湖南 长沙 410082)
类芬顿试剂液相氧化法脱硝的实验研究
范春贞,李彩亭*,路 培,张 星,赵伟伟,陶沙沙 (1.湖南大学环境科学与工程学院,湖南 长沙 410082;2.湖南大学环境生物与控制教育部重点实验室,湖南 长沙 410082)
以类芬顿试剂(H2O2/Fe3+/UV)液相氧化法脱硝,探讨了液相催化和类芬顿脱硝反应的机理及其关系.研究了H2O2浓度、[H2O2]/[Fe3+]、初始pH值、气体流量、紫外光和H2O2投加方式对NO去除率的影响.结果表明,脱硝效率随H2O2浓度增加而升高;H2O2浓度一定时,Fe3+浓度的增加有利于NO的脱除,[H2O2]/[Fe3+]=6时,脱硝效率最高;当初始pH值<3时,脱硝效率随pH值的升高而升高,当初始pH值>3时,pH值升高,脱硝效率下降,初始pH值为3时脱硝效果最好;NO去除率随气体流量的增加而下降;紫外光的照射能提高脱硝效率;分3次等量投加H2O2可以使脱硝效率维持在80%左右.
类芬顿试剂;氧化;液相催化;脱硝
大气中的氮氧化物(NOx)是引发光化学烟雾和酸雨等环境问题的主要原因,为治理其带来的污染,需要开发经济、高效、清洁且易于操作的脱硝技术.类Fenton试剂催化氧化法作为一种高级氧化技术,具有氧化能力强、无二次污染等优点,在环境治理中受到了重视[1-7].近年来一些学者运用芬顿试剂处理大气污染物[8-10],但使用Fe3+/H2O2的较少.研究表明[11-12], Fe3+/H2O2/UV对污染物有很强的氧化能力. Pignatello等[12]的研究表明Fe3+/H2O2/UV催化环己烯环氧化速率比H2O2/UV快得多,这可能与其产生的•OH和另外的活性氧化物有关.并且 Fe3+原料比 Fe2+原料便宜,在工业上有更好的应用前景.另外,由于Fe3+良好的液相催化作用,已有研究[13]将 Fe3+用于液相催化处理SO2和NOx,并取得较好处理效果.本研究以Fe3+代替芬顿反应中的Fe2+,并在紫外灯的照射下进行脱硝试验,研究 H2O2/Fe3+/UV氧化NO的能力以及反应机理.探讨类芬顿反应与 Fe3+液相催化作用之间的关系,以期寻找更好的脱硝氧化剂和最佳反应条件.
1 反应原理
1.1 Fe3+/H2O2反应机理
Fe3+/H2O2系统虽无紫外光照射,但反应仍可进行.发生的反应主要有平衡反应、Fe2+和 Fe3+之间的相互转化反应和自由基之间的反应.
1.1.1 平衡反应 Fe3+/H2O2系统存在诸多平衡反应,主要的反应如下[14]:
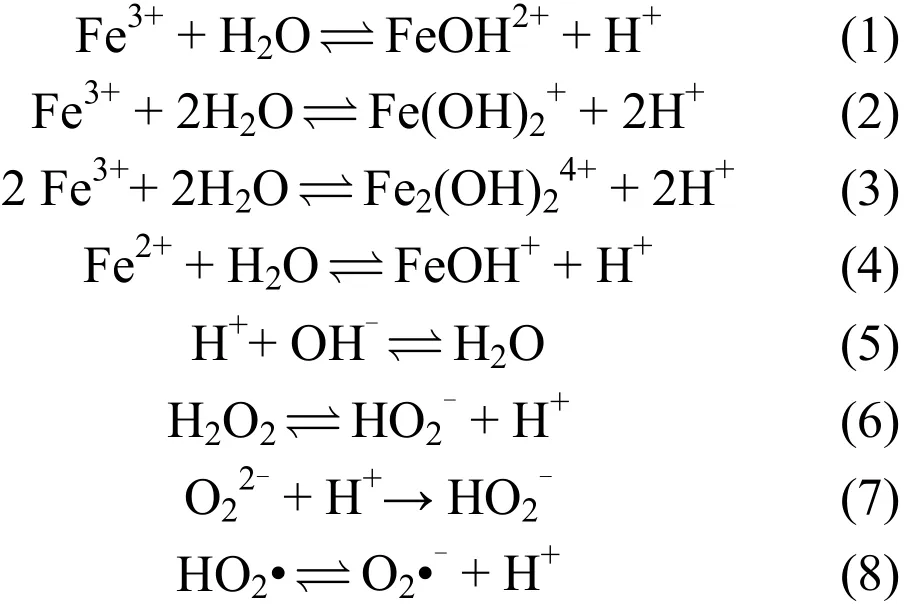
1.1.2 Fe2+和 Fe3+间的反应 Fe2+和 Fe3+间存在一系列的相互反应,两者的平衡影响自由基的产生.当平衡被破坏时,体系的氧化能力降低,脱硝效率降低.Fe2+和Fe3+间可能发生如下反应[11-12,14]:
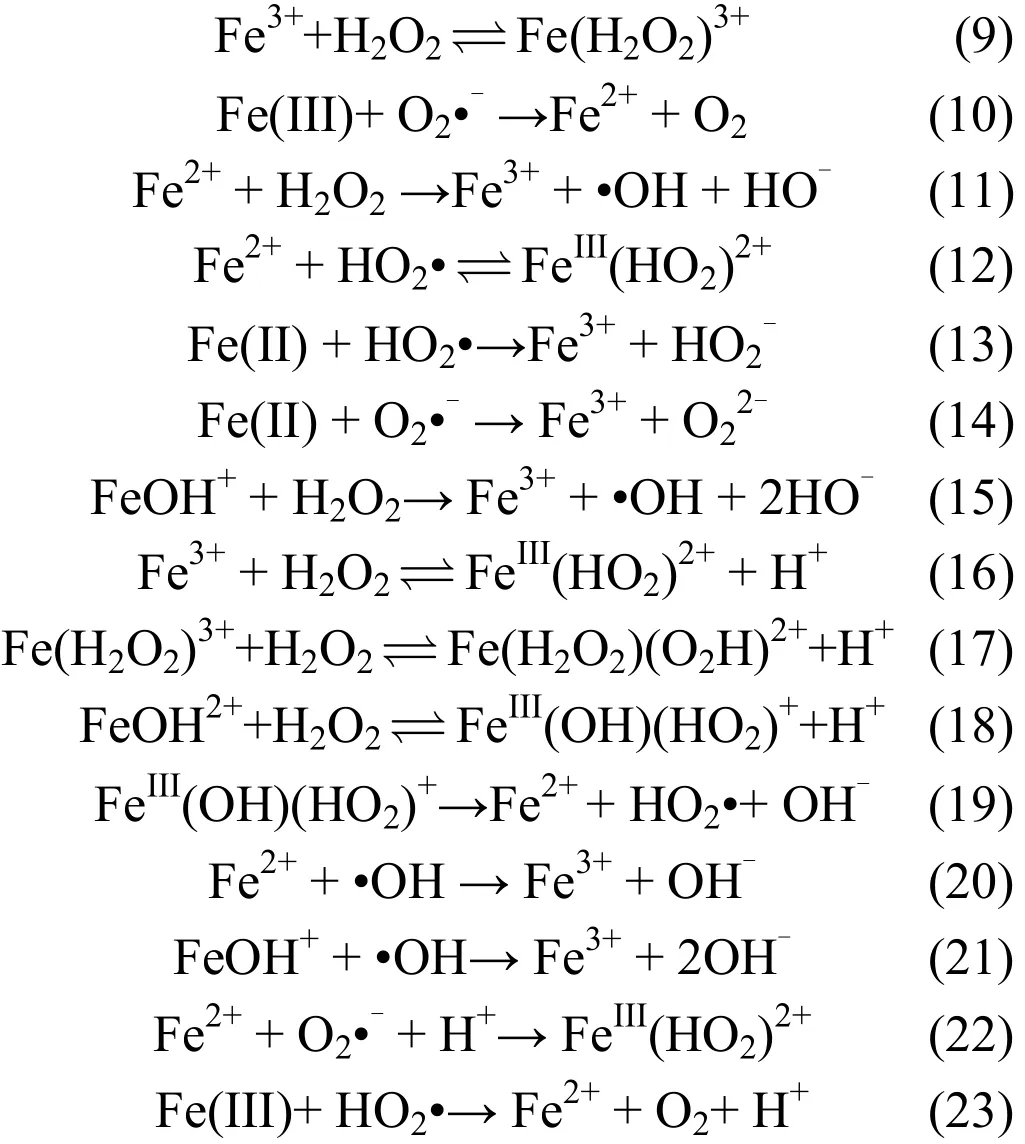
1.2 Fe3+/H2O2/UV反应机理
有研究表明[15]紫外光的存在会使芬顿类反应加速,即产生自由基的速度加快.这将有助于NO的脱除.此外,紫外光可以促进Fe2+的生成,使整体反应更顺利进行.由于紫外光的照射,系统中产生的一些配体物质分解,将促进体系对NO的吸收.此时Fe3+/H2O2系统的大部分反应还会存在,但会增加一些反应,将其归纳如下[10,12]:

在H2O2/UV反应中,产生的O2与H2O2产生协同作用,使生成•OH的总量增加.其原因是通入的O2吸收紫外光生成O3,进而分解成O2和原子氧,原子氧与H2O反应产生•OH,使溶液中•OH浓度增大[16].H2O2/Fe3+/UV体系中,通过烟气分析仪检测到大量 O2存在,并有紫外光的照射,满足生成O3的条件.由此推测包含如下反应[16]:
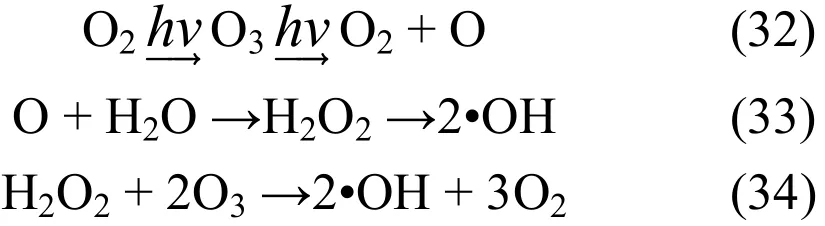
1.3 自由基与NO的反应
NO的去除作用是以上反应产生的自由基与NO发生反应,自由基的量决定反应系统的氧化能力.自由基与NO的反应如下[16]:

1.4 自由基之间的反应
活性氧自由基之间有复杂的反应,当大量自由基存在时,会导致自由基之间的相互反应,使其自身无效分解,H2O2的利用率随之下降.氧自由基之间的反应如下[11,14]:
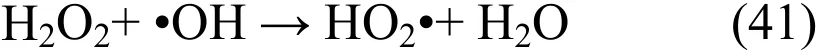

1.5 液相催化机理
Fe3+是一种具有较强得电子能力的过渡金属离子,已有学者研究其在液相催化氧化大气污染物[13,17-19].马双忱等[13]的研究表明,Fe3+具有很好的脱硝效率,但反应机理尚不清楚.禾志强等[18]的研究认为在该过程中,Fe3+可能与水分子相结合,以水合分子的形式存在,进而发生一系列水解反应,形成新的配合物,其可能发生的反应为:

综上所述,H2O2/Fe3+/UV体系脱除NO的反应过程复杂,受诸多因素影响,其中pH值、H2O2浓度、[H2O2]/[Fe3+]和紫外光对其影响较大.
2 实验部分
实验装置及流程如图1所示.

图1 实验流程示意Fig.1 Schematic diagram of the experimental system
采用自制鼓泡反应吸收器,模拟气体各组分由各个钢瓶提供,用分析纯 Fe2(NO3)3⋅9H2O和30%H2O2按比例配制反应吸收液,其中 H2O2的浓度用 KMnO4法进行标定.实验开始前,先向实验装置通5min的N2,排出其中的空气.模拟气体中O2浓度维持在6%,NO浓度为800mg/m3,其余为 N2.模拟烟气经质量流量控制器,进入气体缓冲瓶混合,之后进入装有吸收液的自制鼓泡反应器(Φ60mm×400mm),经反应器中的砂芯板鼓泡和磁力搅拌器搅拌.被吸收液净化后的气体进入无水氯化钙干燥管干燥,再经尾气吸收瓶吸收后排出.在鼓泡反应器进、出口分别设置旁路,用TESTO(350XL,德国)测量进、出口烟气组分和浓度.反应溶液的初始 pH值用配置的 HNO3或NaOH标准液来调节,以HI8424便携式pH计测定.实验操作均在室温下进行,吸收液体积为 1L.在鼓泡反应器两侧放置两支紫外灯(254nm、40W),组成反应系统.NO的去除率按式(51)计算:

式中:η为NO去除率,%;Cin、Cout分别为入口、出口气体中NO浓度,mg/m3.
3 结果与讨论
3.1 H2O2浓度对NO去除率的影响
反应式(35)~(40)表明,H2O2/Fe3+/UV体系的脱硝能力主要来自活性自由基.反应(24)和(25)表明 H2O2是活性自由基的来源.本组实验在气体流量为 400mL/min,初始 pH 值为 3, [H2O2]/[Fe3+]=10,2支紫外灯照射并将H2O2一次投加,不同H2O2浓度条件下进行,研究H2O2浓度对NO去除率的影响,结果如图2所示.
从图2可以看出,当未添加H2O2时,脱硝效率较低,初始效率仅为32%.由于纯水对NO几乎无吸收作用.原因可能是吸收液中有 0.05mol/L的Fe3+,具有液相催化作用[13,20],从而将NO去除.溶液中加入H2O2后,吸收液中生成HO2•和•OH,从而促进NO的脱除.随着H2O2浓度的增加,NO去除率不断提高,当 H2O2浓度大于 0.5mol/L时,NO去除率不再大幅度增加,在芬顿类体系中处理其他污染物也有类似现象[21-22].这主要因为当体系中 H2O2浓度较高时,将导致副反应发生,反应式(41)~(48)表明了自由基之间的相互反应,这将导致 H2O2的利用率降低.在芬顿反应中,随着系统中 H2O2浓度增大,其残留浓度会增加[23],因此在H2O2/Fe3+/UV体系中由于同样的机理使H2O2利用率下降.为使 H2O2高效利用,选取0.5mol/L的H2O2进行深入研究.

图2 H2O2浓度对NO去除率的影响Fig.2 Influence of H2O2 concentration on the removal efficiency of NO
3.2 Fe3+投加量对NO去除率的影响
在H2O2浓度为0.5mol/L,初始pH值为3,气体流量为400mL/min, 2支紫外灯照射并将H2O2一次投加的条件下,改变Fe3+浓度,使[H2O2]/[Fe3+] =2,4,6,8,10,12,以及未投加Fe3+时进行实验.
从图3可以发现,当无Fe3+存在时,NO初始去除效率为 60%,主要是反应(24)产生自由基的作用.不断增加 Fe3+的浓度,NO去除效率也在提高,主要是 Fe3+催化 H2O2反应,促进自由基的产生,还有 Fe3+的液相催化作用,即发生反应(24)~(32)和(50)~(51).由此推测 Fe3+的液相催化和类芬顿氧化具有协同作用.当[H2O2]/[Fe3+]=6时脱硝效率最高,可达 84%,之后开始下降.实验过程中发现当溶液中存在过量的 Fe3+时,溶液变浑浊,有沉淀产生,这将阻碍反应的进行,使脱硝效率下降.因此,应将[H2O2]/[Fe3+]控制在6左右.
3.3 初始pH值对NO去除率的影响
反应式(15)~(23)表明溶液的pH值影响Fe2+和 Fe3+在溶液中的存在形式和相互的络合平衡;H2O2的分解也受 pH值影响.因此 pH值是Fenton类试剂氧化过程的关键因素之一.本组实验条件:H2O2浓度0.5mol/L,[H2O2]/[Fe3+]=6,气体流量为400mL/min, 2支紫外灯照射并将H2O2一次投加.通过改变pH值进行试验,结果见图4.

图3 [H2O2]/[Fe3+]对NO去除率的影响Fig.3 Influence of [H2O2]/[Fe3+] on the removal efficiency of NO
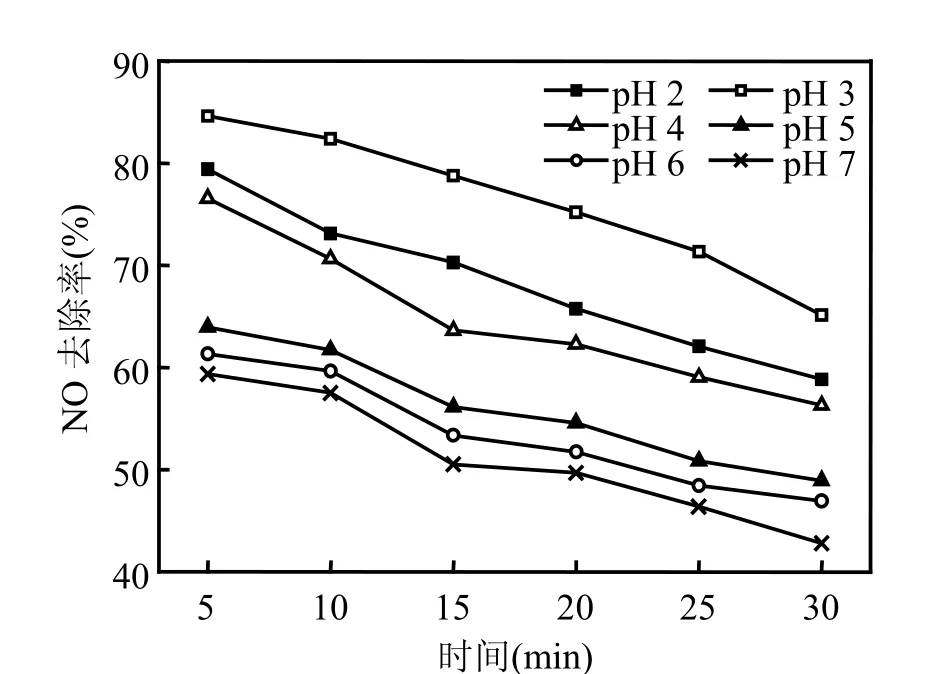
图4 初始溶液pH值对NO去除率的影响Fig.4 Influence of initial pH value on the removal efficiency of NO
图4表明,在实验条件下,pH值为3时初始脱硝效率最高,可达85%.类Fenton试剂处理其他污染物也有相同的最佳pH值[24].当pH值较高时,大量 OH-的存在,使 H2O2迅速无效分解,并且溶液中的 Fe2+和 Fe3+以氢氧化物的形式沉淀而失去催化能力.在强酸性环境中,H2O2过于稳定,氧化能力下降[8];并且 Fe2+和 Fe3+不能顺利的相互转化,使催化反应受阻;大量H+也会抑制NO的氧化.因此 pH值过高或过低都会降低体系的氧化能力,并且较低时,吸收液对设备有很强的腐蚀作用,所以pH值不宜过低,应调节到3左右.
3.4 气体流量对NO去除率的影响
H2O20.5mol/L,[H2O2]/[Fe3+]=6,初始 pH 值3,2支紫外灯照射并将H2O2一次投加,研究气体流量对NO去除率的影响.分别调节模拟气体流量为400,600,800,1000mL/min,进行实验.
由图 5可见,NO去除效率随气体流量增大而降低.当气体流量为400mL/min时NO去除率最高,初始脱硝效率为 85%;当增加到 1000mL/ min时初始脱硝效率迅速降低,仅为30%左右.因为随着气体流量的增加,砂芯板破碎出的气泡增大,气液接触面积减少;并且气泡在反应器中的停留时间缩短,减少了反应时间;此时气液传质过程受到严重影响,反应不彻底.所以选择模拟气体流量为400mL/min进行实验,从而增大气液接触面积,延长反应时间,以高效去除NOx.

图5 进气量对NO去除率的影响Fig.5 Influence of gas flow on the removal efficiency of NO
3.5 紫外光照射对NO去除率的影响
H2O2浓度为 0.5mol/L,[H2O2]/[Fe3+]=6,初始pH值为3,气体流量为400mL/min,并将H2O2一次投加,进行无紫外灯和添加2支紫外灯的对比,研究紫外光对吸收液氧化能力的影响.
由图6可见,无紫外光照射时,NO的初始去除率仅为 65%,添加紫外光照射后,增加到 85%.在紫外灯照射下,反应体系中的NOx分子吸收光子,使电子激发,由基态提升到激发态[9],使其更易于脱除;H2O2在紫外灯照射下,发生反应(24),产生•OH;同时紫外光也促进 Fe3+对体系的催化作用,如反应式(25)~(31)所示;反应产生的 O2在紫外光的作用下发生反应(32)~(34),以上过程都可以促进•OH的生成,提高体系的氧化能力,使NO的去除更迅速、彻底.

图6 紫外光对NO去除率的影响Fig.6 Influence of ultraviolet light on the removal efficiency of NO
3.6 H2O2投加方式对NO去除率的影响
在气体流量为 400mL/min,H2O20.5mol/L, [H2O2]/[Fe3+]=6,初始pH值为3, 2支紫外灯照射的条件下,研究不同的H2O2投加方式对NO去除率的影响,结果如图7所示.

图7 H2O2投加方式对NO去除率的影响Fig.7 Influence of the addition method of H2O2 on the removal efficiency of NO
由图7可知,分3次等量投加H2O2,每次间隔 10min,可以使 NO去除率维持在 80%左右.在芬顿类试剂处理其他污染物的研究中也有类似现象
[25].当反应体系中存在过多H2O2时,可迅速产生大量的自由基,自由基的累积会导致其自身无效分解而失去活性.分次投加 H2O2,可使•OH在吸收液中持续存在,从而有效地延长自由基的存在时间,提高了 H2O2的利用率和体系的氧化能力.
4 结论
4.1 由于类芬顿反应和液相催化的双重作用,H2O2/Fe3+/UV体系具有良好的脱硝效果.
4.2 脱硝效率随 H2O2浓度的增加而提高,当H2O2浓度高于0.5mol/L时脱硝效率可达80%以上.H2O2浓度一定时,脱硝效率随Fe3+浓度增加先升高后降低,当[H2O2]/[Fe3+]=6时脱硝效率最高.最佳初始pH值为3;最佳气体流量为400mL/min.
4.3 2支紫外光的添加可使脱硝效率提高 20%左右. 分3次等量投加H2O2可以使脱硝效率维持在80%左右.
[1] Kang Y W, Hwang K Y. Effects of reaction conditions on the oxidation efficiency in the Fenton process [J]. Water Research, 2000,34(10):2786-2790.
[2] Neppolian B, Jung H, Choi H, et al. Sonolytic degradation of methyl tent-butyl ether: The role of coupled fenton process and persulphate ion [J]. Water Research, 2002,36(19):4699-4708.
[3] Kwon B G, Lee D S, Kang N, et al. Characteristics of p-chlorophenol oxidation by Fenton’s reagent [J].Water Research, 1999,33(9):2110-2118.
[4] Sun Y, Plgnatello J J. Photochemical reactions involved in the total mineralization of 2,4-D by Fe3+/H2O2/UV [J]. Environmental Science and Technology, 1993,27(2):304-310.
[5] Pérez M, Torrades F, Domènech X, et al. Fenton and photo-Fenton oxidation of textile effluents [J]. Water Research, 2002, 36(11):2703-2710.
[6] Tan Y, Lu D, Anthony E J, et al. Mercury removal from coal combustion by Fenton reactions. Paper B: Pilot-scale tests [J]. Fuel, 2007,86(17/18):2798-2805.
[7] 崔春月,马 东,郑庆柱.Fenton改性多壁碳纳米管对亚甲基蓝的吸附性能研究 [J]. 中国环境科学, 2011,31(12):1972-1976.
[8] 彭敦亮,李彩亭,路 培,等.UV/H2O2液相氧化净化烟气中的NO的实验研究 [J]. 环境科学, 2011,32(4):949-954.
[9] 廖飞凤,徐江兴,徐 薇,等.UV/Fenton法处理硝基苯废气的实验研究 [J]. 哈尔滨建筑大学学报, 2002,35(3):64-67.
[10] Tokumura M, Nakajima R, Znad H T, et al. Chemical absorption process for degradation of VOC gas using heterogeneous gas-liquid photocatalytic oxidation: Toluene degradation by photo-Fenton reaction [J]. Chemosphere, 2008,73(5):768-775.
[11] Laat J D, Gallard H. Catalytic decomposition of hydrogen peroxide by Fe (III) in homogeneous aqueous solution: mechanism and kinetic modeling [J]. Environmental Science and Technology, 1999,33(16):2726-2732.
[12] Pignatello J J, Liu D, Huston P. Evidence for an additional oxidant in the photoassisted Fenton reaction [J]. Environmental Science and Technology, 1999,33(11):1832-1839.
[13] 马双忱,赵 毅,郑福玲,等.液相催化氧化脱除烟道气中 SO2和NOx的研究 [J]. 中国环境科学, 2001,21(1):33-37.
[14] Laat J D, Le T G. Kinetics and modeling of the Fe (III)/H2O2system in the presence of sulfate in acidic aqueous solutions [J]. Environmental Science and Technology, 2005,39(6):1811-1818.
[15] 王春敏,张 捷.类 Fenton试剂及其在废水处理中的应用 [J].山西化工, 2006,26(2):40-42.
[16] 马双忱,马京香,赵 毅,等.紫外/过氧化氢法同时脱硫脱硝的研究 [J]. 热能动力工程, 2009,24(6):792-795.
[17] Fuzzi S. Study of iron (III) catalysed sulphur dioxide oxidation in aqueous solution over a wide range of pH [J]. Atmospheric Enviroment, 1978,12(6/7):1439-1442.
[18] 禾志强,刘启旺.Fe3+催化氧化 S(Ⅳ)反应机理初探 [J]. 环境科学学报, 2006,26(10):1701-1706.
[19] Brandt C, Eldik R V. Transition metal-catalyzed oxidation of sulfur (Ⅳ ) oxides. Atmospheric-relevant processes and mechanisms [J]. Chemical Reviews, 1995,95(1):119-190.
[20] Skurlatov Y I, Zepp R G, Baughman G L. Photolysis rates of (2,4,5-trichlorophenoxy) acetic acid and 4-amino-3,5,6-trichloropicolinic acid in natural waters [J]. Journal of Agricultural and Food Chemistry, 1983,31(5):1065-1071.
[21] 钟 萍,杨 曦,赵贵来,等.光助Fenton试剂法氧化处理煤油废水溶液 [J]. 中国环境科学, 2002,22(5):460-463.
[22] 赵 英,左金龙,郭 亮,等.Fenton试剂对硫化物的处理效果研究 [J]. 哈尔滨商业大学学报(自然科学版), 2005,21(4):449-451,478.
[23] 张 晖,Huang C P. Fenton法处理垃圾渗滤液的影响因素分析[J]. 中国给水排水, 2002,18(3):14-17.
[24] Wang S. A comparative study of Fenton and Fenton-like reaction kinetics in decolourisation of wastewater [J]. Dyes and Pigments, 2008,76(3):714-720.
[25] 彭陵文,铁柏清,杨佘维,等.Fenton氧化法预处理垃圾渗滤液试验研究 [J]. 安全与环境工程, 2009,16(3):30-33.
Experimental research of purification NO-containing gas by aqueous oxidation with Fenton-like agent.
FAN Chun-zhen, LI Cai-ting*, LU Pei, ZHANG Xing, ZHAO Wei-wei, TAO Sha-sha (1.College of Environmental Science and Engineering, Hunan University, Changsha 410082, China;2.Key Laboratory of Environmental Biology and Pollution Control, Ministry of Education, Hunan University Changsha 410082, China). China Environmental Science, 2012,32(6):988~993
The fenton-like agent (H2O2/Fe3+/UV) liquid-phase oxidation method was used to purify the NO-containing gas. The mechanism of aqueous catalytic oxidation and fenton-like reaction in denitrification and their relationship were studied by investigating the influence of different operation parameters such as H2O2concentration, [H2O2]/[Fe3+], initial pH value, gas flow, ultraviolet rays (UV) and adding H2O2on the NO removal efficiency. The results showed that the efficiency was improved with the increase of H2O2concentration, and the best efficiency could be achieved when [H2O2]/[Fe3+]=6. Furthermore, when the initial pH value was less than 3, the NO removal efficiency would increase due to the enhancement of pH value, while on the contrary when initial pH>3, and the best efficiency could be reached at the initial pH value at 3. Besides, other processing activities such as employing the UV or decreasing the flue gas mass flow rate could also raise the efficiency. The experiment indicated that the efficiency could be maintained at about 80% if adding H2O2for three times.
fenton-like agent;oxidation;liquid phase catalytic;denitrification
X703
A
1000-6923(2012)06-0988-06
2011-09-29
国家“863”项目(2011AA060803);长沙市科技重大专项(K0902006-31);湖南省产学研结合技术创新工程项目(2010XK6003)
* 责任作者, 教授, ctli@hnu.edu.cn
范春贞(1987-),女,河南南阳人,湖南大学环境科学与工程学院硕士研究生,主要研究方向为大气污染控制工程.

