内蒙古农牧交错区沙蒿根围AM真菌物种多样性
贺学礼,郭辉娟,王银银,赵丽莉
(河北大学 生命科学学院,河北 保定 071002)
内蒙古农牧交错区沙蒿根围AM真菌物种多样性
贺学礼,郭辉娟,王银银,赵丽莉
(河北大学 生命科学学院,河北 保定 071002)
2009年4月、7月和10月分别在内蒙古农牧交错区元上都、黑城子和大河乡样地采集沙蒿(Artemisiasphaerocephala)根围土壤样品,利用形态学和微形态学特征分离鉴定沙蒿根围AM真菌种类,研究了AM真菌物种多样性.共分离鉴定出AM真菌3属20种,其中盾巨孢囊霉属(Scutellospora)2种,无梗囊霉属(Acaulospora)4种,球囊霉属(Glomus)14种.3属AM真菌在3个样地均有分布.3个样地共同优势种是黑球囊霉(G.melanosporum)和网状球囊霉(G.reticulatum).AM真菌物种丰度、香浓-威纳指数和均匀度在时间上表现为4月<7月<10月,空间上表现为元上都<黑城子<大河乡.扫描电镜下不同属种孢子表面纹饰特征差异明显,可作为AM真菌分类的参考依据.
AM真菌;物种多样性;扫描电镜;沙蒿;农牧交错区
农牧交错带是农耕区与草原牧区相连接的半干旱生态过渡带,生态环境十分脆弱,在农牧交错带上,生态系统的结构、功能及生态过程相当复杂,对于气候变化和人类干扰均极端敏感,环境因子、生物类群和社会经济活动均处于相变的临界区间,农牧交错带退化草地和农田已经被证明是京津地区沙尘暴的源头[1].沙蒿(Artemisiasphaerocephala)属菊科蒿属的沙生半灌木,抗旱性强,是我国北方荒漠草原区的重要固沙植物,在促进植物群落演替、保护和改善荒漠生态环境、促进植被恢复中发挥着重要作用,并有重要饲用和经济价值.
AM(arbuscular mycorrhiza)真菌能够与90%的植物形成共生关系,提高宿主植物对土壤N,P和水分的吸收,提高植物抗逆性,促进宿主植物生长,其在植物根围形成庞大菌丝网络和分泌的黏性物质可以改善土壤结构,在植被恢复和生态重建方面发挥着重要作用[2-4].目前,关于农田、草地等生态系统中AM真菌资源、生态分布、生物多样性等方面的研究已有广泛报道[5-7],而农牧交错带及荒漠植物AM真菌分布和活动的研究较少[8],有关沙蒿AM真菌物种多样性的研究未见报道.本实验研究了内蒙古农牧交错区沙蒿根围AM真菌种质资源、物种多样性及其时空分布,为利用菌根技术进行生态恢复提供依据.
1 材料和方法
1.1 研究样地
样地为内蒙古锡林郭勒盟多伦县大河乡(42°11′601″N,116°36′870″E)、黑城子(42°09′817″N,115°56′107″E)和元上都遗址(42°15′842″N,116°10′741″E).该区域为中温带大陆性气候,年均降水量200~365mm,全年降水量主要集中在夏季,年蒸发量1 000~2 600mm,年均气温0~3.4℃,海拔1 312~1 321m.土壤为风沙土.
1.2 样品采集
2009年4月、7月和10月,在每个样地选取4株生长良好的沙蒿植株,去掉表层的枯枝落叶,采集植株根围0~30cm土层土壤,装入密封塑料袋,带回实验室.4℃冷藏,过2mm筛,用于AM真菌的种类鉴定.
1.3 AM真菌孢子分离鉴定
用湿筛倾析-蔗糖离心法[9]分离AM真菌孢子,在体视显微镜下记录孢子数和孢子大小、颜色等特征,挑取孢子置于载玻片上,加水、乳酸等浮载剂压片观察,并辅助使用Melzer's试剂观察孢子壁及内含物特异性反应.根据有关AM真菌分类鉴定的资料鉴定[10].
将目标孢子从体视显微镜下挑出,自然风干,挑到粘有双面胶的样品台上,做好标记,经离子溅射仪喷金镀膜后,在KYKY-2800B型扫描电子显微镜下进行扫描拍照.
1.4 AM真菌物种多样性测定
根据贺学礼等方法[8]计算AM真菌种丰度、相对多度、分离频度、重要值、香浓-维纳指数、均匀度以及优势度的划分等.
1.5 数据分析
采用SPSS 16.0统计软件对数据进行单因子方差(One-Way ANOVA)分析和Pearson法相关分析.
2 结果与分析
2.1 AM真菌群落组成
本实验共分离鉴定出AM真菌3属20种(图1,图2).其中盾巨孢囊霉属(Scutellospora)2种,无梗囊霉属(Acaulospora)4种,球囊霉属(Glomus)14种.幼套球囊霉(G.etunicatum)和长孢球囊霉(G.dolichosporum)仅在黑城子和元上都样地分布,美丽盾巨孢囊霉(S.calospora)仅在黑城子和大河乡样地分布.

图1 20种AM真菌光镜照片(×400)Fig.1 20AM fungal species under the optical microscope(×400)
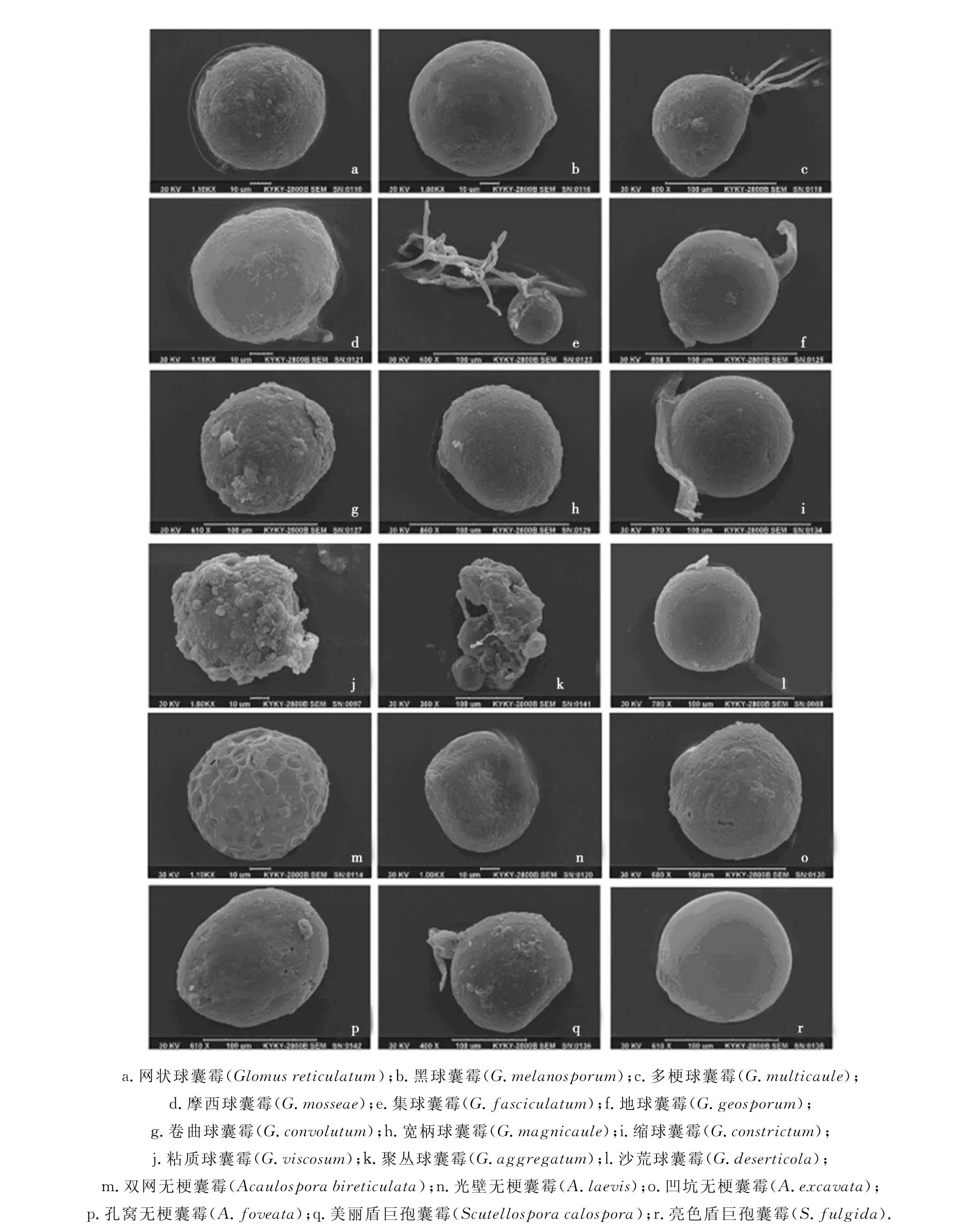
图2 18种AM真菌电镜照片Fig.2 18AM fungal species under SEM
2.2 AM真菌形态特征描述
AM真菌主要形态特征和微形态特征描述见表1.

表1 AM真菌形态特征描述Tab.1 Morphological characteristics description of AM fungi

续表1Continue tab.1
2.3 AM真菌分离频度、相对多度和重要值
从表2可知,3个样地共同优势种是黑球囊霉(G.melanosporum)和网状球囊霉(G.reticulatum),3个样地共同最常见种是聚丛球囊霉(G.aggregatum),黑城子样地最常见种还有粘质球囊霉(G.viscosum)和宽柄球囊霉(G.magnicaule);双网无梗囊霉(A.bireticulata)是大河乡和元上都样地共同最常见种.光壁无梗囊霉(A.laevis)为元上都稀有种;美丽盾巨孢囊霉(S.calospora)为大河乡和黑城子样地共同偶见种;幼套球囊霉(G.etunicatum)和长孢球囊霉(G.dolichosporum)为黑城子和元上都样地共同偶见种;大河乡样地稀有种还有多梗球囊霉(G.multicaule)、地球囊霉(G.geosporum)、摩西球囊霉(G.mosseae)、孔窝无梗囊霉(A.foveata)、凹坑无梗囊霉(A.excavata)和亮色盾巨孢囊霉(S.fulgida).
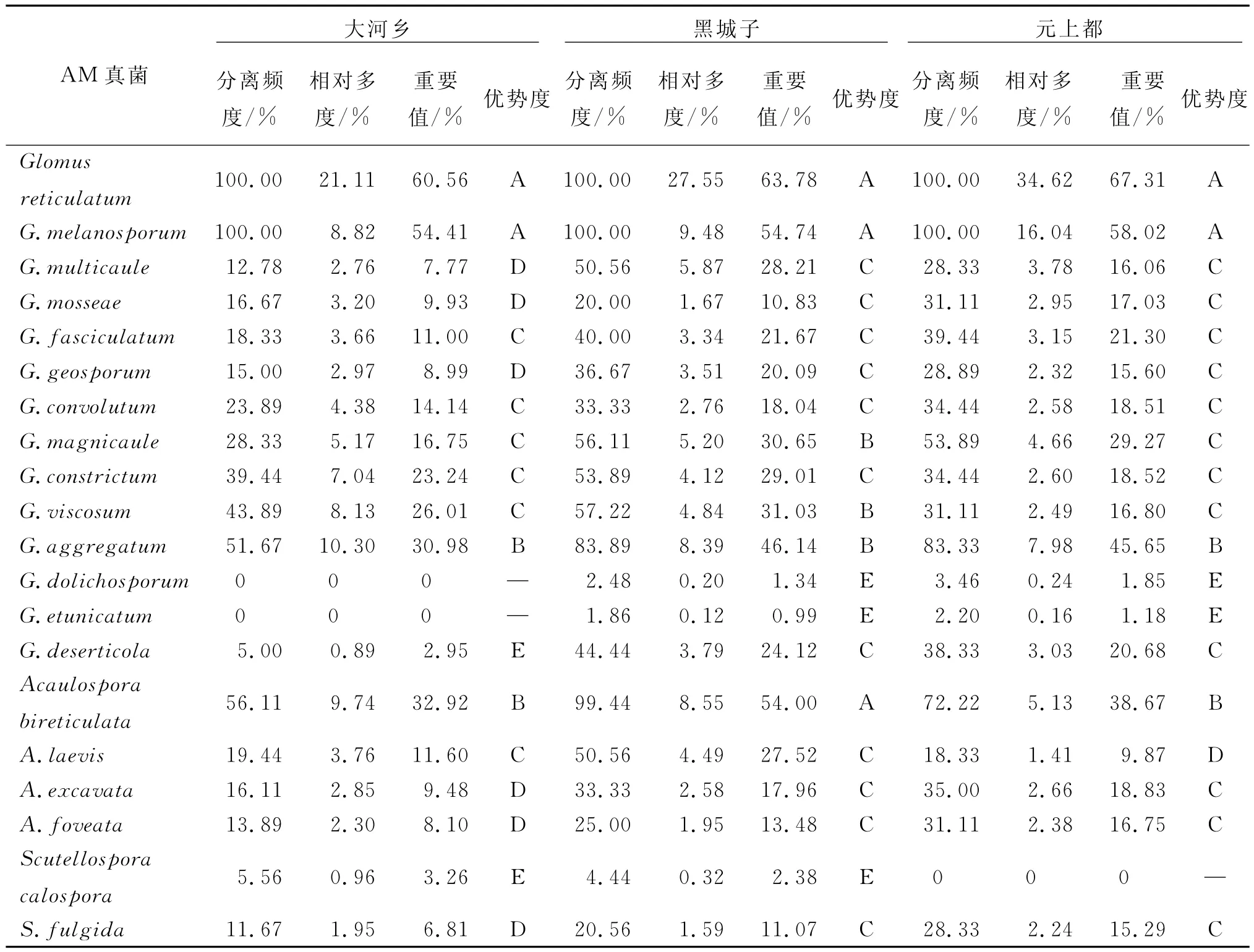
表2 3个样地AM真菌的多样性指标Tab.2 Diversity indexes of AM fungi at three sampling sites
2.4 AM真菌多样性时空变化
据表3可知,AM真菌物种丰度在4月显著低于7月和10月,7月和10月无显著差异;香农-威纳指数和均匀度在月份间的变化规律为,4月<7月<10月,但是月份间无显著差异.由表4可知,AM真菌物种丰度在样地间的变化趋势为:元上都<黑城子<大河乡,但是样地间无显著差异;元上都的香农-威纳指数显著低于其他2个样地;大河乡的均匀度显著高于元上都.样地 物种丰度 香农-威纳指数 均匀度

表3 不同月份沙蒿根围AM真菌多样性Tab.3 AM fungal diversity in the rhizosphere of Artemisiasphaerocephalain different months

表4 不同样地沙蒿根围AM真菌多样性Tab.4 AM fungal diversity in the rhizosphere of Artemisiasphaerocephala at different sites
3 讨论与结论
从沙蒿根围土壤共分离鉴定出AM真菌3属20种,其中球囊霉属所占比例最高,这与张美庆、盖京苹[11-12]等对我国北方地区AM真菌生态分布的研究结果相一致,说明球囊霉属在干旱条件下有更好的生态适应性.3个样地共同优势种是黑球囊霉和网状球囊霉,这为筛选沙蒿高效AM菌种提供了依据.另外,这几种AM真菌体积小,这是AM真菌对荒漠环境的生态适应.然而,长孢球囊霉和幼套球囊霉仅在元上都和黑城子样地有极少分布,在大河乡样地未见分布,说明这2种AM真菌对气候、环境等因子变化敏感、要求较高,故在条件瘠薄的荒漠地区无明显生长优势.此外,本研究结果比钱伟华等[13]在毛乌素沙地及腾格里沙漠油蒿根围分离到的28种AM真菌的结果少,这可能与宿主植物种类、土壤类型、气候等因素有关.
荒漠地区AM真菌多样性季节性变化的报道较少[14].本实验中,沙蒿根围AM真菌物种丰度4月显著低于7月和10月,香农-威纳指数和均匀度4月最低,10月最高.7月到10月沙蒿生长旺盛,能够满足AM真菌生长发育需要的养分,使得AM真菌物种丰度提高.
目前,借助光学显微镜下观察到的形态特征能够确定大多数AM真菌的分类地位,但难以满足形态相似种类及其系统发育关系的研究,此时,扫描电镜和分子生物学技术获得的微形态和分子特征能够丰富AM真菌物种多样性和系统分类研究内容.本实验中,扫描电镜下发现,球囊霉属真菌孢子表面常见颗粒状、脊状纹饰或粘有表面附着物,孢子常具连孢菌丝;无梗囊霉属真菌孢子表面除特有网纹、凹陷等纹饰外,几乎无颗粒状或脊状纹饰、表面附着物和连孢菌丝;盾巨孢囊霉属真菌孢子较大,表面光滑,纹饰较少,但连孢菌丝特征明显,可作为属的鉴定依据.
聚丛球囊霉为多个孢子聚集在一起,无明显界限,似被一外套包裹在一起.粘质球囊霉孢壁外有一黏质外套,Walker等人[15]认为该黏质外套不属于孢壁结构,主要成分为土壤颗粒;两者的外套可防止孢子内部水分和养分流失,使其更适应干旱环境.
地球囊霉表面偶见侵蚀状小孔,这与Roesti等[16]对地球囊霉的观察结果一致.扫描电镜下显示摩西球囊霉表面偶而见到小孔,推测这些小孔是细菌裂解活性所致[17].
扫描电镜下孔窝无梗囊霉外壁较光滑,孔窝近圆形,较小,直接下陷,外围无凸起轮廓;而凹坑无梗囊霉外壁粗糙,凹坑较大,形状不规则,凹坑口处一周稍外凸.因此利用扫描电镜有助于形态相似、亲缘关系相近AM真菌的分类鉴定.
研究结果表明,沙蒿根围AM真菌孢子明显趋于小型化,孢子表面形成的不同附着物和纹饰结构,对于有效阻止孢子体内水分散失和病虫害的侵扰,保持在极端荒漠环境中正常生长发育具有重要意义.通过研究荒漠植物AM真菌物种多样性及其变化规律,不仅可评估荒漠土壤环境和菌根共生体生态意义,而且可为充分利用菌根技术进行生态重建提供资料.
[1] 刘洪来,王艺萌,窦潇,等.农牧交错带研究进展[J].生态学报,2009,29(8):4420-4425.LIU Honglai,WANG Yimeng,DOU Xiao,et al.Progress and perspective of agro-pasturage ecotone[J].Acta Ecologica Sinica,2009,29(8):4420-4425.
[2] 边秀举,胡林,李晓林,等.VA菌根对坪草矿质养分吸收及草坪质量影响的研究[J].草业学报,2001,10(3):42-46.BIAN Xiuju,HU Lin,LI Xiaolin,et al.Effect of VA mycorrhiza on the turfgrass quality and mineral nutrient uptakes[J].Acta Prataculturae Sinica,2001,10(3):42-46.
[3] VOGEL-MIKUS K,DROBNE D,REGVAR M.Zn,Cd and Pb accumulation and arbuscular mycorrhizal colonisation of pennycressThlaspipraecoxWulf.(Brassicaceae)from the vicinity of a lead mine and smelter in Slovenia[J].Environmental Pollution,2005,133:233-242.
[4] BEARDEN B N,PETERSEN L.Influence of arbuscular mycorrhizal fungi on soil structure and aggregate stability of avertisol[J].Plant and Soil,1999,218:173-183.
[5] OEHL F,SIEVERDING E,MADER P,et al.Impact of long-term conventional and organic farming on the diversity of arbuscular mycorrhizal fungi[J].Oecologia,2004,138:574-583.
[6] MANGAN S A,EOM A H,ADLER G H,et al.Diversity of arbuscular mycorrhizal fungi across a fragmented forest in Panama:insular spore communities differ from mainland communities[J].Oecologia,2004,141:687-700.
[7] HE Xueli,LI Yingpeng,ZHAO Lili.Dynamics of arbuscular mycorrhizal fungi and glomalin in the rhizosphere ofArtemisiaordosicaKrasch.in Mu Us sandland,China[J].Soil Biology and Biochemistry,2010,42:1313-1319.
[8] 贺学礼,杨静,赵丽莉.荒漠沙柳根围AM真菌的空间分布[J].生态学报,2011,31(8):2159-2168.HE Xueli,YANG Jing,ZHAO Lili.Spatial distribution of arbuscular mycorrhizal fungi in Salix psammophila root-zone soil in Inner Mongolia desert[J].Acta Ecologica Sinica,2011,31(8):2159-2168.
[9] IANSON D C,ALLEN M F.The effects of soil texture on extraction of vesicular arbuscular mycorrhizal spores from arid soils[J].Mycologia,1986,78:164-168.
[10] SCHENCK N C,PEREZ Y.Manual for the identification of VA mycorrhizal fungi[M].2nd ed.Florida:FNVAM Gainesville,1988:91-97.
[11] 张美庆,王幼珊,张弛,等.我国北方 VA菌根真菌某些属和种的生态分布[J].真菌学报,1994,13(3):166-172.ZHANG Meiqing,WANG Youshan,ZHANG Chi,et al.The ecological distribution characteristics of cenera and species of VAM fungi in northern China[J].Acta mycologica sinica,1994,13(3):166-172.
[12] 盖京苹,冯固,李晓林.我国北方农田土壤中 AM 真菌的多样性[J].生物多样性,2004,12(4):435-440.GAI Jingping,FENG Gu,LI Xiaolin.Diversity of arbuscular mycorrhizal fungi in field soils from North China[J].Biodiversity Science,2004,12(4):435-440.
[13] 钱伟华,贺学礼.荒漠生境油蒿根围AM真菌多样性[J].生物多样性,2009,17(5):506-511.QIAN Weihua,HE Xueli.Diversity of arbuscular mycorrhizal fungi associated with a desert plantArtemisiaordosica[J].Biodiversity Science,2009,17(5):506-511.
[14] KLIRONOMOS J N,HART M M,GURNEY J E,et al.Interspecific differences in the tolerance of arbuscular mycorrhizal fungi to freezing and drying[J].Canadian Journal of Botany,2001,79:1161-1166.
[15] WALKER C,GIOVANNETTI M,AVIO L,et al.A new fungal species forming arbuscular mycorrhizas:Glomusviscosum[J].Mycological Research,1995,99:1500-1506.
[16] ROESTI D,INEICHEN K,BRAISSANT O,et al.Bacteria associated with spores of the arbuscular mycorrhizal fungiGlomusgeosporumandGlomusconstrictum[J].Applied and Environmental Microbiology,2005,71:6673-6679.
[17] FILIPPI C,BAGNOLI G,CITERNESI A S,et al.Ultrastructural spatial distribution of bacteria associated with sporocarps ofGlomusmosseae[J].Symbiosis,1998,24:1-12.
Species diversity of arbuscular mycorrhizal fungi in the rhizosphere ofArtemisiasphaerocephalain Inner Mongolia
HE Xueli,GUO Huijuan,WANG Yinyin,ZHAO Lili
(College of Life Sciences,Hebei University,Baoding 071002,China)
To study AM fungal species diversity and its spatio-temporal distribution,soil samples were collected in the rhizosphere ofArtemisiasphaerocephalafrom three sites of Inner Mongolia in April,July and October 2009,and morphological and micro-morphological characteristics separation-identification methods were used.The results showed that 20AM fungal species in three genera were isolated and identified from the rhizosphere ofA.sphaerocephalain Inner Mongolia,2species belong toScutellospora,4toAcaulosporaand 14toGlomus.G.melanosporumandG.reticulatumwere the dominant species in three sites.AM fungal species richness,Shannon-Wiener index and evenness displayed April<July<October in time,and Yuanshangdu<Heichengzi<Dahexiang on space.SEM showed that fungal spore morphology was different among species,especially in surface ornamentation,that could be used as a reference index for AM fungal identification.
AM fungi;species diversity;scanning electron microscope;Artemisiasphaerocephala;Farming-pastoral zone
Q949.3
A
1000-1565(2012)05-0506-09
2011-11-20
国家自然科学基金资助项目(40471075);保定市科学技术研究与发展计划项目(11ZN032)
贺学礼(1963-),男,陕西蒲城人,河北大学教授,博士生导师,主要从事生物多样性及土壤生态学研究.
E-mail:xuelh1256@yahoo.com.cn
赵藏赏)

