纳米羟基磷灰石的制备及其对Pb2+的吸附性能
张双圣,刘喜坤,刘 倩,刘汉湖,于向辉,谢 晗
(1. 徐州市城区水资源管理处,江苏 徐州 221018;2. 中国矿业大学 环境与测绘学院,江苏 徐州 221116;3. 徐州市水利建筑设计研究院,江苏 徐州 221018)
纳米羟基磷灰石的制备及其对Pb2+的吸附性能
张双圣1,刘喜坤1,刘 倩1,刘汉湖2,于向辉1,谢 晗3
(1. 徐州市城区水资源管理处,江苏 徐州 221018;2. 中国矿业大学 环境与测绘学院,江苏 徐州 221116;3. 徐州市水利建筑设计研究院,江苏 徐州 221018)
采用溶胶-凝胶法制备了纳米羟基磷灰石(n-HAP),使用FTIR、XRD、气体吸附仪等表征了n-HAP的物相及微观结构,并研究了n-HAP对模拟含Pb2+废水中Pb2+的吸附特性。实验结果表明:所制备的n-HAP粒径为24.39 nm,比表面积为53.50 m2/g, 孔体积为0.32 cm3/g;n-HAP对Pb2+的去除率随吸附时间、吸附温度和溶液pH(小于6.5的实验范围)的增加而增大,随初始Pb2+质量浓度增大而减小;n-HAP对Pb2+的吸附较符合准二级吸附动力学方程,颗粒内扩散过程是吸附速率的控制步骤;Langmuir吸附等温方程比Freundlich吸附等温方程更适合描述n-HAP对Pb2+的吸附热力学行为,Pb2+在n-HAP上的吸附符合单分子层吸附形式。
纳米;羟基磷灰石;溶胶-凝胶法;铅离子;吸附;废水处理
铅是一种对人体毒害性很强的重金属。目前,有很多处理含铅废水的方法,吸附法是常用方法之一[1-3]。海泡石、膨润土、高岭石、沸石、改性黏土和铁交联累托石等非金属矿物是吸附法的常用吸附剂[4],这些吸附剂性能优良,成本低廉,来源广泛。磷灰石族矿物因其特殊的晶体化学特征,对多种金属离子也具有吸附作用[5-8],是一种新型的环境功能矿物材料[9]。
本工作采用溶胶-凝胶法制备纳米羟基磷灰石(n-HAP),分别通过FTIR、XRD、气体吸附仪等方法对n-HAP的物相及微观结构进行了表征,并研究了n-HAP对模拟含Pb2+废水中Pb2+的吸附特性,为开发新型废水吸附剂提供依据。
1 实验部分
1.1 试剂和仪器
实验所用试剂均为分析纯。
BS224S型分析天平:赛多利斯科学仪器(北京)有限公司;SHA-BA 型水浴恒温振荡器:金坛市杰瑞尔电器有限公司;101F-1型电热鼓风干燥箱、SX2.5-12型马弗炉:上海树立仪器仪表有限公司;HY-2A型数显多用调速振荡器:金坛市医疗仪器厂;H1650型高速台式离心机:长沙湘仪离心机仪器有限公司;PP-50型pH计:德国Sartorius公司;TAS-990型原子吸收分光光度计:北京普析通用仪器有限责任公司;D/max-γA型旋转阳极XRD仪:日本理学公司;Thermo Nicolet 380型FTIR仪:美国Nicolet公司;Autosorb-1-MP型气体吸附仪:美国Quantachrome公司。
1.2 实验方法
1.2.1 n-HAP的制备
将3 500 m L浓度为0.025 mol/L的Ca(NO3)2溶液加入三口烧瓶中,用水浴加热并维持在45 ℃,在搅拌条件下将175 m L浓度为0.3 mol/L的H3PO4溶液缓慢滴加到Ca(NO3)2溶液中,加入氨水调节溶液pH至10.0左右。滴加完毕后,继续反应40 m in,然后陈化24 h。反应完成后将得到的胶体用蒸馏水洗涤3次,抽滤,将滤饼置于干燥箱中80 ℃条件下干燥。将产物初步研磨后置于马弗炉中经3 h升温至600 ℃,并在600 ℃下煅烧12 h,冷却,研磨,得到n-HAP粉体。
1.2.2 n-HAP的表征
采用XRD仪表征所制备的n-HAP试样的特征衍射峰:Cu Ka射线,管电压40 kV,管电流50 mA,扫描速率0.02(°)/s,扫描范围2θ=10°~80°;采用FTIR仪用KBr压片法对n-HAP进行扫描;采用气体吸附仪测定n-HAP的比表面积。
1.2.3 n-HAP对Pb2+的吸附实验
标准曲线的绘制:配制不同质量浓度的Pb2+溶液,用原子吸收分光光度计测定吸光度(A),绘制Pb2+质量浓度(ρ,mg/L)与吸光度的标准曲线:ρ=36.394A-0.233 9,线性相关系数为0.995 0。
取25 m L不同初始质量浓度的模拟含Pb2+废水,用NaOH溶液或HNO3溶液调节溶液pH后,置于50 m L的离心管中,n-HAP加入量为0.4 mg/m L。在不同温度、振荡频率为150 r/m in的条件下吸附一定时间,然后用转速为11 000 r/m in的离心机离心10 m in,取上清液测其吸光度,按照标准曲线计算溶液中Pb2+质量浓度,按式(1)和式(2)计算n-HAP对Pb2+的去除率(η,%)和t时刻n-HAP对Pb2+的吸附量(qt,mg/g)。

式中:ρ0为废水中初始Pb2+质量浓度,mg/L;ρt为t时刻废水中Pb2+质量浓度,mg/L;V为废水体积,L;m为n-HAP的质量,g。
2 结果与讨论
2.1 n-HAP的表征结果
n-HAP试样的XRD谱图见图1。由图1可见,n-HAP试样的各个衍射峰的位置均与n-HAP的标准卡片一致,没有其他的杂峰,说明本实验所制备的试样即为HAP。经计算,本实验所制备的HAP的粒径为24.39 nm,为n-HAP。

图1 n-HAP试样的XRD谱图
n-HAP试样的FTIR谱图见图2。
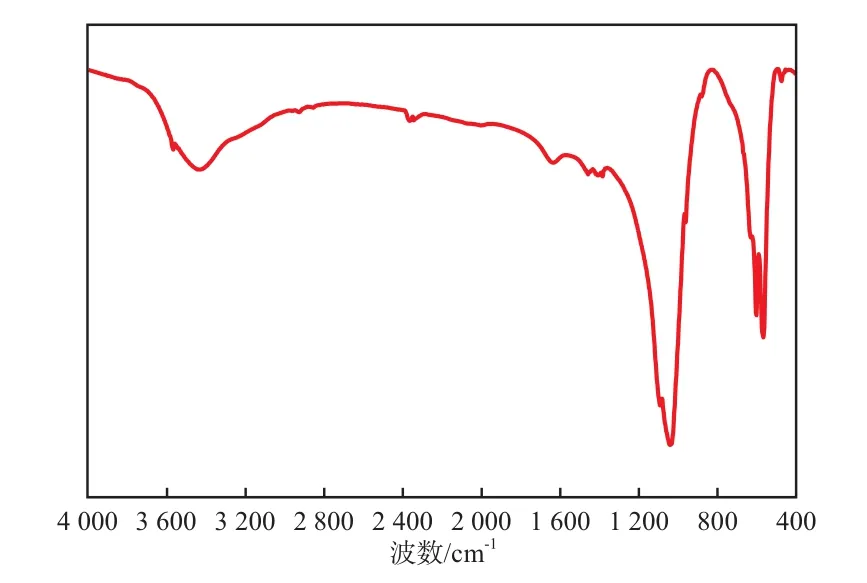
图2 n-HAP试样的FTIR谱图
由图2可见,3 435 cm-1处和631 cm-1处为—OH的伸缩振动和弯曲振动吸收峰;567,603,959,1 030,1 091 cm-1处为PO43-的吸收峰;1 456 cm-1处为NO3-的振动峰。
经气体吸附仪表征,n-HAP试样的比表面积为53.50 m2/g, 孔体积为0.32 cm3/g。
2.2 吸附时间对qt和η的影响
在初始Pb2+质量浓度为25 mg/L、吸附温度为25 ℃、溶液pH为7.0的条件下,吸附时间对qt和η的影响见图3和图4。由图3和图4可见:qt和η均随吸附时间的增加而增大; 吸附时间为2 m in时,η就达到89.78%;吸附时间超过120 min后,η趋于稳定,qt增加缓慢。这是因为吸附开始时Pb2+质量浓度较高,Pb2+向n-HAP表面及其孔隙内部的扩散速率较快,表现为吸附速率较大;随着吸附的进行,溶液中Pb2+浓度降低,扩散速率降低,同时由于n-HAP有效吸附位的减少,造成吸附速率下降,qt增加缓慢。
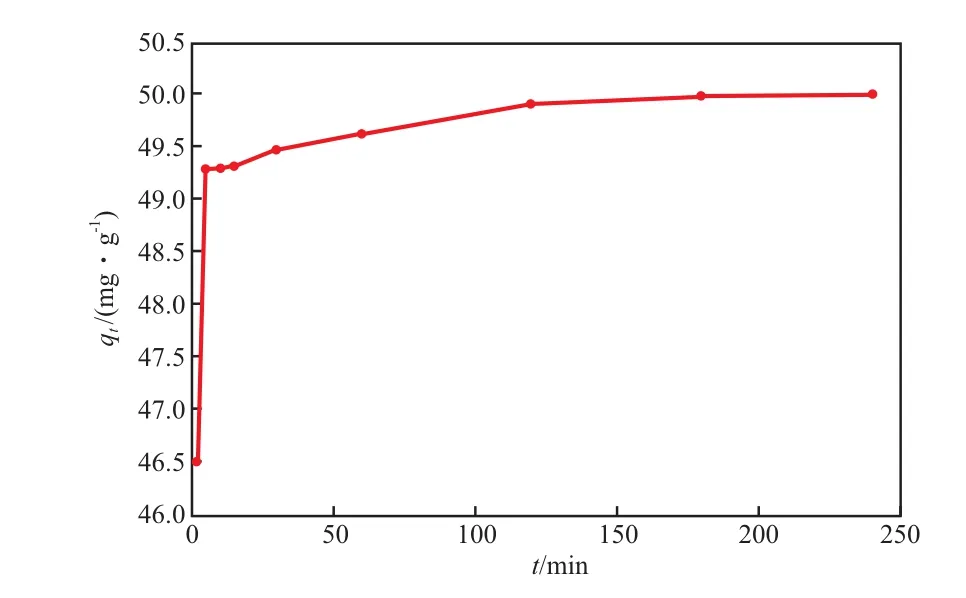
图3 吸附时间对qt的影响

图4 吸附时间对η的影响
2.3 初始Pb2+质量浓度对η的影响
在吸附温度为25 ℃、溶液pH为7.0、吸附时间为120 min的条件下,初始Pb2+质量浓度对η的影响见图5。由图5可见:随初始Pb2+质量浓度增大,η先缓慢减小;当初始Pb2+质量浓度大于70 mg/L时,η开始明显减小。这是因为n-HAP的有效吸附点位是有限的,当溶液中Pb2+质量浓度超过一定范围时,n-HAP对Pb2+的吸附达到饱和,溶液中Pb2+质量浓度越大,吸附后剩余的Pb2+质量浓度越大,η越小。

图5 初始Pb2+质量浓度对η的影响
2.4 吸附温度对η的影响
在初始Pb2+质量浓度为25 m g/L、溶液pH为7.0、吸附时间为120 m in的条件下,吸附温度对η的影响见图6。由图6可见,随吸附温度升高,η增大。这是因为:随吸附温度升高,n-HAP对Pb2+的吸附速率增大,qt也随之增加;该吸附是吸热过程,温度升高有利于吸附的进行;该吸附还包括Ca2+与Pb2+的离子交换过程,也是吸热过程[10]。

图6 吸附温度对η的影响
2.5 溶液pH对η的影响
溶液pH大于6.5时,会产生Pb(OH)2沉淀;随着溶液pH的增大,还会有Pb(OH)2-、Pb(OH)-43等产生,所以若实验在偏碱性条件下进行,则不能确定Pb2+究竟是被n-HAP吸附而去除,还是因沉淀或转变为其他离子而去除,故本实验的溶液pH必须调节至小于6.5。
在初始Pb2+质量浓度为25 mg/L、吸附温度为25 ℃、吸附时间为120 m in的条件下,溶液pH对η的影响见图7。由图7可见,随溶液pH增大,η增大。这是因为n-HAP含有Ca2+,会与溶液中的Pb2+发生离子交换,溶液pH越小,溶液中大量游离的H+和H3O+会与Pb2+竞争吸附位置,使得qt越小,因此η越小。

图7 溶液pH对η的影响
2.6 吸附动力学
采用准二级吸附动力学方程[11-13]和颗粒内扩散方程[14]来研究n-HAP对Pb2+的吸附动力学特性,动力学方程分别见式(3)和式(4)。

式中:qe为平衡吸附量,mg/g;k1为准二级吸附速率常数,g/(mg·m in)-1;kp为颗粒内扩散常数,mg/(g·m in0.5);t为吸附时间,m in ;C为常数,无量纲。n-HAP吸附Pb2+的准二级吸附动力学方程和颗粒内扩散方程的拟合结果见图8,方程参数见表1。

图8 n-HAP吸附Pb2+的准二级吸附动力学方程(a)和颗粒内扩散方程(b)的拟合结果

表1 n-HAP吸附Pb2+的准二级吸附动力学方程和颗粒内扩散方程的参数
由表1可见,准二级吸附动力学方程和颗粒内扩散方程均能在一定程度上描述n-HAP对Pb2+的吸附过程,且采用准二级吸附动力学方程能更好地进行描述,这是因为准二级吸附动力学方程包含吸附的所有过程,如外部液膜扩散、表面吸附和颗粒内部扩散等[15],能够真实地反映出Pb2+在n-HAP上的吸附机理。通过计算得到的平衡吸附量50.050 1 mg/g与实验值50.012 5 mg/g很接近。颗粒内扩散方程虽能描述此吸附过程,但效果次之,qt与t0.5呈现良好的线性关系,但直线不通过原点,说明Pb2+在n-HAP上吸附的颗粒内扩散过程是吸附速率的控制步骤,但不是惟一的控制步骤[16],因此颗粒内扩散方程只能用来描述Pb2+在n-HAP内部的吸附过程,并不适合整个过程。
2.7 吸附热力学
在吸附温度为25 ℃的条件下,n-HAP对Pb2+的吸附等温线见图9。由图9可见,该吸附等温线为第Ⅰ类吸附等温线,吸附以单分子吸附层的化学吸附为主。

Langmuir和Freunlich吸附等温方程分别见式(5)和式(6)。式中:ρe为吸附平衡时溶液中Pb2+的质量浓度,mg/L;qsat为吸附剂的饱和吸附量,mg/g; k为Langmuir常数,L/mg;n为浓度指数,n>1表示优惠吸附,无量纲;kF为吸附平衡常数,无量纲。
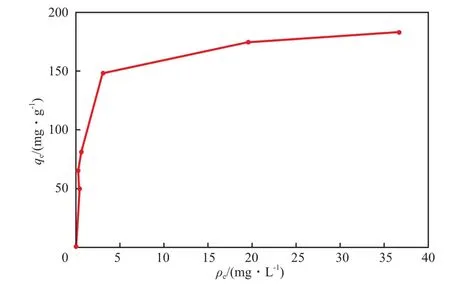
图9 n-HAP对Pb2+的吸附等温线
n-HAP吸附Pb2+的Langmuir和Freunlich吸附等温方程的拟合结果见图10,方程参数见表2。由表2可见:Langmuir吸附等温方程比Freundlich吸附等温方程更适合描述n-HAP对Pb2+的吸附热力学行为;Pb2+在n-HAP上的吸附符合单分子层吸附形式,该过程属于物理吸附与化学吸附并存的物理运动过程[17]。用Freundlich吸附等温方程进行描述时,决定性系数为0.866 1,n为3.627 4(介于1~10),表明n-HAP对Pb2+的吸附是优惠吸附,n-HAP对Pb2+的吸附具有选择性[18]。

图10 n-HAP吸附Pb2+的Langmuir(a)和Freundlich(b)吸附等温方程的拟合结果

表2 n-HAP吸附Pb2+的Langmuir和Freundlich吸附等温方程参数
3 结论
a)采用溶胶-凝胶法制备了n-HAP,分别通过FTIR、XRD、气体吸附仪等方法对n-HAP的物相及微观结构进行了表征。所制备的n-HAP粒径为24.39 nm,比表面积为53.50 m2/g, 孔体积为0.32 cm3/g。
b)n-HAP对模拟含Pb2+废水中Pb2+的吸附是包含离子交换的吸热过程。随吸附时间、吸附温度和溶液pH(小于6.5的实验范围)的增加,η增大;随初始Pb2+质量浓度增大,η减小。
c)n-HAP对Pb2+的吸附较符合准二级吸附动力学方程,颗粒内扩散过程是吸附速率的控制步骤,但不是惟一的控制步骤,颗粒内扩散方程只能用来描述Pb2+在n-HAP内部的吸附过程。
d)Langmuir吸附等温方程比Freundlich吸附等温方程更适合描述n-HAP对Pb2+的吸附热力学行为,Pb2+在n-HAP上的吸附符合单分子层吸附形式,n-HAP对Pb2+的吸附具有选择性。
[1] 韩春鹏,李仲谨,杨威,等. β-环糊精聚合物微球吸附Pb2+的动力学研究[J]. 化工环保,2011,30(6):487 - 491.
[2] Bailey E S,Olin T J,Bricka R M,et al. A review of potentially low-cost sorbents for heavy metals[J]. Water Res,1999,33:2469 - 2479.
[3] Mohan D,Singh K P. Single- and multi-compoent adsorption of cadm ium and zincusing activated carbon derived from bagasse-an agricultural waste[J]. Water Res,2002,36:2304 - 2318.
[4] 唐艳葵,韦科陆,童张法,等. 微波改性锆-铝柱撑膨润土对水中Cr(Ⅵ)的吸附[J]. 化工环保,2011,31(1):1 - 4.
[5] 冯启明,周玉栋,周开灿. 非金属矿产与环境保护[J]. 矿产资源利用, 1996(11):31 - 35.
[6]Maria France Brigatti. Sepiolite and industrial waste wa ter purification removal of Zn2+and Pb2+from aqueous solutions[J]. Appl Clay Sci,1996(11):43 - 54.
[7] 秦海燕,张立娟,孙家寿. 铁交联累托石处理含锌废水的试验研究[J]. 环境污染治理技术与设备,2003,4(11):35 - 38.
[8] 陈国安. 沸石处理重金属离子废水的试验研究[J]. 矿产保护与利用, 2001(6):17 - 19.
[9] 刘羽,彭明生. 磷灰石在废水治理中的应用[J]. 安全与环境学报, 2001,1(1):9 - 12.
[10] 孙卫玲,倪晋仁. 泥沙吸附重金属研究中的若干关键问题[J]. 泥沙研究, 2002(6):53 - 59.
[11] 丁世敏,封享华,汪玉庭,等. 交联壳聚糖多孔微球对染料的吸附平衡及吸附动力学分析[J]. 分析科学学报,2005,21(2):127 - 130.
[12] Yang Xiaoyan,Ai Duri Bushra. Kinetic modeling of liquid phase adsorption of reactive dyes on activated carbon[J]. J Colloid Interf Sci,2005,287:25 - 34.
[13] Yeddou N,Bensmaili A. Kinetic models for the sorption of dye from aqueous solution by clay-wood sawdust mixture[J]. Desalination,2005,185:499 - 508.
[14] Ho Y S,M cKay G. Kinetic models for the sorption of dye from aqueous solution by wood[J]. Trans Ins Chem Eng,1998,76:183 - 191.
[15] Chang M in Yun,Juang Ruey Shin. Adsorption of tannic acid,hum ic acid,and dyes from water using the composite of chitosan and activated clay[J]. J Colloid Interf Sci,2004,278(1):18 - 25.
[16] Mamdouh M N. Intraparticle diffusion of basic red and basic yellow dyes on palm fruit bunch[J]. Water Sci Technol,1999,40(7):133 - 139.
[17] 徐啸,刘伯羽,邓正栋. 活性炭吸附重金属离子的影响因素分析[J]. 能源环境保护,2010,24(2):48 - 50.
[18] 李明愉,曾庆轩,冯长根,等. 离子交换纤维吸附儿茶素的热力学[J]. 化工学报,2005,56(7):1164 - 1167.
Preparation of Nano-sized Hydroxyapatite and Its Adsorption Capability for Pb2+
Zhang Shuangsheng1,Liu Xikun1,Liu Qian1,Liu Hanhu2,Yu Xianghui1,Xie Han3
(1. Xuzhou City Water Resource Offi ce,Xuzhou Jiangsu 221018,China;2. School of Environment Science and Spatial Informatics,China University of M ining and Technology,Xuzhou Jiangsu 221116,China;3. Xuzhou City Design Institute of Water Conservancy Facilities,Xuzhou Jiangsu 221018,China)
Nano-hydroxyapatite (n-HAP) was prepared by sol-gel method,and its phase composition and pore structure were characterized by FTIR、XRD and gas adsorption apparatus. The adsorption capability of n-HAP for Pb2+in the simulated wastewater was investigated. The experimental results show that:The particle diameter,specific surface area and pore volume of n-HAP are 24.39 nm,53.50 m2/g,0.32 cm3/g,respectively;The removal rate of Pb2+increases with the increasing of adsorption time,adsorption temperature and solution pH (less than 6.5),but decreases with the increasing of initial Pb2+mass concentration;The adsorption of Pb2+on n-HAp accords with pseudo-second-order kinetics equation,and the intra-particle diffusion is the controlling step of adsorption rate;Compared with the Freundlich isotherm equation,the Langmuir isotherm equation is more appropriate to describe the adsorption behavior of n-HAP for Pb2+,and the adsorption accords with the mode of monomolecular layer adsorption.
nanometer;hydroxyapatite;sol-gol method;lead ion;adsorption;wastewater treatment
X703
A
1006 - 1878(2012)02 - 0123 - 06
2011 - 11 - 03;
2011 - 12 - 15。
张双圣(1983—),男,山东省昌邑市人,硕士,助理工程师,主要从事水资源管理与水污染控制技术的研究。电话 15162110638,电邮 zhang_shuangsheng@163.com。
2011年徐州市节能技术进步专项基金资助项目(XJ11B006)。
(编辑 祖国红)

