激素治疗风湿病患者股骨头骨坏死风险评估的MRI研究
牛金亮 NIU Jinliang
王 峻1 WANG Jun
李文晋2 LI Wenjin
李小峰3 LI Xiaofeng
茹晋丽3 RU Jinli
郑 英1 ZHENG Ying
郑 洁1 ZHENG Jie
宋志珍1 SONG Zhizhen
2.山西医科大学第二医院口腔科 山西太原 030001
3.山西医科大学第二医院风湿科 山西太原 030001
骨坏死(osteonecrosis)是风湿病患者治疗过程中常见的并发症之一,其中股骨头坏死(osteonecrosis of femoral head, ONFH)患病率最高[1]。激素治疗是风湿病患者股骨头坏死的致病因素之一,激素诱导骨髓间充质细胞向脂肪细胞分化是骨坏死机制的研究热点[2]。目前MRI是ONFH诊断及分期的首选方法,本研究观察激素治疗风湿病患者股骨头骨及骨髓的MRI表现,旨在为ONFH早期诊断、风险评估、早期预防干预治疗的临床研究提供影像学依据。
1 资料与方法
1.1 一般资料 收集2007-06~2008-10山西医科大学第二医院确诊的行激素治疗的风湿病患者50例,其中男性9例,女性41例;年龄18~52岁,平均(32.63±3.63)岁。其中类风湿关节炎27例,符合我国1987年制订的类风湿关节炎诊断标准[3];系统性红斑狼疮(systemic lupus erythematosus, SLE)患者23例,符合1982年美国SLE诊断标准[4]。所有患者均有明确的激素治疗史,开始使用激素到本次体检时间间隔6个月~2年。主要临床症状为髋部不适,髋部疼痛,行走后加剧。同时选取排除骨及骨髓病变的20例与激素治疗组年龄匹配(相差不大于2岁)的正常志愿者作为正常对照组。所有受试者均签订知情同意书。
1.2 仪器与方法
1.2.1 常规MRI检查 所有受试者采用西门子Sonata 1.5T MR检查仪,使用冠状位,同时包括双侧髋关节。扫描序列及参数:脂肪抑制序列采用短时间反转恢复序列(short time inversion recover, STIR),TR/TE/TI=5000ms/27ms/180ms,视 野(field of view, FOV)400mm,采集矩阵为486×512;SE序列T1WI,TR/TE=580ms/20ms,FOV为400mm,采集矩阵为512×512。所有序列均采用相同层面,层厚3mm。所有患者均在MRI检查前摄X线髋关节平片。
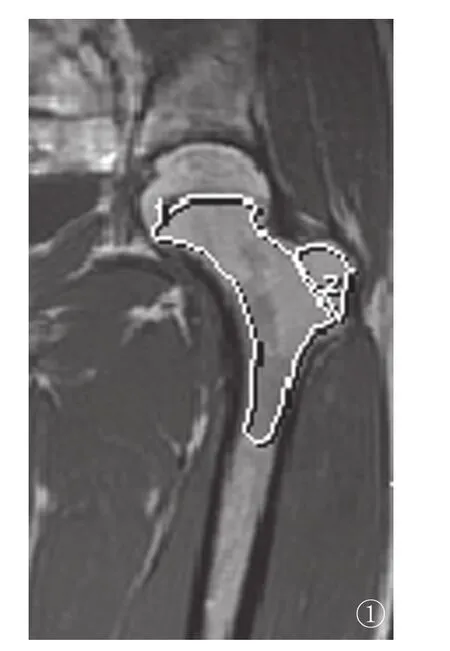
图1 骨髓转化系数(MCI)划界。“1”代表干骺端,上界和外界是骺软骨发育成熟后遗留骺瘢,骺瘢T1WI为低信号,下界为股骨干的近端;“2”代表大转子;股骨MCI=SM/ST×100
股骨骨髓信号强度分析:选取20例未发生骨坏死的激素治疗患者,观察其股骨头及干骺端骨髓的MRI表现。采用骨髓转化系数(marrow conversion index,MCI)定量分析干骺端骨髓信号程度,比较激素治疗组患者与对照组志愿者干骺端骨髓信号强度的差异。MCI的计算方法:SE序列T1WI正中冠状位计算大转子及干骺端的信号强度,沿骺线的界限划分各区间(图1),信号强度值由西门子设备自带软件包自动生成,干骺端骨髓的信号强度用SM(marrow signal intensities of metaphysis)表示,大转子骨髓的信号强度用ST(marrow signal intensities of the greater trochanter)表示,MCI=SM/ST×100,双侧股骨MCI的平均值为患者的研究值[5]。
1.2.2 MRI动态增强扫描(dynamic contrast-enhanced MRI, DCE-MRI)分析股骨近端血流灌注 采用DCEMRI分析股骨头及干骺端血流灌注。MRI检查对象同MCI测量对象DCE-MRI序列及参数:快速小角度激发(fast low-angle shot FLASH)序 列 T1WI,TR=9.5ms,TE=4.8ms,翻转角=25°,层厚5mm,采集层面为1层,每次采集时间为1.5s。具体方法:选取T1WI股骨中央层面为研究层面,常规MRI检查完毕后启动FLASH序列,采集次数为120~160次,总时间为160~240s。当采集次数达到15次时注药,造影剂采用德国先灵公司生产的钆喷替酸葡胺(Gd-DTPA),剂量为0.2ml/kg,注射流率为5ml/s。造影剂推注完毕,以同样的速率推注生理盐水。兴趣区(region of interest,ROI)的选择同常规MRI检查。将原始数据导入西门子MRI检查仪自带软件Mean curve,选择ROI,自动生成时间-信号强度曲线(enhancement-time curve, ETC),选择动脉显影前曲线平稳区域的一层为参考层面,软件自动将曲线换算百分比ETC,本组所有信号强度值均为百分比信号强度值。评估组织微循环血流灌注的参数为首次通过最高信号强度(fEmax),计算方法为在ETC曲线上直接读取首次通过峰值的信号强度[6]。
1.3 统计学方法 采用SPSS 11.0统计软件,计量资料数据以均数±标准差()表示,激素治疗组和正常对照组MCI值、股骨头及干骺端血流灌注fEmax值比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 股骨干骺端骨髓MRI信号强度计算 50例患者中5例(6髋)发生股骨头坏死,其中1例为双髋。20例未发生骨坏死的激素治疗患者与正常对照组比较,干骺端等信号红骨髓不同程度地向高信号黄骨髓转化,红骨髓面积减小,MRI成像T1WI表现为干骺端信号强度增高(图2、3);两组MCI值分别为90.41±5.23、79.51±6.58,差异有统计学意义(t=4.10,P < 0.01)。

图2 正常志愿者,30岁,MRI成像。T1WI显示干骺端红骨髓为等信号,大转子及股骨头为黄骨髓高信号。图3 SLE激素治疗患者,31岁,MRI成像。干骺端等信号红骨髓面积减少,高信号黄骨髓面积增加
2.2 股骨干骺端及股骨头血流灌注MRI检查结果 激素治疗组干骺端及股骨头fEmax值较正常对照组明显减低,差异有统计学意义(P<0.05),见表1。
表1 激素治疗组与正常对照组干骺端及股骨头ETC曲线fEmax值比较()
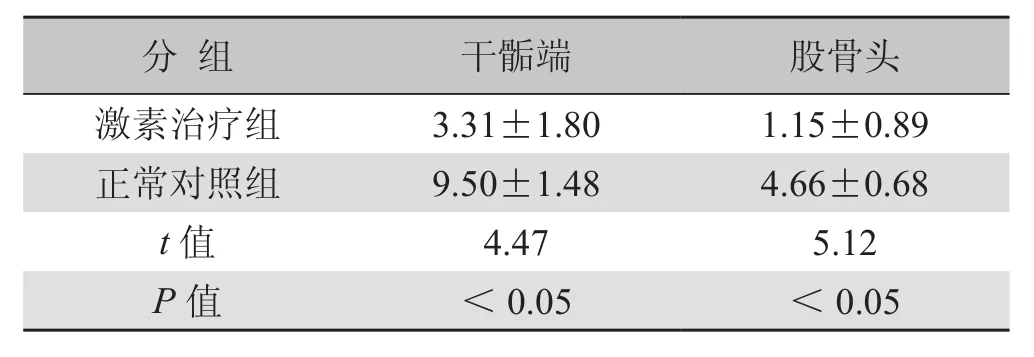
表1 激素治疗组与正常对照组干骺端及股骨头ETC曲线fEmax值比较()
3 讨论
3.1 激素诱导股骨骨髓转化MRI表现及骨坏死风险评估 ONFH是风湿病治疗过程中的严重并发症,其中SLE发病率最高,但确切机制尚未阐明。自身系统性炎症与ONFH有关,但激素治疗仍然是ONFH发生的重要机制。以SLE为例,SLE患者乳酸脱氢酶(lactate dehydrogenase, LDH)、肿瘤坏死因子(tumor necrosis factor, TNF)、同型半胱氨酸(homocysteic acid, HCA)等炎症介质含量增加,这些炎症介质可通过多种机制降低骨血流灌注,影响骨正常新陈代谢[1,7],但目前SLE的主要治疗药物仍然是激素,因此需更加重视SLE治疗过程中ONFH的发生。多数研究探讨了激素用量及使用方法与ONFH的关系,Zonana-Nacach等[7]研究认为大剂量激素治疗(泼尼松>60mg/d,连续使用2个月)与骨坏死有显著相关性,冲击疗法(甲泼尼龙1g/ d,连续使用1~3d)与骨坏死的相关性尚不确定。沈凌汛等[8]研究认为冲击疗法是发生骨坏死的高风险因素。激素累计使用量与骨坏死无相关性。在激素与ONFH的机制中,激素促进、调节骨髓间充质干细胞向脂肪细胞转化(大体病理表现为骨髓转化)受到重视[5,9]。以股骨为例,骨髓转化表现为生理状态下含红骨髓的组织转化为含脂肪细胞较多的黄骨髓(股骨的干骺端),MRI检查表现为T1WI等信号红骨髓面积较小,高信号黄骨髓面积增加;黄骨髓区域脂肪细胞数量和体积增加(股骨头),MRI不能从信号强度反映这一变化。骨髓转化的结果是相应组织血流灌注降低,是发生缺血坏死的高风险因素,表现为股骨头大量脂肪细胞生成,骨髓腔压力增高,组织血流灌注进一步降低,进一步研究表明股骨颈骨折及其他原因引起的ONFH均可见股骨头及干骺端大量脂肪细胞[5],说明骨髓转化是ONFH后期共同的病理生理演变过程,因此,骨髓转化在骨坏死中的作用具有普遍意义。
本研究结果发现,激素治疗未发生ONFH的风湿病患者干骺端等信号红骨髓面积较正常志愿者减小,高信号黄骨髓面积增加,说明骨髓转化是激素治疗的病理改变。MCI定量分析激素治疗后骨髓转化的程度,结果表明,两组MCI值差异有统计学意义(t=4.10,P<0.01)。MCI值是通过干骺端骨髓信号强度的变化反映机体骨髓转化的程度,可以认为MCI值越高,股骨头骨髓转化的程度越高,发生ONFH的几率越大,是评估ONFH风险性的影像学依据,尚需结合临床进一步研究制订MCI值的阈值,治疗前后动态观察骨髓转化的程度,提示ONFH的风险性。服用高剂量皮质激素的患者同时应用降脂药物,其骨坏死的发生率仅为1%,远低于常规激素治疗骨坏死的发生率(3%~20%)[10]。然而,这些研究尚处于探索阶段,何时用药以及用药量尚不完全清楚。本研究认为,MCI值能动态监测激素治疗过程中骨及骨髓的病理变化,为预防ONFH的发生提供影像学依据,MCI在股骨头坏死的防治研究中具有可观的临床应用前景。
3.2 DCE-MRI DCE-MRI是在活体内观察组织微循环血流动力学的影像技术,可以完整记录造影剂进入和排出组织的动力学过程,是评估组织微血管密度(microvessel density, MVD)及通透性的重要影像学方法,目前已应用于骨及骨髓血流灌注的研究[6,11]。风湿病患者无论是系统性炎症还是激素治疗均通过多种机制引起骨的血流灌注减少,骨组织发生缺血坏死[1,12]。本研究表明,与正常对照组相比,激素治疗患者干骺端及股骨头的血流灌注明显降低。虽然DCE-MRI能直接显示骨组织的血流灌注,但生理状态下股骨头含黄骨髓,血流灌注低,激素治疗后血流灌注进一步降低,因此,通过DCE-MRI准确测量局部血流灌注尚处于研究阶段。另外,需注射造影剂及在高场强MRI机完成使应用及研究受到限制。
MRI是早期诊断股骨头坏死的重要影像学方法,骨髓转化系数及骨髓血流灌注是评估骨坏死风险性的重要手段,有望为骨坏死的预防及风险评估提供定量影像学依据。
[1]Lane NE.Therapy insight: osteoporosis and osteonecrosis in systemic lupus erythematosus.Nat Clin Pract Rheumatol,2006, 2(10): 562-569.
[2]李子荣.股骨头坏死的早期诊断治疗及合理治疗.中华关节外科杂志(电子版), 2008, 2(1): 1-3.
[3]中华医学会风湿病学分会.类风湿关节炎诊断及治疗指南.中华风湿病学杂志, 2010, 14(4): 265-270.
[4]中华医学会风湿病学分会.系统性红斑狼疮诊断及治疗指南.中华风湿病学杂志, 2010, 14(5): 342-346.
[5]Koo KH, Dussault RG, Kaplan PA, et al.Fatty marrow conversion of the proximal femoral metaphysis in osteonecrotic hips.Clin Orthop Relat Res, 1999, (361):159-167.
[6]Kiessling F, Jugold M, Woenne EC, et al.Non-invasive assessment of vessel morphology and function in tumors by magnetic resonance imaging.Eur Radiol, 2007, 17(8):2136-2148.
[7]Zonana-Nacach A, Barr SG, Magder LS, et al.Damage in systemic lupus erythematosus and its association with corticosteroids.Arthritis Rheum, 2000, 43(8): 1801-1808.
[8]沈凌汛, 夏菲, 余立凯.系统性红斑狼疮患者并发无菌性骨坏死的调查分析.中华风湿病学杂志, 2005, 9(1):20-23.
[9]Kamata N, Oshitani N, Sogawa M, et al.Usefulness of magnetic resonance imaging for detection of asymptomatic osteonecrosis of the femoral head in patients with inflammatory bowel disease on long-term corticosteroid treatment.Scand J Gastroenterol, 2008, 43(3): 308-313.
[10]Descloux E, Durieu I, Cochat P, et al.Paediatric systemic lupus erythematosus: prognostic impact of antiphospholipid antibodies.Rheumatology, 2008, 47(2): 183-187.
[11]Menezes NM, Connolly SA, Shapiro F.Early ischemia in growing pig let skeleton: MR diffusion and perfusion imaging.Radiology, 2007, 242(1): 129-136.
[12]Griffith JF, Antonio GE, Kumta SM, et al.Osteonecrosis of hip and knee in patients with severe acute respiratory syndrome treated with steroids.Radiology, 2005, 235(1):168-175.

