骨髓瘤细胞诱导破骨前体细胞分化的分子机制探讨
汤丽苑 俞 康
多发性骨髓瘤(MM)是以骨髓微环境中浆细胞恶性增殖为特征的血液肿瘤.RANKL/核因子-κB受体活化因子(receptor activator of NF-κB,RANK)/护骨素(osteoprotegerin,OPG)与MM发病关系密切[1]。但目前国内外对 MM细胞本身是否表达RANKL仍未达成共识。本文着重研究人骨髓瘤细胞株RPMI8226能否表达 RANKL。通过 rhRANKL、条件培养液与RANKL mAb体外干预,从细胞水平和基因水平探讨骨髓瘤细胞RPMI8226诱导RAW264.7细胞分化成熟的影响,从而进一步阐明骨髓瘤骨病(myeloma bone disease,MBD)的分子机制。
材料与方法
1.主要材料:鼠单核吞噬细胞株(RAW264.7)购于北京协和医科大学细胞库。人骨髓瘤细胞株(RPMI8226)和人成骨肉瘤细胞株(MG-63)购于武汉大学细胞保藏中心。人抑制性RANKL单克隆抗体MAB6262,MAB6261(用于Western blotting)和rhRANKL购于R&D公司。TRAP染色试剂盒购于Sigma公司。高糖DMEM培养基购买至GIBCO公司。Random Primer、反转录酶、Rnaisn、dNTP mix、5 × reaction buffer购于Fermentas公司。PCR引物由上海生工生物工程公司合成。Platinum PCR Supermix购于Invitrogen公司。
2.工作液的配制:MAB6262、MAB6261干粉500μg用 1ml无菌PBS溶解,配成浓度为500μg/ml,分装后 -80℃储存。rhRANKL蛋白干粉10μg用0.2ml无菌PBS溶解,配成浓度为50μg/ml,加入0.1%人白蛋白保持其活性,分装后-80℃储存。
3.细胞培养:RAW264.7、RPMI8226 与 MG -63 细胞用10%FCS-DMEM培养基培养,培养条件为37℃,5%CO2,2~4天换液传代。盼蓝拒染试验检测活细胞率均在95%以上。
4.条件培养液收集:当RPMI8226和MG-63细胞株处于对数生长期时,以1×105/ml密度传代接至25cm2细胞培养瓶内,培养2天后将细胞悬液或上清液移至离心管中,离心力200g,离心5min后,取上清液,离心力500~600g,离心10min完全去除细胞后,收集条件培养液,-80℃冻存备用。
5.TRAP染色:根据试剂盒使用说明书的步骤进行。RAW264.7细胞以1.5×104/孔接种于6孔板,培养过夜后更换不同条件培养液(100ng/ml rhRANKL、30%MG-63细胞条件培养液、30%RPMI8226细胞条件培养液以及 1μg/ml RANKLmAb干预组),第7天TRAP染色,细胞用4%多聚甲醛固定10min后,加染色液,37℃避光水浴90min后,双蒸水洗3次,干燥后用中性树脂封固,光镜下计数(放大100倍)各组每孔中TRAP阳性多核破骨细胞(≥3个核)的数量,并摄片记录。
6.RT-PCR 检测:每106~107RPMI8226、MG -63细胞或每孔加入1.0ml Trizol混匀,以一步法抽提总RNA,紫外分光光度法检测RNA浓度和纯度,各组OD260/OD280比值(>1.8)。反转录体系含 RNA 1μg,dNTP 2.0μl,M -Mulv 反转录酶 1μl,引物 1μl,以 DEPC 水补充至 20μl,42℃,60min,70℃,10min完成反转录反应。RT-PCR反应体系为15μl。PCR产物经2%琼脂糖凝胶电泳,扫描条带后用Quantity One软件分析测定各扩增带A值(吸光度)。用目的条带吸光度与内参(β-actin)条带吸光度之比表示组织目的基因mRNA的含量,重复实验3次。各反应条件如表1。
7.Western blotting法检测:RPMI8226和MG-63细胞取对数生长期时传代,以1×105/ml密度接种于25cm2的培养瓶中,培养3天后分别通过离心或细胞刮刀获取细胞,提取总蛋白。将20μl蛋白经12%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离后,转移至PVDF膜,于摇床上封闭1.5h,分别加入鼠抗人RANKL单克隆抗体(MAB6261)和兔抗人β-actin单克隆抗体,4℃过夜,TBST充分漂洗。加入辣根过氧化物酶连接的羊抗鼠IgG室温轻摇1.5h,同上漂洗,与ECL化学发光试剂反应,常规方法显色、定影。
结 果
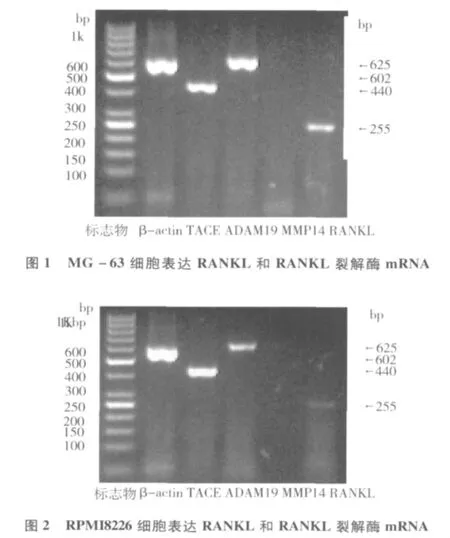
1.RANKL和mRANKL裂解酶(TACE、ADAM19)mRNA表达:本试验以能表达RANKL的MG-63细胞为阳性对照[10],发现 RPMI8226细胞能表达RANKL mRNA(255bp)和两种RANKL裂解酶:TACE mRNA(440bp)和 ADAM19 mRNA(625bp),而MMP14两种细胞均未检测到(图1、图2)。
2.Western blotting法检测RANKL表达:本试验证实 RPMI8226细胞表达 mRANKL(跨膜型)和sRANKL(可溶型)蛋白(图3)。
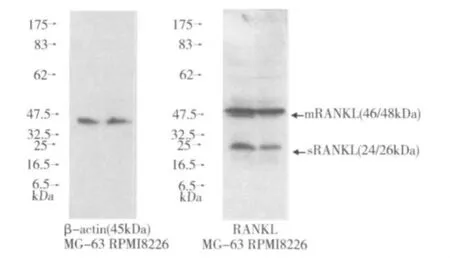
图3 Western blotting法检测RPMI8226细胞表达RANKL蛋白
3.TRAP染色观察 RAW264.7细胞形态:TRAP染色观察不同实验组中RAW264.7细胞培养7天的变化。无诱导的RAW264.7细胞胞体较小,椭圆形,或梭形,大部分细胞呈TRAP阴性单核细胞,少数为TRAP阳性的单核或多核细胞。加条件培养液或重组RANKL蛋白的RAW264.7细胞中出现成熟破骨细胞明显增多,胞体较大,形态不规则,呈油煎蛋形或漏斗形等,几个到几十个不等的细胞核(≥3个),核圆形,大小较一致,互相拥挤或重叠,细胞边缘见伪足样突起,胞质呈空泡状,胞质TRAP酶活性部位呈玫瑰红色,细胞核为阴性,即为TRAP阳性多核成熟破骨细胞(图4)。
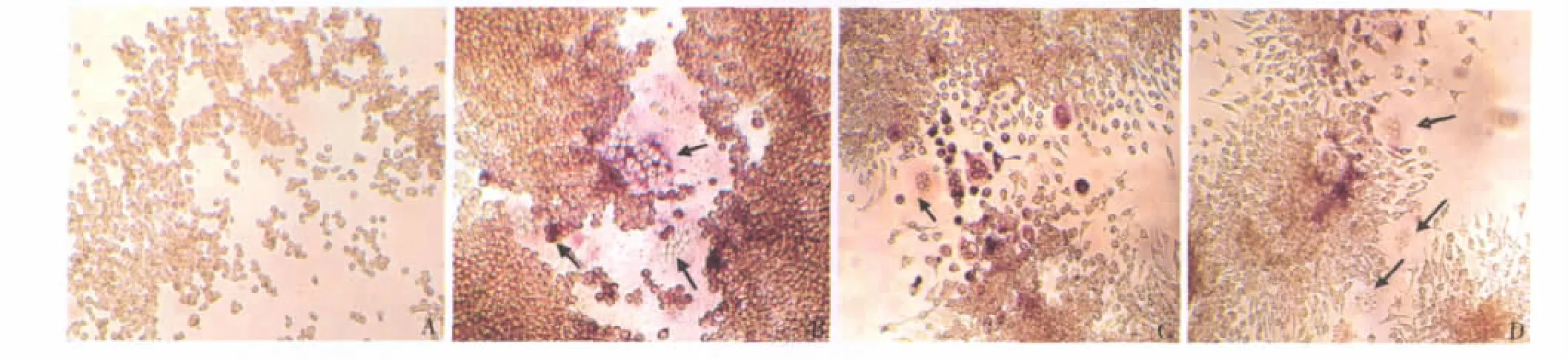
图4 RAW264.7细胞株TRAP染色形态图A.空白组(×100);B.100ng/ml rhRANKL组(×100);C.30%RPMI8226条件培养液组(×100);D.30%MG-63条件培养液组(×100)
4.TRAP阳性的多核破骨细胞计数:(1)100ng/ml rhRANKL、30%RPMI8226细胞与30%MG-63细胞条件培养液对RAW264.7细胞的诱导分化作用:此3组培养液诱导的TRAP阳性多核破骨细胞数和空白组比较有显著差别(p<0.01)。100ng/ml rhRANKL诱导分化作用比其他两诱导组明显(p<0.01)(表 2)。(2)1μg/ml RANKL mAb抑制 RPMI8226细胞条件培养液与rhRANKL的诱导分化作用:1μg/ml RANKL mAb抑制30%RPMI8226条件培养液或100ng/ml rhRANKL诱导的TRAP阳性多核破骨细胞数明显低于不加抗体的诱导组,p<0.01。1μg/ml RANKL mAb阻断30%RPMI8226条件培养液组与空白组无差别;而1μg/ml RANKL mAb阻断100ng/mL rhRANKL组相比空白组有统计学意义,p<0.05(表 3)。
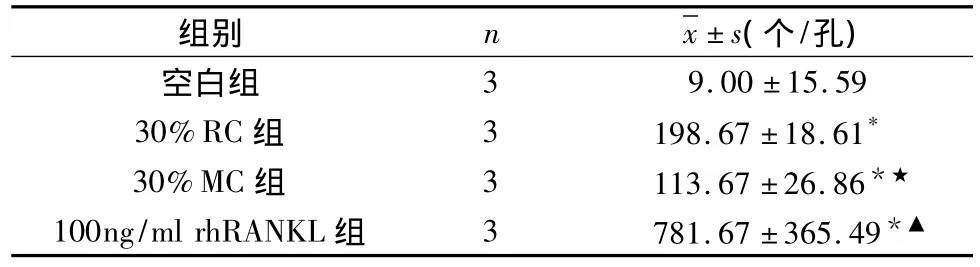
表2 rhRANKL、RPMI8226与MG-63细胞条件培养液诱导RAW264.7细胞分化为TRAP阳性多核破骨细胞
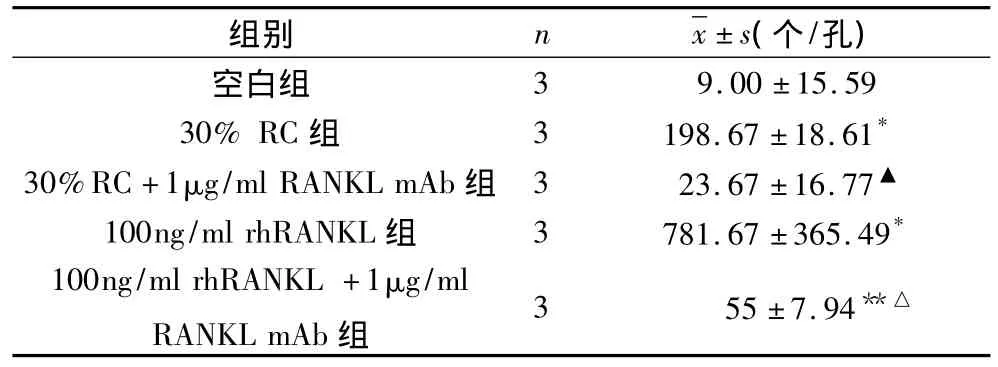
表3 1μg/ml RANKL mAb抑制RPMI8226细胞株条件培养液与rhRANKL的诱导分化作用
5.破骨细胞表型基因TRAPmRNA表达:加30%MG-63细胞条件培养液、30%RPMI8226细胞条件培养液或 100ng/ml rhRANKL的 RAW264.7细胞TRAP基因表达量明显高于空白组,p<0.01。30%RPMI8226细胞条件培养液组比30%RPMI8226细胞株条件培养液+1μg/ml RANKL mAb组TRAP表达量高,P <0.05(表4与图5)。
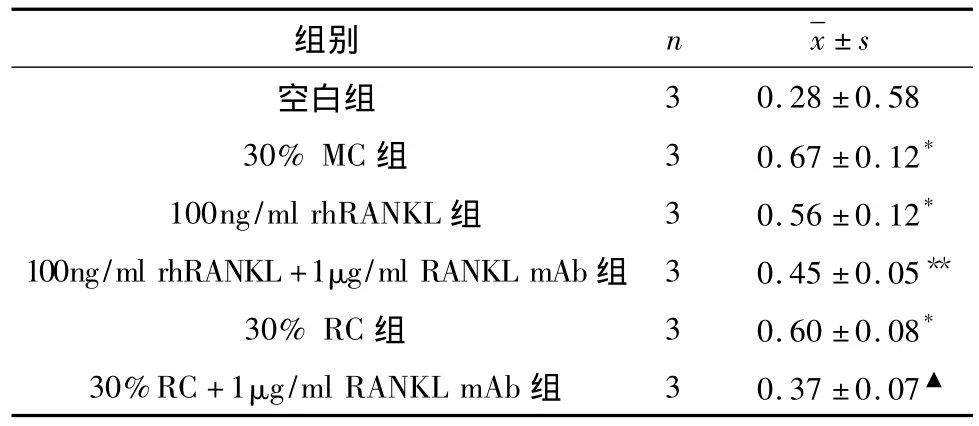
表4 各试验组TRAP mRNA表达
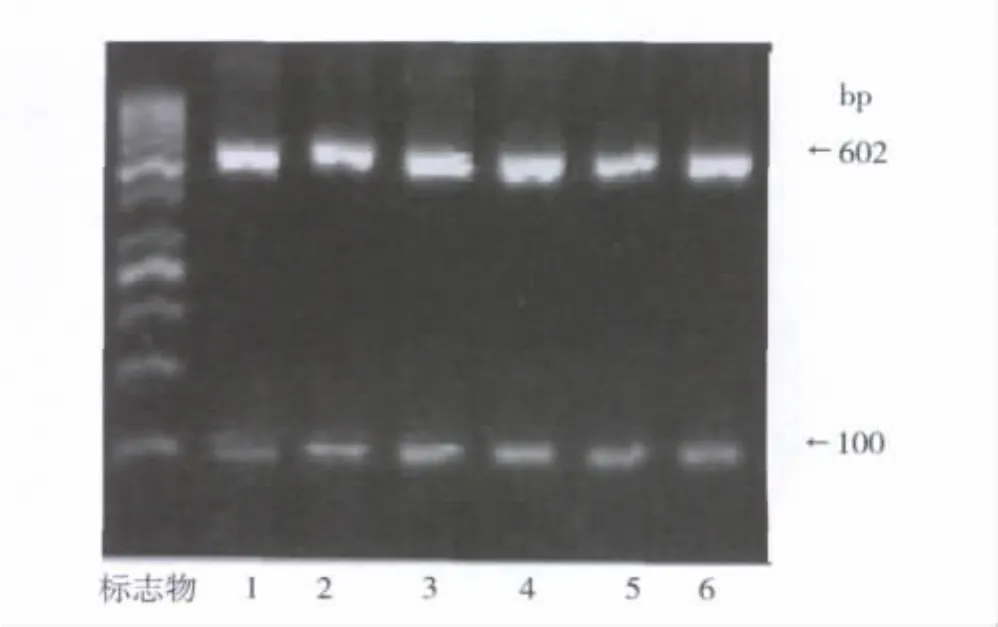
图5 各试验组诱导RAW264.7细胞株表型基因TRAP的表达
讨 论
RANKL/RANK/OPG系统在MBD的破骨细胞分化和功能调节中起举足轻重的作用。但目前国内外对骨髓瘤细胞本身是否表达RANKL仍未存在争议。
Sezer等[2]利用流式细胞术,免疫细胞化学染色和免疫印迹法发现6种人MM细胞株如RPMI8226,U266等和6例MBD患者的MM细胞都表达RANKL。Heider等[3]以流式细胞仪分析正常浆细胞发现胞膜上RANKL不表达或弱表达,但伴骨质破坏患者的MM细胞胞膜RANKL表达显著高于正常人和无骨质破坏患者,差异有统计学意义。Croucher等[4]用 RT-PCR和流式细胞术证明了纯化的5T2MM鼠骨髓瘤细胞中RANKL mRNA和蛋白的表达。Farrugia等[5]用流式细胞术和RT-PCR法分析高度纯化的人MM细胞表达RANKL蛋白和mRNA。
然而仍有许多专家持反对意见,认为MM细胞不自主分泌RANKL,而是诱导骨髓微环境中其他细胞分泌RANKL,促进破骨细胞与MM细胞的生长、存活和分化。Giuliani等[6]利用免疫印迹法和RT-PCR发现10种人MM细胞株如U266等,和26例MM患者的MM细胞均不表达 RANKL,仅产生极少量的OPG。在细胞共同培养中,人MM细胞促进人骨髓前成骨细胞或基质细胞上调RANKL mRNA和蛋白的表达,明显下调OPG生成,这一作用依赖于细胞间的直接接触。同样,Pearse等[7]检测5种骨髓瘤细胞株也未发现RANKL蛋白和mRNA的表达。
基于上述研究,本试验着眼于MM细胞自身是否表达RANKL以及其功能展开深入研究。MBD研究迄今为止,已有多种分离MM细胞的方法,但常混杂其他细胞,所以选取经典的人MM细胞株RPMI8226作为研究对象。我们采用免疫印迹法证明了RPMI8226细胞能表达 mRANKL蛋白(46/48kDa)和sRANKL 蛋白(24/26kDa),这与 Sezer等[2]的研究结果相同。而且 RPMI8226细胞表达的 mRANKL和sRANKL分子质量大小与Lacey等[8]的研究结果相一致。RANKL在体内有mRANKL和sRANKL两种形式,sRANKL分为原发分泌型和蛋白酶裂解膜蛋白型。目前已知的RANKL裂解酶主要有3种:肿瘤坏死因子α转化酶(TACE),解聚素-基质金属蛋白酶19(ADAM19)和Ⅰ型膜型基质金属蛋白酶(MMP14)[9,10]。本试验结果发现 RPMI8226 细胞表达2种RANKL裂解酶TACE和ADAM19 mRNA。证明了RPMI8226细胞通过自主分泌或RANKL裂解酶TACE、ADAM19酶解作用产生sRANKL。研究表明不论mRANKL,还是sRANKL均有共同的羧基末端活性受体结合域,因此都能与相同的受体结合,发挥诱导破骨细胞分化成熟的生物学作用,并且可与 OPG结合,失去生物学活性。
本研究发现RPMI8226细胞、MG-63细胞条件培养液与rhRANKL(编码mRANKL胞外段136-317位氨基酸,与 sRANKL序列相似)均能明显诱导RAW264.7细胞分化为TRAP阳性的多核破骨细胞。说明RPMI8226细胞条件培养液中存在能诱导RAW264.7细胞分化成熟的物质。这与Lai等报道的人骨髓瘤细胞株NCI-H929,U266的条件培养液能诱导人骨髓单个核细胞分化为TRAP阳性的多核破骨细胞一致。同时1μg/ml人抑制性RANKL单克隆抗体能显著阻断30%RPMI8226细胞条件培养液与100ng/ml rhRANKL诱导的RAW264.7细胞株分化成熟作用,间接证明了RPMI8226细胞条件培养液中起诱导作用的重要成分为sRANKL。
同时本试验通过RT-PCR显示rhRANKL、MG-63细胞与 RPMI8226细胞条件培养液能诱导RAW264.7 细胞上调 TRAP mRNA。1μg/ml人抑制性RANKL单克隆抗体能抑制30%RPMI8226细胞条件培养液的诱导分化作用使TRAP mRNA表达与空白组相近,并与TRAP染色实验的结果一致。1μg/ml人抑制性 RANKL单克隆抗体阻断100ng/ml rhRANKL诱导的TRAP mRNA表达高于空白组,和TRAP染色实验的结果一致,这可能与100ng/ml rhRANKL未被单克隆抗体完全中和有关。
目前我们证实了骨髓瘤RPMI8226细胞能表达RANKL,且其细胞培养液所含 sRANKL具有促使RAW264.7细胞分化为成熟破骨细胞的生物活性。这一发现将为探索骨髓瘤骨病的分子机制以及寻找治疗新靶点,提供实验和理论基础。
1 Roodman GD.Pathogenesis of myeloma bone disease[J].Leukemia,2009,23(3):435 -441
2 Sezer O,Heider U,Zavrski I,et al.Immunocytochemistry reveals RANKL expression of myeloma cells[J].Blood,2002,99(12):4646-4647
3 Giuliani N,Bataille R,Mancini C,et al.Myeloma cells induce imbalance in the osteoprotegerin/osteoprotegerin ligand system in the human bone marrow environment[J].Blood,2001,98(13):3527 -3533
4 Croucher P I,Shipman CM,Lippitt J,et al.Osteoprotegerin inhibits the development of osteolytic bone disease in multiple myeloma[J].Blood,2001,98(13):3534-3540
5 Farrugia AN,Atkins GJ,To LB,et al.Receptor activator of nuclear factor- κB ligand expression by human myeloma cells mediates osteoclast formation in vitro and correlates with bone destruction in vivo[J].Cancer Res,2003,63(17):5438 - 5445
6 Nicola Giuliani,Simona Colla,Francesca Morandi,et al.Lack of receptor activator of nuclear factor-kB ligand(RANKL)expression and functional production by human multiple myeloma cells[J].Haematologica,2005,90(2):275 -278
7 Pearse RN,Sordillo EM,Yaccoby S,et al.Multiple myeloma disrupts the TRANCE/osteoprotegerin cytokine axis to trigger bone destruction and promote tumor progression[J].Proc Natl Acad Sci USA,2001,98(20):11581 -11586
8 D.L.Lacey,E.Timms,H.L.Tan,et al.Osteoprotegerin Ligand Is a Cytokine that Regulates Osteoclast Differentiation and Activation[J].Cell,1998(93):165 - 176
9 Chesneau V,Becherer JD,Zheng Y,et al.Catalytic propertiesof ADAM19[J].J Biol Chem,2003,278(25):22331 -22340
10 Atsuhiko Hikita,Ikuo Yana,Hidetoshi Wakeyama,et al.Negative Regulation of Osteoclastogenesis by Ectodomain Shedding of Receptor Activator of NF - κB Ligand[J].The Journal of Biological Chemistry,2006,281(48):36846 -36855

