Caspase-3、ADAM10在肺癌中表达与生物学意义
景瑞军,李勇强
(西安医学院第二附属医院,陕西 西安 710038)
20世纪50年代开始,吸烟等种种因素导致了我国肺癌发病率和病死率的升高,肺癌的防治成为一项重大问题[1],但目前肿瘤的生物学行为无明确指标。既往研究显示,细胞外信号通路、线粒体信号通路、内质网信号通路和高尔基体信号通路的共同终末都是 Caspase 酶[2]。整合素-金属蛋白酶(ADAMs)是近年来发现的一类与细胞膜结合的糖蛋白家族,能参与细胞信号传导等过程,也可能参与了人类肿瘤细胞转移的病理过程[3,4]。我们为此采用免疫组化方法研究Caspase-3、ADAM10表达与肺癌临床病理参数的相关性,为判断肺癌的特点与预后提供依据,报告如下。
1 资料与方法
1.1 一般资料
收集我院病理科2004年2月-2011年7月间手术切除的肺癌石蜡包埋标本80例,男60例,女20例。入选标准:患者术前均未行任何治疗,符合世界卫生组织(WHO)中肺癌的诊断标准,同意入选。肺癌类型:腺癌35例,鳞癌35例,小细胞癌10例;年龄33~78岁,平均(60.2±9.2)岁;按组织学分级:高分化20例,中分化35例,低分化25例;淋巴结转移50例,无淋巴结转移30例。同期取正常肺组织20例,包括13例尸检的正常肺组织,5例手术切除炎性假瘤病例的正常肺组织和2例肺大泡的正常肺组织。
1.2 方法
1.2.1 主要试剂
本文使用的兔抗人多克隆抗体ADAM10和Caspase-3购自USBio公司,EDTA抗原修复液购自福州迈新公司,DAB显色剂购自DAKO公司,观察所用显微镜为同本Olympus产品,型号为BX-50。丙酮和无水乙醇为天津市化学试剂公司产品。
1.2.2 染色方法
所有标本均经10%福尔马林固定,石蜡包埋,切片常规脱蜡至水;3%过氧化氢微波炉低档孵育2 min,蒸馏水浸泡;将切片放入盛有EDTA抗原修复液的高压锅中,喷气后1~2min,高压锅离开热源,冷却至室温,取出切片;蒸馏水浸泡,PBS液(pH 7.4)浸泡;滴加1∶75的一抗4℃冰箱过夜,PBS液浸;滴加生物素标记的二抗工作液,室温下湿盒中孵育10min,PBS液浸泡;DAB显色剂显色,显微镜下观察,适时终止反应。
1.3 判定标准
着色细胞比例1/3以下为1分,1/3~2/3为2分,2/3以上为3分。着色程度,无着色0分,浅黄色1分,棕黄色2分,棕褐色3分。然后根据两者积分的乘积来判断阳性等级:0分为(-),1~2分为(+),3~4分为(++),4分以上为(+++);其中,(+)为弱阳性,(++~+++)为强阳性。
1.4 统计学方法
采用SPSS 18.0统计软件包进行数据分析。ADAM10和Caspase-3在各组中表达阳性率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 ADAM10和 Caspase-3的表达情况
ADAM10和Caspase-3阳性表达呈棕黄色与颗粒状,主要定位于细胞浆中。ADAM10和Caspase-3在正常肺组织和肺癌组织的表达阳性率分别为100%、50%,见表1。
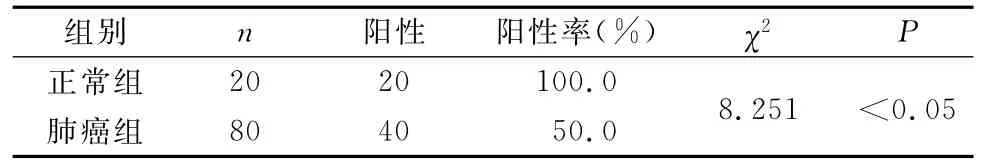
表1 Caspase-3在肺癌进展组织芯片中的表达(n)
2.2 ADAM10和Caspase-3的表达与肺癌临床病理参数的关系
调查显示,ADAM10和Caspase-3在腺癌中的表达水平较鳞癌和小细胞癌低,同时在转移的肺癌表达水平也比较低。
3 讨论
近年来,从我国城乡前10位恶性肿瘤构成来看,肺癌已代替肝癌成为我国首位恶性肿瘤死亡原因,占全部恶性肿瘤死亡的22.7%,且发病率和病死率仍在继续迅速上升。根据卫生部全国肿瘤防治办公室提供的资料显示,2005年~2011年间,中国肺癌的发病数估计增加28万人,目前我国肺癌发病率每年增长26.9%,如不及时采取有效控制措施,预计到2025年,我国肺癌患者将达到100万,成为世界第1肺癌大国[5-7]。大量的流行病学研究证明了吸烟与肺癌发生的密切关系,吸烟使肺癌的发病率和病死率持续上升。在因肺癌死亡的患者中,90%是由吸烟,包括被动吸烟引起的。同时肺癌的发生与个体基因易感性也有关。

表2 ADAM10和Caspase-3的表达与肺癌临床病理参数的关系(n)
Caspase酶是1个氨基酸序列和空间结构非常相似的蛋白质家族,它有3个结构域,是控制细胞凋亡的关键组件,平常它们以酶原的形式存在于细胞内,当细胞接到凋亡信号后,Caspase家族成员依次被激活,以多种方式“拆解”细胞,其中1种方式是激活CAD,使CAD进入细胞核内,像剪刀一样剪断肿瘤细胞的DNA,导致细胞凋亡,因此Caspase酶也被形象地称为肿瘤细胞的“剪刀酶”[8,9]。有研究发现,Caspase-3在良性前列腺增生表达明显高于前列腺癌细胞[10]。还有研究应用免疫组织化学发现,Caspase-3在肺癌的表达与有无淋巴结转移、病理分期、分化程度有关[11,12]。
ADAM10是一种功能性的分泌酶,ADAM10最初从牛脑髓鞘膜中分离纯化而来,并被称为哺乳动物整合素金属蛋白酶。体外实验发现ADAM10是细胞质髓鞘碱性蛋白酶,由于ADAM10广泛参与细胞功能,许多疾病,如癌症或AD都将其列为有潜力的靶点。ADAM10可以切割肿瘤相关底物,并与前列腺癌或乳腺癌的进程相关,它还与人结肠癌细胞迁移有关。因此,抑制ADAM10在一定条件下对于肿瘤治疗可能是有帮助的。相反,在脑内ADAM10过表达或激活对于治疗神经退行性疾病,也许是有利的。本文结果显示,ADAM10和Caspase-3阳性表达呈棕黄色与颗粒状,主要定位于细胞浆中。ADAM10和Caspase-3在正常肺组织和肺癌组织的表达阳性率分别为100%和50.0%。经过调查,ADAM10和Caspase-3在腺癌中的表达水平较鳞癌和小细胞癌低,同时在转移的肺癌表达水平也比较低。
总之,Caspase-3、ADAM10在肺癌中表达都受到抑制,阳性率降低,可能与患者肿瘤的病理特点与转移情况有关,可作为预测肺癌发生发展的指标之一。
[1]郑春晨,陈愉生,陈小岩,等.Livin、Caspase-3和Bel-2在非小细胞肺癌的表达及生存分析[J].中国呼吸与危重监护杂志,2009,8(3):224-228.
[2]姚峰,陈倩,陶琳,等.Caspase-3基因在肺癌中的表达及其与bcl-2和Bax蛋白表达的关系[J].肿瘤防治杂志,2009,11(1):4-6.
[3]徐进,文继舫,郑晖,等.Caspase-3蛋白在胃癌及非典型增生中的表达及其与细胞凋亡的关系[J].湖南医科大学学报,2002,27(2):181-182.
[4]陈余清,李殿明,蔡映云,等.纤维支气管镜活检病变组织标本和痰标本Swruvuin基因的检测对肺癌的诊断价值[J].中华结核和呼吸杂志,2005,28(4):225-229.
[5]李艳,王新允,郑海燕,等.Survivin和PTEN在肺癌中的表达及意义[J].中国肿瘤临床与康复,2011,12(2):120-123.
[6]王筱冰,张小翠,夏妙红,等.Caspase的活化机制[J].现代生物医学进展,2006,6(3):53-55.
[7]王仁忠,张能,余华荣.Caspase与糖尿病[J].国际内分泌代谢杂志,2006,26(4):267-269.
[8]Brambilla E,Brambilla C.p53and lung cancer[J].Pathol Biol(Paris),1997,45(10):852-863.
[9]Jacobson MD,Wei l M,Raff MC.Programmed cell death in animal development[J].Cell,1997,88(3):347-354.
[10]Lamkanfi M,Declercq W,Kalai M,et al.Alice in Caspase land-A phylogenetic analysis of Caspase from worm to man[J].Cell Death Differ,2002,9(4):358-361.
[11]Farina F,Cappello F,Todaro M,et al.Involvement of caspase-3and GD3ganglioside in ceramide-induced apoptosis in Farber disease[J].J Histochem Cytochem,2000,48(1):57-62.
[12]Nomura J, Matsumoto K,Iguchi-Ariga SM,et al.Mitochondria-independent induction of Fas-mediated apoptosisby MSSP[J].Oncol Rep,2005,14(5):1305-1309.

