芝麻油中芝麻素提取与纯化工艺研究
何晓梅,朱 珣
(1.皖西学院 生物与制药工程学院,安徽 六安237012;2.安徽省植物生物技术实训中心,安徽 六安237012)
研究表明,芝麻油中含有芝麻素(sesamin)、芝麻林素(sesamolin)、芝麻酚(sesamol)等木脂素类物质,这些物质的存在大大提高了芝麻油的稳定性,同时也是芝麻油具有生理保健功能的物质基础。芝麻素作为一种具有生物活性的天然物质正日益受到人们的重视,其在保健品、食品以及医药卫生等领域的应用越来越广泛。芝麻素在生物体内呈现较强的抗氧化作用,具有多种生理活性功能。临床研究发现,它具有抗高血压及心血管疾病、保肝、抗氧化、降低胆固醇、抗癌等功效[1]。目前,许多植物化学家将芝麻素列入抗癌症类功效因子进行研究[2]。
已知芝麻素的分离方法主要有减压蒸馏法、吸附色谱法及萃取法[3]。前两种方法成本高,费用大,而且制备芝麻素后的原料成为工业废渣,造成资源浪费和环境污染。本研究以芝麻油为原料,以乙醇为提取溶剂,探讨一种提取和纯化芝麻素的有效方法,旨在不影响芝麻油理化性质的同时,开发高附加值的芝麻素产品。
1 材料与方法
1.1 主要原料和试剂
芝麻油(产自六安市金安区马头镇);芝麻素标准品购自Sigma公司;甲醇(色谱纯);乙醇、石油醚和其他试剂均为分析纯。
1.2 主要仪器设备
恒温震荡器,超低温冰箱,旋转蒸发器,循环水式真空泵,常温冰箱,真空干燥箱,RD-1型熔点测试仪,电子天平,TU-1901双光束紫外可见分光光度计,超声波清洗器,waters高效液相色谱仪。
1.3 试验方法
1.3.1 芝麻素的浸提工艺
取一定量充分摇匀的芝麻油,按一定料液比(g/mL)加入无水乙醇置于恒温震荡器中在一定温度下避光震荡,反应结束后静置分层,把乙醇提取物于-40℃下放置12h,除去底层凝固物[4],取上层清液,旋转蒸发至无乙醇馏出物,得芝麻素富集物。加入一定量洗涤溶剂石油醚,45℃密闭容器中震荡30 min,置于4℃冰箱结晶,过滤、真空干燥、称重,得芝麻素粗品备用。
1.3.2 芝麻素提取的单因素试验
1.3.2.1 浸提次数单因素试验
分别准确称取200g芝麻油于3个锥形瓶中,按料液比1∶3加入无水乙醇,于50℃密闭震荡2h,静置分层2h,取上清液进行后续试验,取下层重复上述操作,重复4次。
1.3.2.2 料液比单因素试验
分别准确称取200g芝麻油于5组锥形瓶中(每组3个),按不同料液比加入无水乙醇,于50℃密闭震荡2h,静置分层2h,取上清液进行后续试验,取下层重复上述操作,重复3次。
1.3.2.3 提取时间单因素试验
分别准确称取200g芝麻油于5组锥形瓶中(每组3个),按料液比1∶5加入无水乙醇,于50℃密闭震荡不同时间,静置分层2h,取上清液进行后续试验,取下层重复上述操作,重复3次。
1.3.2.4 提取温度单因素试验
分别准确称取200g芝麻油于5组锥形瓶中(每组3个),按料液比1∶5加入无水乙醇,于不同温度密闭震荡3h,静置分层2h,取上清液进行后续试验,取下层重复上述操作,重复3次。
1.3.3 芝麻素提取的正交试验
在单因素试验的基础上,选择料液比(A)、提取时间(B)、提取温度(C)为考察因素,以芝麻素总提取率为考察指标,采用L9(34)正交试验设计(表1),进行3因素3水平试验,确定芝麻素浸提的最佳工艺条件。

表1 正交试验因素水平表
1.3.4 芝麻素的纯化[5]
将芝麻素粗品加无水乙醇,水浴加热促进溶解后,置于4℃冰箱中进行结晶,过滤,再加无水乙醇溶解并于4℃冰箱结晶,重复3次,真空干燥(<45℃)得到芝麻素晶体。
1.3.5 芝麻素含量测定
芝麻素在287nm有最大特征吸收峰[6],因此本实验选择287nm为测定波长。准确称取5mg芝麻素标准品,置于25mL棕色容量瓶中,以甲醇溶解定容至25mL,配制成200μg/mL的标准溶液。然后用甲醇分别稀释成10、20、30、40、60和80μg/mL的标准溶液。以无水甲醇为空白,在287nm处测吸光度,回归分析得到芝麻素浓度和吸光度的关系式:y=0.0236x-0.0061,R2=0.9998。表明芝麻素浓度在10~80 μg/mL范围内线性良好。将芝麻素粗品和芝麻素结晶用甲醇溶解后,根据标样的测定方法测定其吸光度,然后代入标准曲线获得样品中芝麻素的含量。
芝麻素得率(g/100g)=样品中芝麻素含量(g)/原料质量(100g)
1.3.6 芝麻素提取物纯化样品的检测
1.3.6.1 芝麻素熔点测定
按照RD-1型熔点测试仪的使用操作规程进行操作。将装有3mm高芝麻素样品的毛细管插入毛细管支架上,放入传温液体内并利用支架上的磁铁吸牢。按一下启动键,仪器处于测试状态,此时通过传温液杯前放置的放大镜观察样品的熔化过程,并记下初熔温度和终熔温度。
1.3.6.2 HPLC法分析纯度
以纯化的芝麻素样品进行HPLC分析检测,色谱条件:流动相,甲醇+水(V+V)=80+20,流速1.0mL/min,进样量20μL,柱温为室温,检测器波长287nm。
2 结果与分析
2.1 芝麻素的浸提单因素试验
2.1.1 提取次数对芝麻素提取率的影响
如表2所示,经过4次浸提,芝麻素总提取率达到0.243g/100g,但第4次浸提芝麻素提取率较第3次增加较少,考虑成本和环境因素,确定后续各水平研究浸提次数为3次。

表2 提取次数对芝麻素提取率的影响
2.1.2 料液比对芝麻素提取率的影响
料液比在1∶5时,芝麻素提取率接近最大值,再增加料液比,提取率没有明显的提高(图1)。考虑溶剂消耗成本和芝麻素提取率,选择最佳料液比为1∶5。
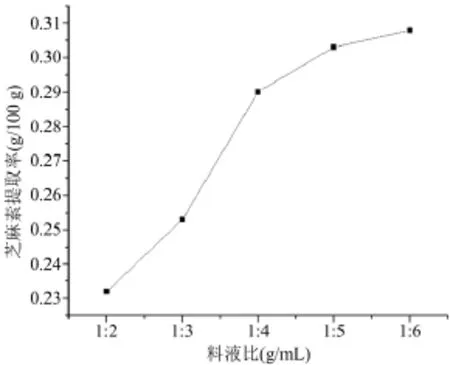
图1 料液比对芝麻素提取率的影响
2.1.3 提取时间对芝麻素提取率的影响
由图2可知,随着浸提时间的延长,芝麻素提取率逐渐增加,但考虑到效率因素,浸提时间以3h为宜。
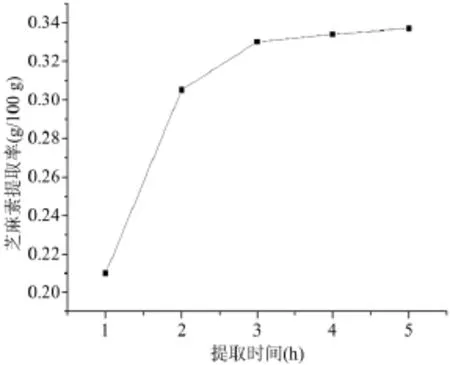
图2 提取时间对芝麻素提取率的影响
2.1.4 提取温度对芝麻素提取率的影响
随着提取温度的提高,芝麻素提取率逐渐增加,温度从45℃提高到50℃,芝麻素提取率增加显著,但当温度高于60℃,芝麻素提取率有所下降(图3),可能是芝麻素在高温下易于氧化降解,确定浸提温度以50℃为宜。
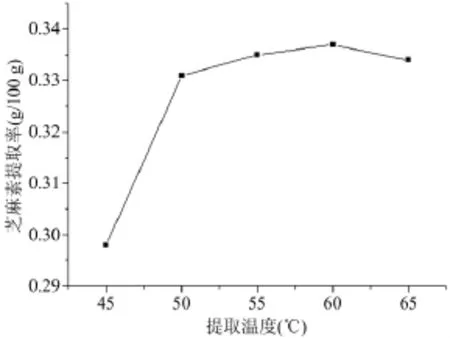
图3 提取温度对芝麻素提取率的影响
2.2 正交试验确定芝麻素浸提的最优工艺条件
由表3可知,各试验因素及因素水平对芝麻素提取率大小的影响不完全相同,在所选因素水平下,3种因素的最佳组合为A3B2C1,即料液比1∶5,浸提时间3h,温度50℃,浸提3次,芝麻素提取率最高,芝麻素提取率平均值为0.336g/100g芝麻油。根据极差R值可知,各因素对芝麻素提取率的影响顺序为:B>A>C,即提取时间影响最大,其次是料液比。
2.3 芝麻素提取物纯化样品的检测
2.3.1 熔点的测定
由于视觉判断误差,重复测定3次,芝麻素的初融温度取平均值为120.5℃,终熔温度取平均值为121.7℃。与有关文献报道的120~122℃相接近。
2.3.2 芝麻素纯度测定
图4为芝麻素提纯物HPLC图,图中10.818处的峰为芝麻素色谱峰,其相对含量达到95.2%,与文献[8]报道的相接近。
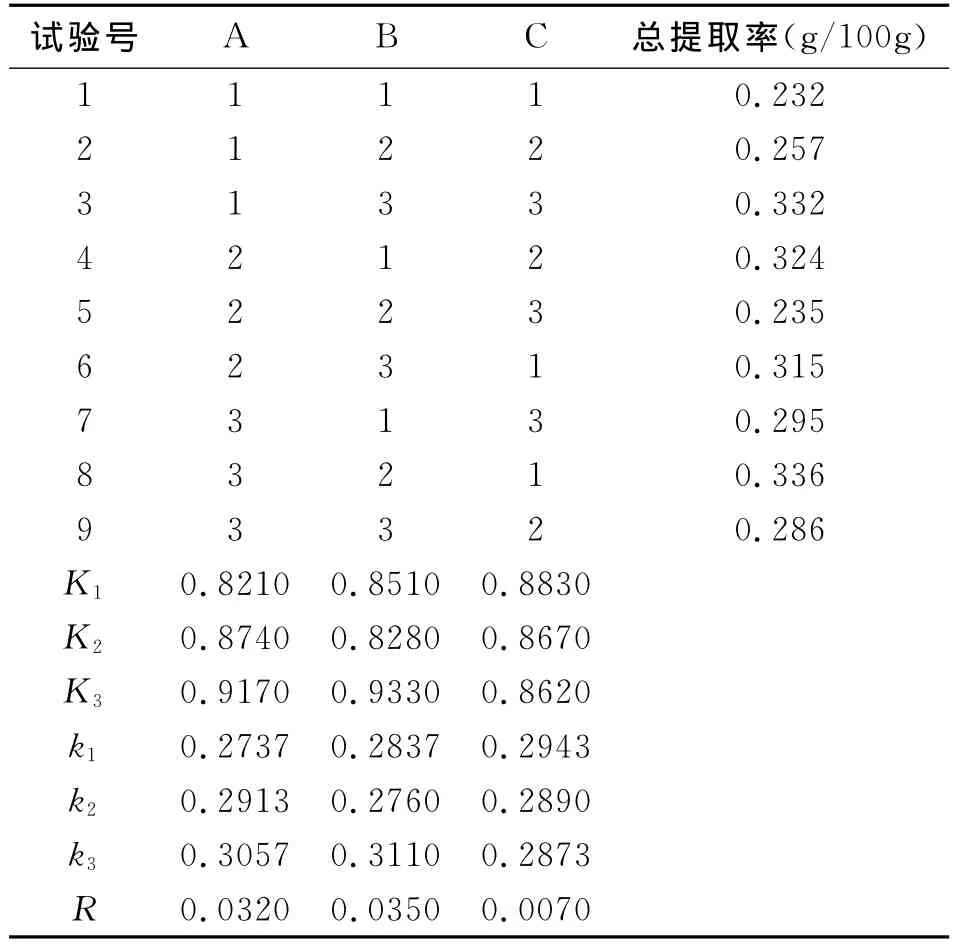
表3 正交试验结果分析
3 结论
本研究通过单因素试验和正交试验确定了芝麻油中芝麻素分离提取的优化条件,即料液比1∶5、浸提时间3h、温度50℃、浸提3次,芝麻素提取率最高,达到0.336g/100g芝麻油。芝麻素粗品经结晶纯化,产品熔点为120.5~121.7℃,HPLC分析芝麻素相对含量达95.2%。
本研究探索出一种从芝麻油中提纯芝麻素的有效方法,为生物活性物质芝麻素在食品、生物医药领域的开发应用奠定了基础。
[1]沈旭丽.芝麻的营养成分及保健价值[J].中国食物与营养,2006,(7):51-52.
[2]刘元法,王兴国,金青哲.芝麻油中芝麻素提取物的纯化与检测[J].中国油脂,2004,29(3):48-50.
[3]戴洪平,王兴国,余春涛.芝麻素的研究及开发[J].中国油脂,2003,28(6):52-54.
[4]黄纪念.芝麻油中芝麻素的分离方法[P].中国专利:200910064426.2.2010(17):2.
[5]金青哲,刘元法,王兴国,等.芝麻油脚中芝麻素的提取与纯化研究[J].粮油加工与食品机械,2005,(5):52-55.
[6]冯志勇,谷克仁.紫外光谱法测定芝麻素与芝麻林素含量[J].中国粮油学报,2006,21(3):296-300.
[7]魏安池,杨玲玲,代红丽,等.用响应面法优化芝麻饼中木脂素的提取工艺[J].河南工业大学学报(自然科学版),2011,32(4):11-15.
[8]陈伟强,李树田.芝麻饼粕中芝麻素的分离提取与HPLC分析[J].食品研究与开发,2010,31(6):153-155.

