RGMa在创伤后精神应激障碍大鼠内侧前额皮质的表达变化
温莉莉,韩芳,石玉秀
(中国医科大学基础医学院组织学与胚胎学教研室,沈阳110001)
创伤后精神应激障碍(post-traumatic stress disorder,PTSD)是由异常精神心理创伤所致的以再度体验创伤并伴有易激惹情绪和回避行为的临床表现为特征的长期持续性精神障碍。研究表明PTSD患者脑部的海马,杏仁核都有减小,其内有神经细胞的凋亡[1,2],而排斥性导向分子 A(repulsive guidance molecule A,RGMa)是一种新的轴突生长抑制蛋白,在中枢神经生长发育过程中起介导排斥性轴突导向信号和神经管闭合、调控神经细胞的增殖、分化、存活、诱导生长锥塌陷而阻断受损神经再生等作用[3]。大鼠前额皮质(medial prefrontal cortex,mPFC),是认知、记忆和情感的重要脑区[4~5]。mPFC在情绪反应中起重要作用[6],文献报道PTSD脑萎缩可能由神经元细胞凋亡所致[7],从RGMa在PTSD mPFC的表达变化有可能揭示PTSD大鼠mPFC神经元凋亡发生机制。RGMa的激活可破坏生长锥,使轴突回缩、生长抑制[3],研究RGMa在PTSD大鼠的表达变化可能揭示PTSD mPFC缩小的发病机制之一。本研究利用国际认定的PTSD-SPS模型,采用免疫组织化学、免疫印迹方法检测PTSD大鼠mPFC神经元RGMa表达变化,为研究PTSD致细胞凋亡的机理提供实验依据。
1 材料与方法
1.1 实验动物及分组
由中国医科大学实验动物中心提供成年健康雄性Wistar大鼠45只,体质量180~220 g,分笼喂养,自由饮食,实验室内通风良好,室温保持在18~25℃,先将大鼠在实验室条件适应性喂养1周后,将其随机分为对照组、PTSD-SPS组(7 d和14 d组),每组15只。
1.2 PTSD-SPS大鼠模型建立与行为学验证
采用2005年日本文部省召开的“基础和临床研究进展”国际会议确定的关于大鼠PTSD模型-SPS[8]。将大鼠连续进行下述步骤处理:禁锢2 h;后强迫游泳20 min(水深40 cm,水温25℃);休息15 min后乙醚麻醉至意识丧失;无干扰常规喂养直至取材前通过行为学验证确认符合PTSD后取材。
1.3 制备光镜标本
对SPS 7 d、14 d及正常对照组大鼠分别进行心脏灌流固定。步骤如下述:大鼠经2%戊巴比妥腹腔注射麻醉后,暴露心脏,左心室插管,剪开右心耳,先以生理盐水300 mL快速灌冲血道,后以4%多聚甲醛进行灌注固定,取出脑组织,并浸入4%多聚甲醛续固定3 h,然后浸入Holt′s液(用0.01 mol/L PBS配制的40%蔗糖)中至沉瓶底。于恒冷箱切片机(莱卡)行冠状切片,片厚8 μm,用于免疫组化染色。
1.4 RGMa免疫组织化学SABC法染色
冰冻切片经吹干,依次用3%H2O2-dH2O漂洗10 min,PBS(含0.03%Triton X-100) 漂洗10 min×3次,5%BSA封闭20 min后,滴加兔多克隆抗体RGMa(工作浓度为1∶200,Santa Cruz Bio-technology)0.01 mol/L,PBS代替一抗作阴性对照,4 ℃孵育过夜,滴加生物素化羊抗兔IgG37℃,30 min,滴加SABC37℃,20 min,以上各步间均用0.01 mol/L PBS漂洗,之后DAB(武汉博士德公司)显色,常规脱水,透明,中性树胶封片,以PBS液代替一抗作阴性对照,光学显微镜 (OLYMPUS,BX60,Japan) 观察mPFC的RGMa表达,摄片。同倍率下,观察5张连续切片,每张切片随机选取3个视野进行阳性细胞计数。用形态学图像分析系统软件,记录阳性细胞吸光度(absorbance,A),对以上免疫组化显色切片进行半定量分析。
1.5 免疫印迹(Western blot)
脱颈法处死大鼠,冰上快速取出正常对照组及SPS 7 d、14 d组大鼠mPFC,组织经匀浆、超声粉碎后高速低温离心,12000 r/min,取上清;采用考马斯亮蓝法测定蛋白浓度;每例标本提取蛋白50 μg,10%SDS PAGE变性凝胶电泳,浓缩胶90 V、30 min和分离胶110 V、120 min;恒压转移到PVDF膜上,4℃过夜,5%脱脂奶粉封闭90 min;加入兔多克隆多抗体RGMa(工作浓度为1∶200)中孵育,4℃过夜;IgG抗体-HRP多聚体孵育2 h;ECL发光,以目的条带与内参照GAPDH的平均光密度(OD)的比值表示相对表达水平,进行半定量分析。
2 结果
2.1 RGMa免疫组织化学染色
显色结果表明,RGMa在正常对照组和模型组均有表达,且阳性信号表达在神经元和突起内,见图1。分析结果显示,SPS 7 d组和14 d组高于对照组,差异有统计学意义(P<0.05);3组阳性细胞OD值分别是(0.44±0.002)、(0.63±0.015)和(0.51±0.009),SPS 7 d组RGMa的表达增多,SPS14 d组RGMa表达稍有降低,但较对照组仍明显增高,差异有统计学意义(P<0.05),见图2。

2.2 SPS大鼠mPFC组织蛋白提取及免疫印迹法测定RGMa
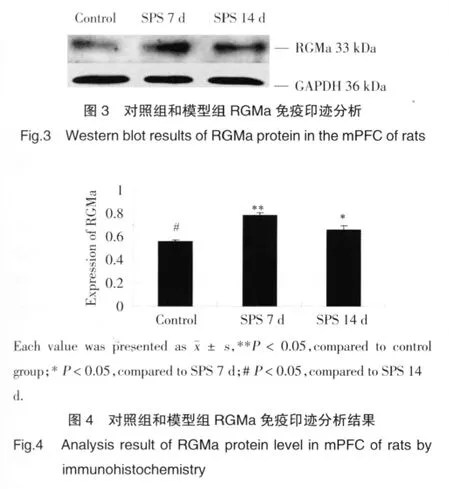
免疫印迹测试显示,在33 kDa处有阳性条带。分析结果表明,对照组的mPFC RGMa有一定表达,SPS 7 d组表达量明显增多,差异具有统计学意义(P<0.05),SPS14 d组表达较7 d组减少,较正常组增多(图3,图 4)。
3 讨论
现代社会压力日趋增大,巨大自然灾害(海啸、地震、洪灾等)近年频发,故此PTSD受到国内外极大关注[9]。PTSD-SPS大鼠模型是2005年日本文部省召开的“基础和临床研究进展”国际会议确定的关于大鼠PTSD模型[8],该模型以环境条件刺激(强迫性游泳)作为应激刺激,SPS大鼠能表现出PTSD相似的临床行为学改变[10],更适于PTSD的研究。目前国外研究发现PTSD患者MRI检查见海马体积缩小、萎缩[11,12]。所以推测记忆的异常可能与海马体积减小有关。杏仁核活跃,PTSD大鼠杏仁核神经细胞树突增多,推测恐怖增强可能与此有关[2,13]。国内外的学者对PTSD的研究主要集中在行为学和内分泌的改变,对细胞通路的研究较少。RGM是分子量为33/35 kDa的排斥导向分子,其家族成员有RGMa、RGMb RGMc,其中 RGMa、在成年大鼠神经元有表达,在脑损伤时表达增强[11]。RGMa的高亲和力受体neogenin主要表达于发育中和成熟的中枢神经系统[14],而RGMa可在创伤条件下与其高亲和力受体结合,通过激活RhoA-ROCK(RhoA-Rhoassociated kinase)而使神经元生长锥崩塌,抑制大脑神经元轴突生长[11,12,15]。因此,RGMa 参与神经元的再生,mPFC在情感反应中起到核心作用。研究RGMa在mPFC的表达对揭示PTSD凋亡机制有一定意义。
本实验观察到RGMa在PTSD大鼠mPFC的表达增加,RGMa在SPS后表达增高尤其是SPS 7 d表达量最多,提示 RGMa参与PTSD的应激过程。RGMa是一种新的轴突生长抑制蛋白,可诱导生长锥塌陷进而阻断受损神经再生等作用[3],致中枢神经系统受到损伤后神经元的再生困难,在哺乳动物脑和脊髓损伤后其神经元中诱导抑制性或排斥性导向分子表达增多[14]。研究报导阻断RGMa蛋白后能使neogenin与RGMa分离,促使neogenin与netrin-1结合,促进轴突生长[16]。我们推测PTSD后情感改变、恐惧增强,与创伤后RGMa表达增多有关,RGMa表达增多可能使神经元生长锥塌陷抑制神经元再生,使PTSD神经元萎缩、凋亡。RGMa在创伤条件下与其高亲和力受体结合可通过激活RhoAROCK(RhoA-Rho-associated kinase)而使神经元生长锥崩塌,抑制脑神经元轴突生长[15],进而神经细胞萎缩甚至凋亡。
综上所述,本实验结果显示RGMa在mPFC的细胞凋亡时有很强的过表达,我们推测RGMa/neogenin信号有可能是PTSD细胞凋亡的重要调控信号。SPS大鼠mPFC中RGMa表达增高,可能通过RhoA-ROCK(RhoA-Rho-associated kinase)通路抑制神经元再生和修复,加重PTSD大鼠mPFC神经元凋亡的发生。本研究为阐明PTSD发病机制提供了部分实验依据。
[1]Hull AM.Neuroimaging findings in post-traumatic stress disorder systematic review[J].Br J Psychiatry,2002,181:102-110.
[2]Xiao B,Han F,Shi Yu-xiu,et al.Single-prolonged stress induces apoptosis by activating cytochrome c/caspase-9 pathway in a rat model of posttraumatic stress disorder[J].Cell Mol Neurobiol,2011,31(1):37-43.
[3]Hata K,Fujitani M,Yasuda Y,et al.RGMa inhibition promotes axonal growth and recovery after spinal cord injury [J].J Cell Biol,2006,173(1):47-58.
[4]Mottaghy FM,Gangitano M,Sparing R,et al.Segregation of areas related to visual working memory in the prefrontal cortex revealed by rTMS[J].Cereb Cortex,2002,12(4):369-375.
[5]Meeldinger A,Gruenewald C,Beseon M,et al.Separable neuronal circuitries for manipulable and non-manipulable objects in working memory[J].Cereb Cortex,2002,12(11):lll5-1123.
[6]Bechara A,Damasio H,Damasio AR.Emotion,decision making and the orbitofrontal cortex[J].Cerebral Cortex,2000,10(3):295-307.
[7]Li XM,Han F,Liu DJ,et al.Single-prolonged stress iduced mitochondrial-dependent apoptosis in hippocampus in the rat model of post-traumatic stress disorder[J].J Chem Neuroanat,2010,40(3):248-255.
[8]Liberzon I,Krstov M,Young EA.Stress restress:effects on ACTH and fast feedback[J].Psychoneuroendocrinology,1997,22(6):443-453.
[9]Li S,Yukihisa M,Wang M,et al.The effects of chronic valproate and diazepam in a mouse model of posttraumatic stress disorder[J].Pharmacol Biochem Behav,2006,85(2):324-331.
[10]lmanaka A,Mofinobu S,Toki S,et a1.Importance of early environment in the development of post-traumatic stress disorder-like behaviors[J].Behav Brain Res,2006,173(1):129-137.
[11]Apfel BA,Ross J,Neylan TC,et al.Hippocampal volume differences in gulf war veterans with current versus lifetime posttraumatic stress disorder symptoms[J].Biol Psychiatry,2011,69(6):541-548.
[12]Wang Z,Neylan TC,Muellea SG,et al.Magnetic resonance imaging of hippocampal subfields in posttraumatic stress disorder[J].Arch Gen Psychiatry,2010,67(3):296-303.
[13]Liu H,Wang HT,Han F,et al.Activity of5-HT1A receptor is involved in neuronal apoptosis of the amygdala in a rat model of posttraumatic stress disorder[J].Mol Med Rep,2011,4(2):291-295.
[14]Mueller BK,Yamashita T,Schaffar G,et al.The role of repulisive guidance molecules in the embryonic and adult vertebrate central nervoussystem[J].PhiloTransRSocLondBBioSci,2006,361(1473):1513-1529.
[15]Bae GU,Yang YJ,Krauss RS.Neogenin regulates skeletal myofiber size and focal adhesion kinase and extracellular signal-regulated kinase activities in vivo and in vitro[J].Mol Biol Cell,2009,20(23):4920-4931.
[16]Manitt C,Thompson KM,Kennedy TE,et al.Developmental shift in expression of netrin receptors in the rat spinal cord:predominance ofUNC-5homologuesinadulthood[J].Neurosci Res,2004,77(5):690-700.

