CD4+CD25+调节性T细胞及Foxp3基因在不同淋巴结转移状态的非小细胞肺癌患者中的表达差异①
何晓烨 蔡映云
(上海复旦大学附属中山医院老年病科,上海200032)
肺癌是当今对人类健康危害最大的肿瘤之一,其发生和发展涉及环境、微生物、炎症等众多因素,同时还伴随着机体免疫反应的参与及最终免疫监控机制的失调。CD4+CD25+调节性T细胞是一类具有免疫调节功能的T细胞亚群,与肿瘤免疫逃逸过程有着密切的关系[1,2]。近年来普遍认为可转录因子Foxp3是CD4+CD25+调节性T细胞的一个特征性标志,是其获得免疫调节特性的关键转录因子。Foxp3能使初生CD4+CD25-T细胞转化为CD4+CD25+的调节性 T细胞,该基因的正常表达是CD4+CD25+调节性T细胞发挥作用的前提[3]。
肿瘤微环境是近年来深入研究肿瘤局部淋巴细胞与肿瘤细胞相互作用而提出的新概念,它主要指肿瘤在其发生、发展过程中所处的内环境,由肿瘤细胞本身、间质细胞、微血管、组织液及少量浸润细胞,如树突细胞、巨噬细胞等共同组成[4]。抑制性免疫调节性T细胞是肿瘤微环境中参与肿瘤组织与免疫系统相互作用的重要因素之一。检测肿瘤微环境中调节性T细胞的表达情况有助于更全面地了解肿瘤逃逸免疫监视机制。
本研究主要观察和比较了CD4+CD25+调节性T细胞及Foxp3基因在不同淋巴结转移状态的非小细胞肺癌患者外周血及肿瘤微环境中的表达差异。
1 材料与方法
1.1 研究对象 收集46例于2008年5~12月间入住复旦大学附属中山医院胸外科的初诊肺癌患者,均为未经化疗及其他生物治疗的初治患者,不伴有自身免疫性疾病,均经病理组织学证实为非小细胞肺癌。其中男性24例,女性22例,有吸烟史9例。患者的平均年龄为(59.24±12.51)岁(38~86岁),平均病程(3.23±4.71)个月(2天~24个月,中位数1月)。组织学类型:腺癌36例、鳞癌8例、腺鳞癌2例。根据2003年国际抗癌联盟(UICC)的分期标准:Ⅰ期21例、Ⅱ期8例、Ⅲ期13例、Ⅳ期4例。病理分级:Ⅱ级29例、Ⅱ~Ⅲ级11例、Ⅲ级6例。所有入选患者均获得知情同意。
1.2 主要仪器与试剂 OD260/280核酸定量分析仪(Pharmacia公司);PCR仪(PE公司);凝胶成像系统(Alpha Innotech公司);Bio-Rad 550分光光度仪(美国Bio-Rad公司);FACS Calibur流式细胞仪(Becton Dickinson公司);IMS细胞图像分析系统(上海申腾信息技术有限公司);OLYMPUS BH2显微镜;PANASONIC MV-CP410摄像机;淋巴细胞分离液(国药集团化学试剂有限公司);PCR引物委托上海生工生物技术有限公司合成,Foxp3上游引物:5'-ACAGCACATTCCCAGAGTTCCT-3',下游引物:5'-TCTCCACCCGCACAAAGCA-3';GADPH上游引物:5'-CCCATCACCATCTTCCAG-3',下游引物:5'-ATGACCTTGCCCACAGC-3';Trizol(Invitrogen公司);逆转录试剂盒(Fermentas公司);50 bp DNA ladder(北京天根生物技术公司);2×Pfu PCR master mix(北京天根生物技术公司);Foxp3抗体(eBioscience公司);EnVision两步法试剂盒(DAKO公司);FITC-CD4和PE-CD25抗体(Invitrogen公司);TGF-β及IFN-γ的ELISA试剂盒(上海元象医疗器械有限公司)。
1.3 标本处理 采集肺癌患者空腹状态下的外周静脉血约4 ml,分为2份。一份离心后取血清置-20℃冰箱保存,待测 TGF-β及 IFN-γ。另一份用肝素抗凝,以淋巴细胞分离液常规分离外周血单个核细胞(PBMC),计数细胞后调整细胞浓度至1×106~2×106ml-1,以流式细胞仪检测 CD4+CD25+调节性T细胞。
每例患者术中取50 mg大小的肿瘤组织,加入500 μl生理盐水,用研磨杵头在1.5 ml EP管中手动研磨制备组织匀浆,5 000 r/min离心10分钟后取上清液,待测TGF-β及IFN-γ。肿瘤组织及引流区淋巴结的石蜡切片取自术后的常规石蜡切片,切片厚度3 μm。
1.4 流式细胞仪检测 取100 μl PBMC加入10 μl FITC标记的鼠抗人CD4,PE标记的CD25抗体,避光孵育30分钟后加入PBS洗涤2次,2 000 r/min离心5分钟后弃上清,加入500 μl PBS,FACS Calibur流式细胞仪检测。
1.5 RNA抽提及Real-time PCR 将肺癌患者的PBMC标本用RNA抽提试剂盒提取总RNA,操作步骤按说明书进行。以此RNA为模板,加入引物oligo(dT)18及Rnase-free水,65℃加热5分钟,迅速在冰上冷却。再加入逆转录缓冲液、dNTPs、逆转录酶和RNA酶抑制剂,继续反应42℃ 50分钟,99℃ 1分钟。cDNA分别以GAPDH和Foxp3为引物,进行PCR反应。反应条件为:95℃ 5分钟,94℃ 30秒,60℃ 30秒,72℃ 30秒,72℃ 10分钟,共40个循环。反应产物经2%琼脂糖凝胶电泳,Foxp3扩增片段192 bp,GAPDH扩增片段450 bp,凝胶成像系统成像拍照,灰度扫描分析结果。将目的条带的灰度值与内参的灰度进行比对得到目的基因的相对表达值。
1.6 TGF-β及IFN-γ检测 分别取肺癌患者血清、肿瘤组织匀浆上清液各约100 μl加入待测孔,反应板充分混匀后37℃下放置120分钟,洗涤液洗涤反应板4~6次后每孔加入第一抗体工作液50 μl,37℃下放置60分钟;洗板后每孔加入酶标抗体工作液100 μl,37℃下放置60分钟,洗板后每孔加入底物工作液100 μl,37℃暗处反应5~10分钟,每孔加1滴终止液混匀后于450 nm处测吸光值。分别于TGF-β和IFN-γ的标准曲线图上根据样品的OD值查出相应的TGF-β和IFN-γ值。
1.7 免疫组化 采用EnVision二步法。石蜡切片用二甲苯脱蜡,酒精梯度水化后9.0 EDTA 100℃加热30分钟,切片用0.3%H2O2处理5分钟。用PBS洗片 3次,每次 2分钟。加 50 μl Foxp3抗体(1∶50),4℃过夜。再用 PBS洗片3次,每次2分钟。加50 μl试剂盒中的抗鼠HRP聚合物,室温放置30分钟。PBS再次洗片3次,每次2分钟。DAB显色5~10分钟,苏木素复染,常规脱水透明封片。
结果判断:免疫组化染色结果由两位病理科医生在不知道相关临床资料的情况下进行。于光镜下(×200)随机选取10个视野观察肿瘤组织内、肿瘤组织与正常肺组织交界处以及淋巴结内淋巴细胞表达Foxp3的情况。然后采用IMS细胞图像分析系统和医学图像分析软件,计算淋巴细胞表达阳性Foxp3的OD值。
2 结果
根据肺癌患者是否存在淋巴结转移分为淋巴结转移组(n=22)和无淋巴结转移组(n=24),两组的一般情况及临床特点如表1所示。

表1 非小细胞肺癌患者的临床特点一览表Tab.1 The clinical characteristics of non-small lung cancer patients
2.1 不同淋巴结转移状态的肺癌患者外周血中CD4+CD25+调节性T细胞比例及Foxp3基因表达情况的比较 有淋巴结转移和无淋巴结转移的两组肺癌患者外周血中CD4+CD25+T细胞占总CD4+T细胞比例分别为41.00%±14.05%和43.62%±15.10%(表2,图1),Foxp3基因的相对表达量分别为1.01% ±0.51和0.92% ±0.41,组间比较均无显著性差异(表2,图2)。
2.2 不同淋巴结转移状态的肺癌患者肿瘤微环境及淋巴结中淋巴细胞表达阳性Foxp3的情况比较在肿瘤微环境及淋巴结组织中,表达阳性Foxp3的淋巴细胞表现为细胞核呈棕黄色(图3)。转移淋巴结表达Foxp3的阳性程度要明显强于未转移淋巴结(OD值16.43±3.07 vs 8.49±0.64,P<0.05,表2);有淋巴结转移的肺癌患者肿瘤组织及肿瘤组织与正常肺组织交界处淋巴细胞表达阳性Foxp3的OD值均明显高于无淋巴结转移的肺癌患者(肿瘤组织处16.89±3.12 vs 11.02±3.15,交界处15.71±3.27 vs 10.66 ±2.75,P <0.05,表2,图3)。

表2 不同淋巴结转移状态的肺癌患者外周血及肿瘤微环境中调节性T细胞的表达情况及TGF-β、IFN-γ水平的检测结果Tab.2 The expression of regulatory T cells and levels of TGF-β and IFN-γ in peripheral blood and tumor microenvironment of NSCLC patients with different lymph node metastasis situation
2.3 不同淋巴结转移状态的肺癌患者外周血及肿瘤组织匀浆中TGF-β及IFN-γ的检测结果比较 两组肺癌患者外周血中TGF-β水平分别为(68.04±9.80)pg/ml和(67.44 ± 9.62)pg/ml,IFN-γ 水平分别为(28.52±1.77)pg/ml和(30.88±10.78)pg/ml,组间比较差异无显著性(P>0.05,表2)。
有淋巴结转移的肺癌患者肿瘤组织匀浆中TGF-β水平明显高于无淋巴结转移的肺癌患者[(111.53 ±34.10)pg/ml vs(67.19 ±14.78)pg/ml],差异具有显著性(P<0.05,表2),但两组的IFN-γ水平比较无显著性差异[(27.75±25.01)pg/ml vs(28.27 ±11.65)pg/ml],P >0.05,表2。
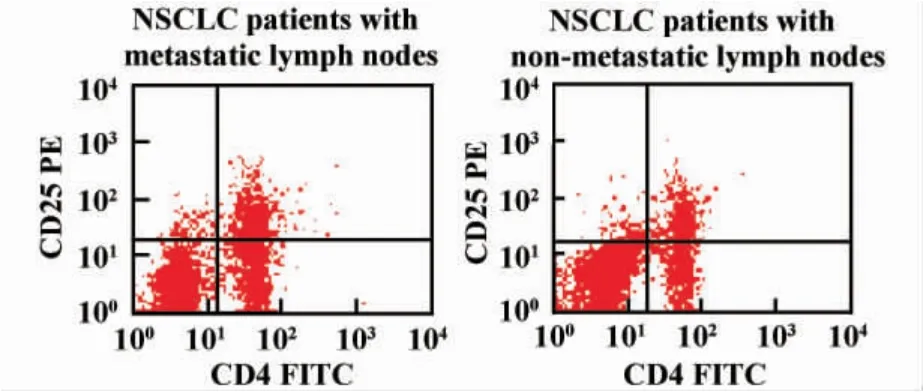
图1 不同淋巴结转移状态的肺癌患者外周血中CD4+CD25+T细胞比例比较Fig.1 Proportion of CD4+CD25+T in PBMC of NSCLC patients with different lymph node metastasis situation

图2 不同淋巴结转移状态的肺癌患者外周血中Foxp3基因的表达Fig.2 Foxp3 expression in periphery blood of NSCLC patients with different lymph node metastasis situation

图3 不同淋巴结转移状态的肺癌患者肿瘤微环境及淋巴结中淋巴细胞表达阳性Foxp3的情况Fig.3 Foxp3 expression in lymphocytes of tumor microenvironment in NSCLC patients with different lymph node metastasis situation
3 讨论
肿瘤患者引流区的淋巴结中存在着大量的免疫细胞,它们具有识别和杀伤肿瘤细胞的潜能,而肿瘤细胞仍然可以在其中存活并转移,说明在肿瘤侵袭的淋巴结中,免疫效应细胞的增多受到了抑制,免疫状况发生了改变。我们的研究显示,在非小细胞肺癌患者转移的淋巴结中淋巴细胞表达Foxp3的阳性程度明显强于未转移淋巴结。这可能是因为肿瘤的生长促进了CD4+CD25+调节性T细胞在淋巴结中的增殖和分化;同时,增多的调节性T细胞增强了其免疫抑制作用,进一步抑制了淋巴结内的多种免疫细胞对肿瘤细胞的杀伤作用,从而促进了淋巴结中肿瘤细胞的侵袭。在肿瘤免疫过程中,肿瘤抗原能够被机体的免疫系统识别并清除,对人体有着重要的保护作用。而调节性T细胞可通过抑制CD4+CD25-T细胞和活化的CD8+CTL细胞等效应T细胞的增殖[5,6],抑制树突细胞的成熟和抗原递呈能力,以及参与多种细胞因子的相互作用来抑制机体抗肿瘤的免疫反应,从而促进了肿瘤细胞的生长和侵袭。
此外,我们的研究显示,虽然CD4+CD25+调节性T细胞比例和Foxp3基因的表达在两组不同淋巴结转移状态的非小细胞肺癌患者外周血中的比较无显著性差异,但存在淋巴结转移的非小细胞肺癌患者在肿瘤组织、肿瘤组织与正常肺组织交界处中的Foxp3基因表达均明显强于无淋巴结转移的肺癌患者。Curiel等[7]学者认为,大多数肿瘤细胞能分泌趋化因子CCL22,而调节性T细胞表面高表达CCL22受体CCR4,因此尽管外周血中存在着效应性CD4+CD25+调节性T细胞,肿瘤细胞和肿瘤微环境中的巨噬细胞还是通过分泌趋化因子CCL22趋化调节性T细胞向肿瘤局部特异性聚集,从而发挥免疫抑制效应,这也是肿瘤免疫逃逸发生的一个重要机制。
肿瘤微环境中调节性T细胞发挥免疫抑制涉及多种机制,目前认为主要有:①调节性T细胞诱导抗原提呈细胞(APC)表达B7-H4,B7-H4+APC能抑制T细胞的增殖周期;②调节性T细胞通过释放穿孔素或粒酶直接杀伤T细胞和APC;③CYLA4+调节性T细胞诱导 APC表面IDO的表达[8],而IDO是降解色氨酸的酶,其表达一旦增加则会导致生长环境中缺少色氨酸,令蛋白质合成受阻,从而影响T细胞的增殖和活化;④通过释放IL-10和TGF-β等细胞因子,抑制MHC分子、CD80、CD86等分子表达,抑制IL-12分泌,直接抑制T细胞活化和AK功能。总而言之,肿瘤微环境中的调节性T细胞削弱了抗肿瘤免疫反应,并能部分解释T细胞对肿瘤抗原的弱应答现象。
肿瘤组织微环境中存在多种可以抑制效应T细胞功能的细胞因子成分,这些细胞因子由肿瘤细胞本身或间质细胞所分泌。我们的研究发现,存在淋巴结转移的肺癌患者肿瘤组织匀浆中的TGF-β水平要明显高于无淋巴结转移的肺癌患者。TGF-β具有促进和抑制细胞增殖的双向作用,在免疫系统中表现出负调节因子效应,可通过抑制MHC抗原表达、干扰树突状细胞的分化成熟诱导免疫耐受。在肿瘤组织微环境中,主要是通过影响效应T细胞、巨噬细胞、自然杀伤细胞等发挥非特异性免疫抑制作用,同时TGF-β可诱导调节性T细胞的扩增,而扩增的调节性 T 细胞又可进一步分泌 TGF-β[9,10]。
1 Field E H,Matesic D,Rigby S et al.CD4+CD25+regulatory cells in acquired MHC tolerance[J].Immunol Rev,2001;182:99-112.
2 Somasundaram R,Jacob L,Swoboda R et al.Inhibition of cytolytic T lymphocyte proliferation by autologous CD4+/CD25+regulatory T cells in a colorectal carcinoma patient is mediated by transforming growth factor beta[J].Cancer Res,2002;62(18):5267-5272.
3 Chen W,Jin W,Hardegen N et al.Conversion of peripheral CD4+CD25-native T cells to CD4+CD25+regulatory T cells by TGF-beta induction of transcription factor Foxp3[J].J Exp Med,2003;198(12):1875-1886.
4 Hede K.Environmental protection:studies highlight importance of tumor microenvironment[J].J Natl Cancer Inst,2004;96(15):1120-1121.
5 Wolf A M,Wolf D,Steurer M et al.Increase of regulatory T cells in the peripheral blood of cancer patients[J].Clin Cancer Res,2003;9(2):606-612.
6 Read S,Malmstr∅m V,Powrie F.Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+)regulatory cells that control intestinal inflammation[J].J Exp Med,2000;192(2):295-302.
7 Curiel T J,Coukos G,Zou L et al.Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival[J].Nat Med,2004;10(9):942-949.
8 Munn D H,Sharma M D,Mellor A L et al.Ligation of B7-1/B7-2 by human CD4+T cells triggers indoleamine 2,3-dioxygenase activity in dendritic cells[J].J Immunol,2004;172(7):4100-4110.
9 Peng Y,Laouar Y,Li M O et al.TGF-beta regulates in vivo expansion of Foxp3-expressing CD4+CCD25+regulatory T cells responsible for protection against diabetes[J].Proc Natl Acad Sci USA,2004;101(13):4572-4577.
10 Li H,Yu J P,Cao S et al.CD4+CD25+regulatory T cells decreased the antitumor activity of cytokine-induced killer(CIK)cells of lung cancer patients[J].J Clin Immunol,2007;27(3):317-326.