脑胶质瘤组织中内皮抑素的表达及其与血管形成的关系①
陈 岩 倪朝辉 赵 刚 (吉林大学第二医院神经外科,长春130041)
恶性胶质瘤是高度血管化的肿瘤,内皮细胞增殖所致新生血管的形成与胶质瘤的恶性程度、生物侵袭性及临床复发进程密切相关[1]。肿瘤新生血管形成是血管生成刺激因子与抑制因子共同调节、相互制衡的结果。已有较多研究报道证实:以VEGF为代表的多种血管生成刺激因子在恶性胶质瘤组织中表达明显升高。而对于负性调控因子,尤其是目前已知作用最强的内源性血管生成抑制因子——内皮抑素(Endostain,ES)在胶质瘤肿瘤组织中的表达情况研究尚不多见,且已有研究结果也不尽一致[2,3]。因此,本研究应用免疫组化方法检测不同级别的人脑胶质瘤组织中内皮抑素的表达及肿瘤微血管密度(MVD),旨在进一步明确内皮抑素蛋白水平与胶质瘤新生血管形成的关系,为应用抗血管生成疗法治疗脑胶质瘤提供实验依据。
1 材料与方法
1.1 临床资料 选取手术切除并经病理证实的46例脑胶质瘤患者。男31例,女15例,年龄15~64岁,平均41.6岁。其中Ⅰ级7例;Ⅱ级18例;Ⅲ级13例;Ⅳ级8例。同时取5例外伤后内减压术的非肿瘤患者脑组织标本作为正常对照组,标本经10%福尔马林液固定,常规石蜡包埋,5μm厚组织切片。
1.2 脑胶质瘤组织内皮抑素及MVD表达检测内皮抑素单克隆抗体购自R&D systems;免疫组化试剂盒购自福州迈新试剂公司。内皮抑素主要表达于血管内皮细胞及肿瘤细胞胞浆内,以胞浆中出现棕黄色颗粒为染色阳性。每张切片随机观察1个高倍镜视野,计数500个细胞中阳性细胞的百分率:其中阳性细胞百分率<5%记为(-),5% ~20%记为(+),21% ~50%记为(++),百分率 >50%记为(+++);MVD检测采用SP法进行CD34染色,在低倍镜下寻找微血管最密集区,然后在400倍视野范围内计算5个视野下的微血管数,取其平均数作为该病例的MVD值。
1.3 统计学方法 采用SPSS14.0软件包进行统计学处理。计量数据以±s表示;计数资料数据以百分率表示,率的差异性比较采用卡方检验率;等级资料率的差异性比较采用Wilcoxon秩和检验;以P<0.05为差异有显著性统计学意义。
2 结果
2.1 内皮抑素在胶质瘤组织中的表达情况 5例正常脑组织及46例各级别胶质瘤组织中内皮抑素表达阳性率见表1。脑胶质瘤组织标本中,以内皮细胞中内皮抑素表达最为显著(图1A)。此外,在肿瘤细胞浆亦偶见内皮抑素阳性表达,尤见于新生血管内皮细胞周边的肿瘤细胞(图1B)。与正常脑组织相比,胶质瘤组织中内皮抑素表达百分率显著增加(χ2=8.673,P=0.003 <0.01)。对内皮抑素表达程度与胶质瘤病理级别的关系行Spearman等级相关分析,显示内皮抑素在胶质瘤血管内皮细胞中的表达强度随肿瘤恶性程度增高而增强。
2.2 肿瘤微血管密度(MVD)检测 不同级别的胶质瘤组织中MVD值见表2,各组间总体存在非常显著性差异(χ2=33.204,P=0.00 <0.01),进一步进行两两比较,除Ⅲ级与Ⅳ级之间的差异没有统计学意义外(χ2=3.824,P=0.051 >0.05),其余各级之间均存在非常显著性差异(P值均小于0.003 3)。各级别胶质瘤组织中MVD染色见图2。

表1 胶质瘤组织中内皮抑素表达与肿瘤病理级别关系Tab.1 Relationship between Endostatin expression with tumor pathology grade in glioma tissues

图1 胶质瘤组织中内皮抑素表达免疫组化检测(×400)Fig.1 Immunohistochemical detection of endostatin in gliomas tissues(×400)
2.3 内皮抑素表达强度与肿瘤MVD的关系 对表达不同强度内皮抑素的胶质瘤组织中的MVD情况进行分析发现:随着内皮抑素蛋白表达强度的增加,MVD值呈上升趋势(详见表3)。

表2 胶质瘤组织MVD与病理级别的关系Tab.2 Relationship between MVD with tumor pathology grade in glioma tissues
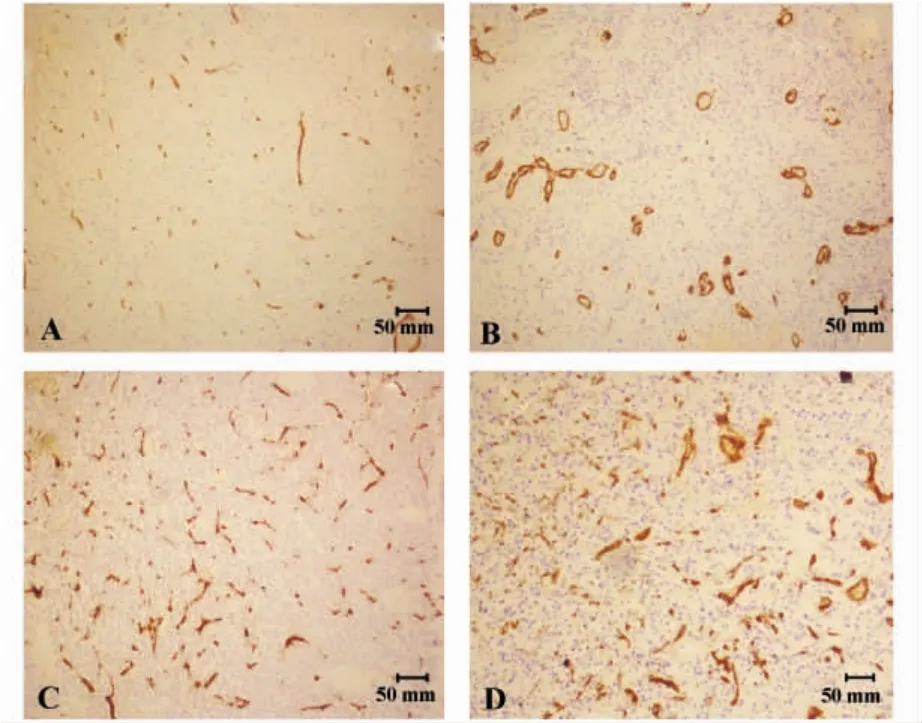
图2 胶质瘤组织CD34免疫组化检测(×100)Fig.2 Immunohistochemical detection of CD34 in each grade glioma tissues(×100)

表3 胶质瘤组织中内皮抑素表达与MVD的关系Tab.3 Relationship between Endostatin expression with MVD in glioma tissues
3 讨论
内皮抑素是目前已知功能最强的血管生成抑制因子,能特异性地抑制血管内皮细胞增殖,从而有效地抑制血管生成和肿瘤生长[4]。目前的研究认为内皮抑素并不是由肿瘤细胞直接产生的,而是由于机体受到肿瘤细胞通过多种途径的刺激,激发血管生成,之后内皮细胞产生蛋白水解酶,水解胶原ⅩⅧ的C末端中心蛋白酶敏感区,水解后释放出大小不等的生物活性片段,即为内皮抑素,并且通过血液循环到达肿瘤部位,抑制原发和继发肿瘤血管的生成。
脑胶质瘤是富含血管的肿瘤,恶性胶质瘤如多形性胶质母细胞瘤更以高度血管化和血管内皮细胞增生为主要特征。胶质瘤细胞的不断生长、繁殖、浸润,必须通过胶质瘤间质血管获得营养物质,间质血管在维持脑胶质瘤细胞生物学行为方面起着至关重要的作用。Morimoto等[2]利用内皮抑素的单克隆抗体通过免疫印迹和免疫组织化学的方法对51例星形细胞瘤内皮抑素的表达情况进行研究,发现Ⅳ级的星形细胞瘤组织中的内皮抑素表达水平明显高于低级别的瘤组织;内皮抑素的免疫染色定位于所有级别的肿瘤血管上,在恶性脑胶质瘤中内皮抑素的阳性染色甚至广泛包绕着靠近增生微血管周的瘤细胞。本研究结果与其基本一致,且研究还发现,随着胶质瘤病理级别的增高,其MVD值增加,并且组织中内皮抑素的表达量也呈现增高趋势。但是这一结果似乎与胶质瘤高度血管化的临床病理特征相矛盾。考虑原因可能为随着肿瘤恶性程度的增高,其血管内皮细胞高度增生,使得肿瘤组织中血管内皮生成因子表达升高,从而促进肿瘤组织中多种胶原酶表达上调,而内皮抑素是ⅩⅧ型胶原C端的一个水解片段,胶原酶表达增多可以促进内皮抑素的生成增多。而Ratel等[5]认为恶性肿瘤组织以及血清中内皮抑素抗体的存在可能使得肿瘤可以逃逸血管生成分子的作用,使得血管生成促进因子和抑制因子之间的平衡仍偏向血管生成有关。国内学者[6]也认为其原因可能为机体内部存在着某种平衡的机制,当肿瘤组织中血管内皮生成因子水平升高时,内皮抑素的表达水平也随之升高以期达到一种新的平衡状态。但是由于两者之间的表达上调速度不一致,血管内皮生成因子水平上调快而内皮抑素水平上调慢,导致在肿瘤组织中主要表现为促进新生血管生成,从而使得肿瘤快速生长。肿瘤组织中血管生成调控的复杂性可能也是某些肿瘤组织中内皮抑素低表达的原因所在。总之,肿瘤组织中新生血管形成的调控机制以及与之相关的内皮抑素蛋白的加工及灭活机制均有待进一步研究,抗血管生成疗法也将有望成为彻底治愈脑胶质瘤的有效手段之一。
1 Wong M L,Prawira A,Kaye A H et al.Tumour angiogenesis:its mechanism and therapeutic implications in malignant gliomas[J].J Clin Neurosci,2009;16(9):1119-1130.
2 Morimoto T,Aoyagi M,Tamaki M et al.Increased levels of tissue endostatin in human malignant gliomas[J].Clin Cancer Res,2002;8(9):2933-2988.
3 Strik H M,Schluesener H J,Seid K et al.Localization of endostatin in ratand human gliomas[J].Cancer,2001;91(5):1013-1019.
4 Fujita Y,Abe R,Shimizu H.Clinical approaches toward tumor angiogenesis:past,present and future[J].Curr Pharm,2008;14(36):3820-3834.
5 Ratel D,Nasser V,Dupre L et al.Antibodies to endostatin in a multifocal glioblastoma patient[J].Lancet,2000;356(9242):1656-1657.
6 高文宏,陈谦学,刘 刚.内皮抑素和血管内皮生长因子在脑胶质瘤中的表达及意义[J].中国临床神经外科杂志,2006;11(2):86-87.