植物硒形态分析的研究综述
程建中,杨 萍,桂仁意
(浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安311300)
硒(Se)是人和动物必须的微量元素,具有防癌抗癌,清除体内自由基,抗衰老等作用[1-2]。研究证明: 克山病(Keshan disease),大骨节病(Kaschin-Beek disease),糖尿病(diabetes),艾滋病(AIDS)等 40多种疾病与缺硒有关[3]。1932年,人们从植物体中检测出硒,发现人或动物摄取的硒都直接或间接来自于植物,植物硒具有较高的生物利用度和生物活性[4],并且植物硒的生物功能与其形态和含量密切相关。作者对近年来国内外植物硒形态分析研究予以综述。
1 植物硒形态存在形式及代谢途径
硒被植物吸收后,形成非常复杂的化学形态,分为无机硒和有机硒两大类。无机硒较少,包括硒酸、亚硒酸和其他一些无机形态(如Se2-和HSe-),且主要以Se(Ⅳ)形式存在。有机硒占硒总量80%以上,由大分子硒和以硒代氨基酸及其衍生物形式存在的小分子硒化物(表1)组成;大分子硒主要包括硒蛋白、硒核酸和硒多糖等,小分子硒化物包括硒甲基硒半胱氨酸、硒代高胱氨酸、硒代蛋氨酸和硒肽等[7]。硒代氨基酸是人日常膳食中获取硒的主要来源。
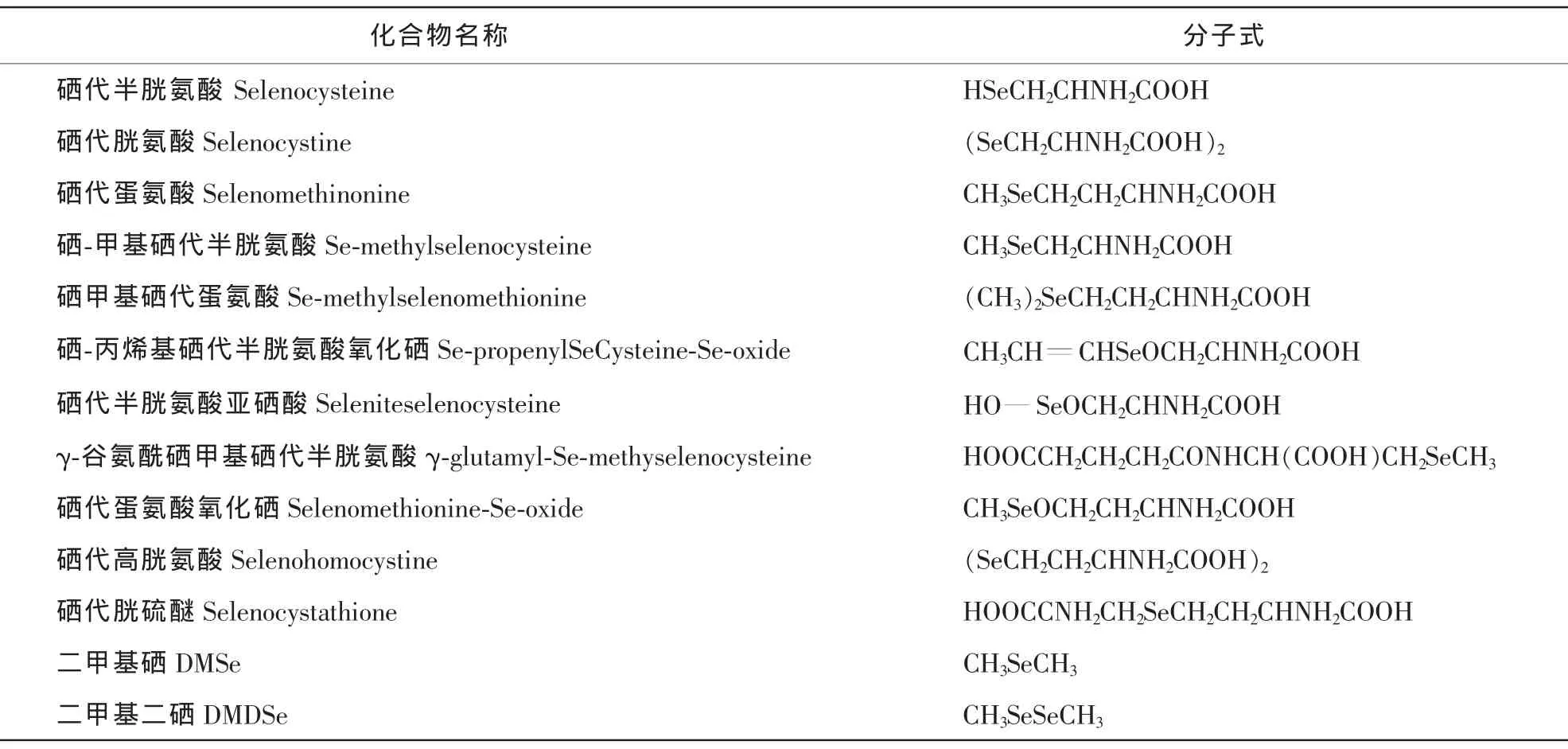
表1 植物中有机小分子硒化合物[5-6]Table 1 Small organic molecule Se-compounds in plants
由于硒和硫有相似的物理和化学性质,目前,通过植物体中硫的代谢途径来研究硒的代谢过程。植物对硒的吸收依赖硫转运体,这个过程是逆电化学式梯度的需能体现[8]。代谢过程(图1)主要发生在植物的叶绿体和细胞质中,其中关于代谢产物硒代蛋氨酸、硒代半胱氨酸和甲基硒代半胱氨酸的研究报道较多[11-13]。目前,植物含硒蛋白研究较多[14-15],对于植物体中有哪些大分子硒蛋白,还未见报道。
2 硒形态样品的提取
由于硒形态的不稳定性,样品的提取过程尽量保持硒形态的原始特性不变,比仅仅检测硒元素复杂得多,也是植物硒形态分析准确性的关键。目前,针对有机硒蛋白,大多数采用体积分数为75%乙醇,0.5 mol°L-1氯化钠和 0.1 mol°L-1氢氧化钠溶液进行提取[4]。余芳等[16]用 0.1 mol°L-1氢氧化钠为提取液提取富硒茶叶中硒蛋白,确定料液比1∶30(g°mL-1),提取时间16 h,提取温度40℃时的提取效率最高。在小分子硒形态方面,主要包括水提取法、酸提取法和酶提取法[17]。水提取对一些非结合蛋白形式的硒形态较适合,如硒-甲基硒代半胱氨酸、γ-谷氨酰基-硒甲基硒代半胱氨酸,但对以蛋白形式结合的硒,回收率较差;酸提取法有很高的回收率,但酸易使硒形态发生转变;酶提取法的应用最广(表2),常用的酶有蛋白酶K,蛋白酶XIV,胰蛋白酶,胃蛋白酶和链霉蛋白酶等。酶提取法通常在温和的条件下(37℃,pH 7.0)进行,可以减少硒形态之间相互转化,但此法提取的时间较长,一般需24~48 h。Emese等[12]对富硒北葱Allium schoenoprasum硒形态分析采用2种方法进行提取:①对于非蛋白硒,用高氯酸-乙醇(8∶2)提取;②对于蛋白硒,采用酶解法。首先蛋白酶K溶于pH 7.5的三羟甲基氨基甲烷(Tris)缓冲液(包含1 mmol°L-1氯化钙2),所得到的溶液加入到韭菜Allium tuberosum样品中,在50℃下搅拌15 h,后再加入蛋白酶XIV,同样在50℃下搅拌15 h。在第1种提取方法下,检测到MeSeCys,SeCys2,Se(Ⅳ)和Se(Ⅵ)等4种硒形态,用第2种提取方法,检测到5种硒形态(多检测出SeMet),且酶解法得出的有机硒形态含量高于第1种方法。
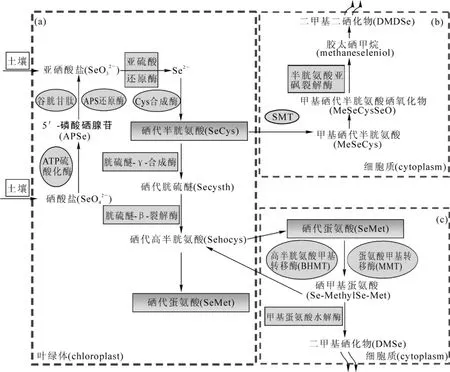
图1 植物硒代谢途径[9-10]Figure 1 Selenium metabolic fate in plants
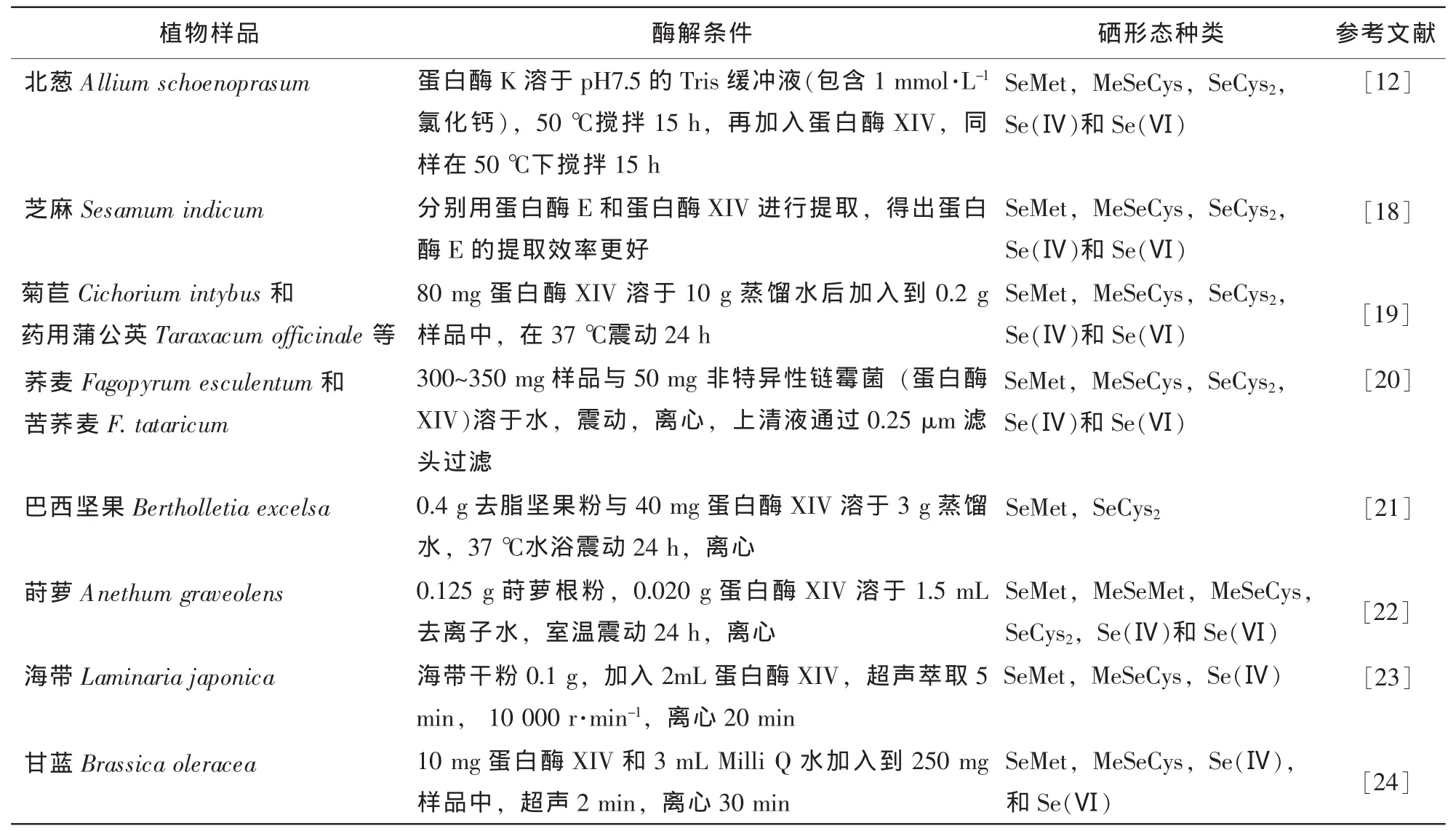
表2 近几年植物样品中硒形态酶解过程Table 2 Procedures of enzymatic hydrolysis for selenium species extractions in plants in recently years
按照使用辅助仪器的不同,分为萃取提取、振摇提取、超声提取、离心提取、微波提取等,其中超声微波结合酶提取法可以有效地缩短提取时间[25],加压液体萃取法(PLE)是未来研究的方向之一。该方法在分析锡和砷形态分析上得到应用,但在硒形态分析上应用较少[26]。
3 硒形态分离联用技术
硒化物的分离技术主要有气相色谱法(GC),液相色谱法(LC,表3)和电泳法等。植物体中挥发性的含硒化合物(如二甲基硒和二甲基二硒),应用GC分离较方便,且检测限可达到1 ng°L-1[27]。非挥发性(含硒氨基酸)和含硒手性化合物,采用GC方法会消耗大量时间,且不适用分离低聚肽的硒化合物。Janáak[28]利用氯甲酸乙酯同氨基酸基团特征反应使SeMet和SeCys2等衍生成气态化合物,再通过GC进行分离。
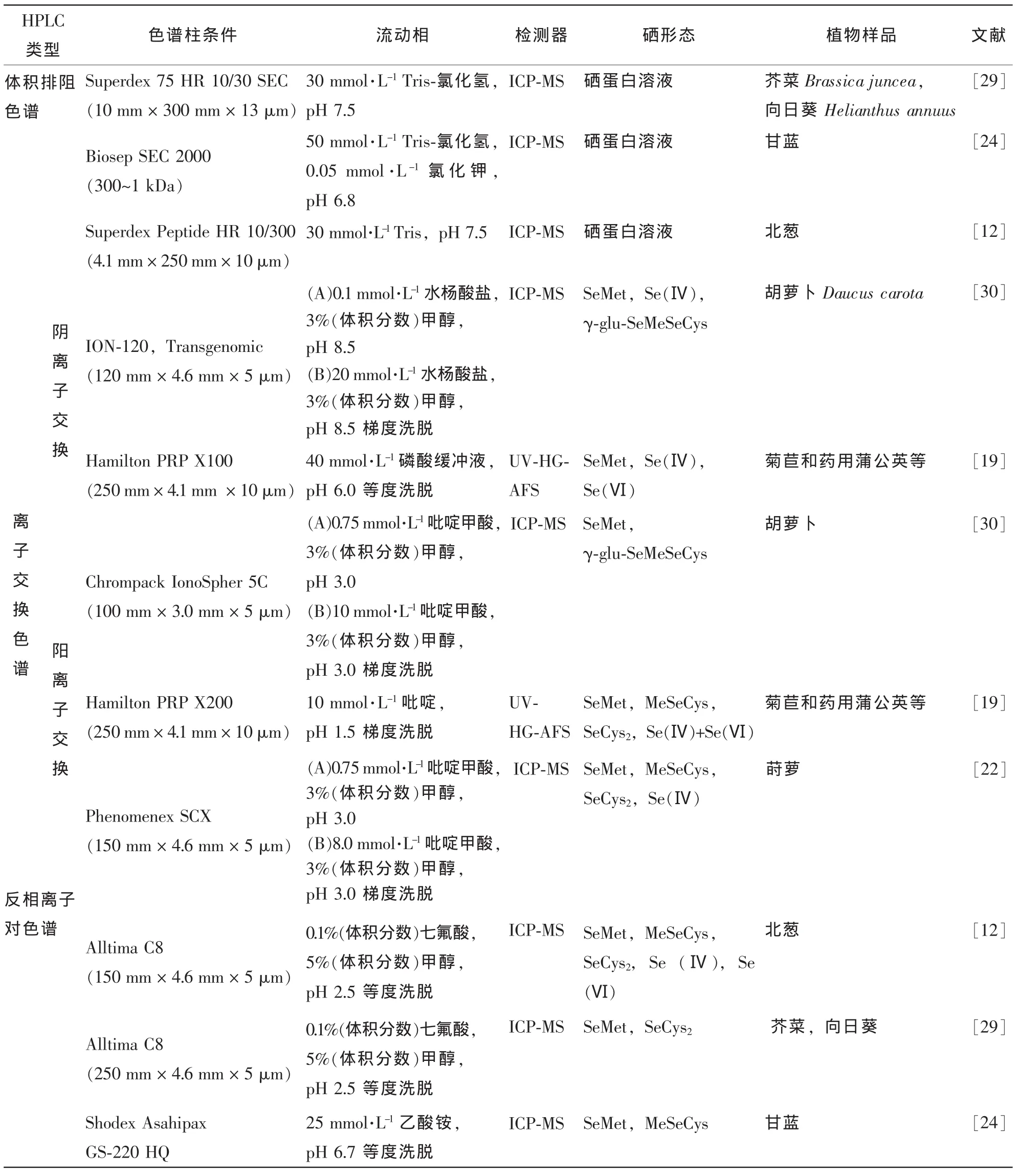
表3 液相色谱应用于植物样品中硒形态分离Table 3 Examples of applications of different chromatographic liquid mechanisms for selenium species sepration in plant
植物体硒形态多以非挥发性形式存在,高效液相色谱技术被广泛应用于分离植物体中各种硒形态(表3)。目前,用于硒形态分析高效液相色谱法(HPLC)包括体积排阻色谱(SEC-HPLC),离子交换色谱(IEC-HPLC)和反相离子对色谱(RP-IP-HPLC)。SEC-HPLC是一种温和的分离方法,主要用于硒蛋白、硒多糖的检测以及硒与蛋白相互作用的研究,主要分离的化合物分子量为10~1 000 kDa[31]。Mounicou等[32]用Superdex 75排阻色谱柱和Mono-Q 5/50GL强离子交换快速蛋白柱组成二维色谱分离法分析富硒芥菜Brassica juncea中含硒蛋白并分离其中的小分子含硒化合物。此外,体积排阻法可作为后面用离子交换和反相色谱分析小分子硒形态的前纯化步骤。IEC-HPLC主要用来分离样品中带有电荷的化合物,根据各种物质在离子交换柱中的保留时间不同将它们分开。由于植物无机硒中的Se(Ⅳ)和Se(Ⅵ)带有负电荷,硒代氨基酸及其他小分子硒化合物在一定pH值条件下带有正电荷,所以,离子交换色谱常被用来分析植物中小分子硒化合物[33]。RP-HPLC因其固定相不含有游离金属配体化合物,在分离硒类生物分子化合物方面,效果优于其他色谱方法,尤其适用于天然产物分离,是目前应用最广泛的分离硒化合物方法[34]。在RP-HPLC流动相中加入一种反离子试剂成为RP-IP-HPLC,它能同时分离带有电荷和不带电荷的化合物,且具有非常高的结果重复性和较短的分离时间。此外,缓冲液的浓度、pH值、流动相中的离子强度等都影响着反相离子对色谱的分辨力[33]。
电泳法拥有高分辨率、低检测限,且在分析过程中能保持样品的完整性等优点,在分析植物硒形态中应用越来越广。主要有毛细管电泳(CE)和凝胶电泳(GE)。CE以电渗流为驱动力、毛细管为分离通道,根据目标分子所带电荷数与分子本身大小的比值进行分离,具有分离时间短、效果好、成本低、样品耗用量少等优势,是高效液相色谱在形态分析方面的有效补充。Kannamkumarath等[35]用毛细管电泳-电感耦合等离子体质谱 (CE-ICP-MS)对坚果中硒形态研究,在酶提取液中7 min内分离出SeMet,SeCys2。Se(Ⅳ)和 Se(Ⅵ)。但由于 CE 和 ICP-MS 在联用时,所需的流速不同(分别为 nL°min-1和 mL°min-1),所以接口技术的发展对推广CE-ICP-MS在分析植物硒形态上的应用至关重要[17]。凝胶电泳中聚丙烯酰胺凝胶电泳(SDS-PAGE)由于分辨率比HPLC高,在分析含硒蛋白方面应用较多。用SDS-PAGE对粗米中的硒蛋白分析,共得到7组含硒蛋白胶条,分布在分子量13.6~121.4 kDa的蛋白质中,且主要分布区域为13.6~15.8 kDa,84.34%的Se在分子量小于36.3 kDa的蛋白质中被检测到[15]。但是,具有不同硒蛋白组成的植物组织也可能在SDS-PAGE中有相同的分离速度,所以分离得到的蛋白胶条不能真实代表实际样品蛋白组成,二维等电聚焦SDS-PAGE可较好改善分离效果,系统一次运行可分离几千种蛋白质[34]。此外,激光烧蚀等新技术也逐渐得到发展应用[36]。
4 硒形态检测联用技术
在研究植物硒的各种化学形态时,检测技术有电感耦合等离子体质谱(ICP-MS),原子吸收光谱(AAS),原子荧光光谱(AFS)和原子发射光谱(AES)等。ICP-MS有高灵敏度,高选择性等优点,然而,对于硒而言,由于其第一电离能较高(I1=9.752 eV),使得离子化效率相对较低,而且还存在多原子离子的干扰(40Ar和36Ar+对76Se,40Ar和37Ar+对77Se,40Ar和38Ar+对78Se等)。近年,随着 ICP-MS中碰撞反应池技术的发展[37],使得多原子对Se的干扰得到有效控制,加上ICP-MS与HPLC和CE耦合等优点,高效液相色谱-电感耦合等离子体质谱(HPLC-ICP-MS)和CE-ICP-MS已成为植物硒形态分析中应用最多的联用仪器(表3)。
电喷雾质谱(ES-MS),电喷雾串联质谱(ES-MS-MS)和二维凝胶色谱分离结合激光解吸飞行质谱(MALDI-TOF)是目前在分析硒化合物结构方面应用较先进的技术。由于大分子硒化合物及盐的影响,植物硒溶液不能直接进入ES-MS中进行分析,且ES-MS联用技术检测灵敏度要比ICP-MS联用低,因此,在用ES-MS分析前,需要对植物样品进行浓缩提纯[4]。由于灵敏度不高,目前ES-MS仅在富硒能力强的植物上(蒜Allium sativum,洋葱A.cepa等)应用较多[38-39],在富硒能力弱的植物上应用还有待发展。Dernovics等利用HPLC-ES-MS在巴西坚果Bertholletia excelsa中发现了大约15条硒多肽。此外,利用ES-MS技术,已经在酵母和动物体内鉴定出一些硒蛋白的结构,但是在植物方面,尚未发现有关硒蛋白结构的报道。MALDI-TOF是一种软电离技术,不产生或产生较少的碎片离子,适用于混合物及生物大分子的测定,准确度为0.10%~0.01%,远远高于目前常规应用的SDS电泳等技术,目前可测定生物大分子的分子量高达600 kDa,这可能是未来研究植物大分子硒化合物形态结构的主要手段。
同位素稀释分析法(IDA)也是近年在硒形态分析上应用较多的方法之一。植物硒形态在样品处理和储藏阶段能够相互转化,同位素追踪可以有效地解决这一问题。IDA的优点是植物样品与稀释剂混合后同位素的比值不变,因此,不必考虑样品处理过程中被测元素的损失。此外,植物样品经色谱分离后,在线加入待测元素同位素稀释剂,再进入质谱检测完成同位素稀释分析(柱后同位素稀释法),可以对色谱分离所得到的未知结构硒形态准确地定量,这是ES-MS技术所无法做到的。
5 植物硒形态分析研究展望和应用前景
近20 a来,硒在毒理学、生理学及环境科学上的重要性愈来愈为人们重视,硒的测定方法研究从痕量和超痕量发展,向有机硒化合物测定的方向发展,联用技术的发展为分离检测植物硒形态做出了重大贡献,HPLC-ICP-MS是目前分析硒化合物应用最多的方法之一,但还存在需要解决的问题:①由于硒形态的不稳定性造成无法准确地定性定量,应从减少硒形态的相互转化和分析硒形态转化后的产物2个方面进行研究,对植物样品分析前应该用冷冻干燥进行处理,防止应用高温烘干处理后,硒形态发生变化。也可以充分利用同位素稀释分析法在对硒形态转化上的应用。②由于植物有机硒化合物种类繁多且含量低、标准品有限、目标化合物的不可知性、结构鉴定仪器尚不令人满意的灵敏度及其未充分开发的潜力等因素的限制,对其硒蛋白和含硒氨基酸等有机含硒化合物的直接分析仍存在着巨大的挑战,因此检测分析方法实用化,仪器简单化、标准化是硒形态研究的一个重要方向。
目前,随着含硒氨基酸密码子(UGA)的破译及含硒氨基酸进入蛋白质机制的阐明,人们对硒的研究已深入到分子生物学水平,对硒的生物学作用的重要性认识进一步深入。硒在动物体内的生理生化机制已越来越清楚,多种含硒蛋白逐渐被纯化出来,其生理生化功能也逐渐成为营养学界所注目的焦点。因此,大分子植物硒蛋白方面的研究将是相关领域内科研工作中的重点与方向,随着植物各种硒蛋白和含硒蛋白的深入研究,以及硒与食品中其他营养物质相互作用的探索,功能性食品(优良的硒补充剂)的开发将有着极为广阔的应用前景。
[1]BROOKS J D,METTER E J,CHAN D W,et al.Plasma selenium level before diagnosis and the risk of prostate cancer development[J].J Urol,2001,166 (6): 2034-2038.
[2]孟惠平,吕明.微量元素硒的抗衰老作用研究[J].世界元素医学,2008,15(3):29-33.MENG Huiping,LU Ming.Study on the anti-decrepitude function of trace element selenium [J].World Elem Med,2008,15 (3): 29-33.
[3]ZIEGLER E E,FILER L J Jr.Present Knowledge in Nutrition [M].Washington D C: International Life Science Institute,1996: 310.
[4]张涛,吴刚,陈春英,等.联用技术在植物硒形态分析中的应用[J].理化检验:化学分册,2009,45(6):749-760.ZHANG Tao,WU Gang,CHEN Chunying,et al.Application of hyphenation of different analytical methods to speciation analysis of selenium in plants [J].Ptca Part B Chem Anal,2009,45 (6): 749-755.
[5]DUMONT E,VANHAECKE F,CORNELIS R.Selenium speciation from food source to metabolites: a critical review[J].Anal Bioanal Chem,2006,383: 1304-1323.
[6]GAMMELGAARD B,GABEL-JENSEN C,STÜRUP S,et al.Complementary use of molecular and element-specific mass spectrometry for identification of selenium compounds related to human selenium metabolism [J].Anal Bioanal Chem,2008,390: 1691-1706.
[7]李应生,李亚男,陈大清.硒的生物学功能及植物的富硒机理[J].湖北农学院学报,2003,23(6):476-480.LI Yingsheng,LI Yanan,CHEN Daqing.Biological functions of selenium and the mechanism of selenium enrichment in plant[J].J Hubei Agric Coll,2003,23 (6): 476-480.
[8]HAWKESFORD M J,DAVIDIAN J C,GRIGNON C.Sulphate/H+co-transport in plasma membrane vesicles isolated from Brassica napus: increased transport in membranes isolated from suplhur-starved plants [J].Plants,1993,190: 297-304.
[9]SORS T G,ELLIS D R,SALT D E.Selenium uptake,translocation,assimilation and metabolic fate in plants [J].Photosynth Res,2005,86: 373-389.
[10]TERRY N,ZAYED A M,SOUZA M P,et al.Selenium in higher plants [J].Annu Rev Plant Physiol Plant Mol Biol,2000,51: 401-32.
[11]WARTBURTON E,GEONAGE-INFANTE H.Methane mixed plasma-improved sensitivity of inductively coupled plasma mass spectrometry detection for selenium speciation analysis of wheat-based food [J].J Analy Atomic Spec,2007,22: 370-376.
[12]KÁPOLNA E,SHAH M,JOSEPH A.et al.Selenium speciation studies in Se-enriched chives (Allium schoenoprasum)by HPLC-ICP-MS [J].Food Chem,2007,101: 1398-1406.
[13]SLEKOVEC M,GOESSLER W.Accumulation of selenium in natural plants and selenium supplemented vegetable and selenium speciation by HPLC-ICP-MS [J].Chem Spec Bioavailability,2005,17: 63-74.
[14]赵镭,杜明,张美莉,等.硒在富硒灵芝中的分布[J].中国食品学报,2005,5(4):119-123.ZHAO Lei,DU Ming,ZHANG Meili,et al.Selenium distribution in Se-enriched Ganoderma lucidum [J].J Chin Inst Food Sci Technol,2005,5 (4): 119-123.
[15]KUNLUN LIU,FUSHENG CHEN,YAN ZHAO,et al.Selenium accumulation in protein fractions during germination of Se-enriched brown rice and molecular weights distribution of Se-containing proteins[J].Food Chem,2011,127(4): 1526-1531.
[16]余芳,汪社英,方勇,等.富硒绿茶硒蛋白的提取工艺研究[J].南京农业大学学报,2008,31(4):140-143.YU Fang,WANG Sheying,FANG Yong,et al.Study on extraction of selenium-containing protein from selenium-enriched green tea [J].J Nanjing Agric Univ,2008,31 (4): 140-143.
[17]PEDRERO Z,MADRID Y.Novel approaches for selenium speciation in foodstuffs and biological specimens: a review [J].Anal Chim Acta,2009,634: 135-152.
[18]KÁPOLNA E,GERGELY V,DERNOVICS M,et al.Fate of selenium species in sesame seeds during simulated bakery process [J].J Food Eng,2007,79: 494-501.
[19]MAZEJ D,OSVALD J,VEKOSLAVA S.Selenium species in leaves of chicory,dandelion,lamb’s lettuce and parsley [J].Food Chem,2008,107: 75-83.
[20]SMRKOLJ P,STIBILJ V,KREFT I,et al.Selenium species in buckwheat cultivated with foliar addition of Se (VI)and various levels of UV-B radiation [J].Food Chem,2006,96: 675-681.
[21]DUMONT E,DEPAUW L,VANHAECHE F,et al.Speciation of Se in Bertholletia excelsa (Brazil nut): a hard nut to crack?[J].Food Chem,2006,95: 684-692.
[22]CANKUR O,YATHAVAKILLA SANTHA K V,CARUSO J A.Selenium speciation in dill(Anethum graveolens L.)by ion pairing reversed phase and cation exchange HPLC with ICP-MS detection [J].Talanta,2006,70: 784-790.
[23]仲娜,王小如,杨黄浩,等.高效液相色谱与电感耦合等离子体质谱联用技术用于胁迫富硒海带硒形态研究[J].高等学校化学学报,2008,29 (1): 77-80.ZHONG Na,WANG Xiaoru,YANG Huanghao,et al.Selenium speciation in enriched Laminaria japonica by HPLE-ICP-MS [J].Chem J Chin Univ,2008,29 (1): 77-80.
[24]PEDRERO Z,ELVIRA D,CÁMARA C,et al.Selenium transformation studies during broccoli(Brassica oleracea)growing process by liquid chromatography-inductively coupled plasma mass spectrometry (LC-ICP-MS)[J].Anal Chim Acta,2007,596: 251-256.
[25]VALE G,PEREIRA S,MOTA A,et al.Enzymatic probe sonication as a tool for solid-liquid extraction for total selenium determination by electrothermal-atomic absorption spectrometry [J].Talanta,2007,74 (2): 198-205.
[26]GÓMEZ-ARIZA J L,CARO DE LA TORRE M A,GIRÁLDEZ I,et al.Speciation analysis of selenium compounds in yeasts using pressurized liquid extraction and liquid chromatography-microwave-assisted digestion-hydride generation-atomic fluorescence spectrometry [J].Anal Chim Acta,2004,524 (1/2): 305-314.
[27]WUILLOUD J C,WUILLOUD R G,VONDERHEIDE A P.et al.Gas chromatography plasma spectrometry—an Important analytical tool for elemental speciation studies [J].Spectrochim Acta Part B,2004,59 (6): 755-792.
[28]JANÁANA J,BILLIET H A,FRANK J,et al.Separation of selenium analogues of sulphur-containing amino acids by high-performance liquid chromatography and high-resolution gas chromatography [J].J Chromatogr A,1994,677(1): 192-196.
[29]MOUNICOU S,VONDERHEIDE A P,SHANN J R,et al.Comparing a selenium accumulator plant (Brassica juncea) to a nonaccumulator plant(Helianthus annuus) to investigate selenium-containing proteins [J].Anal Bioanal Chem,2006,386:1367-1378.
[30]KÁPOLNA E,PETER R,KRISTIAN H,et al.Effect of foliar application of selenium on its uptake and speciation in carrot[J].Food Chem,2009,115: 1357-1363.
[31]雷绍荣,杨定清,周娅.硒的总量及形态分析综述[J].中国测试,2009,35(5):1-6.LEI Shaorong,YANG Dingqing,ZHOU Ya.Summary on total content determination and speciation analyses of selenium [J].China Meas & Test,2009,35 (5): 1-6.
[32]MOUNICOU S,MEIJA J,CARUSO J A.Preliminary studies on selenium-containing proteins in Brassica juncea by size exclusion chromatography and fast protein liquid chromatography coupled to ICP-MS [J].Analyst,2004,129 (2):116-123.
[33]ARVY M P.Selenate and selenite uptake and translocation in bean plants (Phaseolus vugaris)[J].J Exp Bot,1993,44: 1083-1087.
[34]徐芳,邱德仁,胡克季,等.硒的化学与生物形态分析综述[J].光谱学与光谱分析,2002,22(2):331-340.XU Fang,QIU Deren,HU Keji,et al.Review of chemical and biological speciation analyses for Se [J].Spectrosc Specl Anal,2002,22 (2): 331-340.
[35]KANNAMKUMARATH S S,WROBEL K,WUILLOUD R G.Studying the distribution pattern of selenium in nut proteins with information obtained from SEC-UV-ICP-MS and CE-ICP-MS[J].Talanta,2005,66 (1): 153-159.
[36]FAN T W,PRUSZKOWSKI E,SHUTTLEWORTH S,et al.Speciation of selenoproteins in Se-contaminated wildlife by gel electrophoresis and laser ablation-ICP-MS[J].J Anal At Spectrom,2002,17: 1621-1623.
[37]BEDNAR A J,KIRGAN R A,JONES W T.Comparison of standard and reaction cell inductively coupled plasma mass spectrometry in the determination of chromium and selenium species by HPLC-ICP-MS [J].Anal Chim Acta,2009,632: 27-24.
[38]GRANT T D,MONTES-BAYON M,LEDUC D,et al.Identification and characterisation of Se-methyl selenomethionine in Brassica juncea roots [J].J Chromatogr A,2004,1026 (1/2): 159-166.
[39]INFANTE H G,HEARN R,CATTERICK T.Current mass spectrometry strategies for selenium speciation in dietary sources of high-selenium [J].Anal Bioanal Chem,2005,382 (4): 957-967.

