水飞蓟宾及其类似物的化学修饰研究进展
刘 伟,余燕影,曹树稳,*
1南昌大学食品科学与技术国家重点实验室,南昌330047;2南昌大学化学系,南昌330031
水飞蓟宾及其类似物的化学修饰研究进展
刘 伟1,余燕影2,曹树稳1,2*
1南昌大学食品科学与技术国家重点实验室,南昌330047;2南昌大学化学系,南昌330031
以天然黄酮类化合物为活性先导物,研究其化学结构与生物活性的关系,进而进行化学修饰研究,是目前创新药物的一条重要思路。药用植物水飞蓟用来治疗肝胆疾病已有2000多年的历史,水飞蓟宾作为水飞蓟素的主要活性成分具有保肝、抗炎和抗癌等活性而备受人们关注,但由于水飞蓟宾极低的溶解性极大地限制了其生物利用度。为此,国内外学者通过化学和物理等方法对其进行修饰和改造,并取得了一定的成果。本文就近10年来水飞蓟宾及其类似物的化学修饰研究进行综述。
水飞蓟宾;类似物;化学修饰;构效关系
水飞蓟素(Silmyarin)是指从菊科药用植物水飞蓟种子的种皮中提取得到的一种黄酮木脂素类化合物,黄色粉末,味苦。主要的活性成分有水飞蓟宾(Silybin)、异水飞蓟宾(Isosilybin)、水飞蓟亭(Silychristin)和水飞蓟宁(Silydianin)等四种同分异构体[1,2],其中水飞蓟宾含量为50% ~70%[3],结构式最终由Lee等[4]确定(如图1)。水飞蓟用来治疗肝胆疾病已有2000多年的历史[6],水飞蓟素作为其主要的活性成分可以防止化学毒素、食物毒素和药物等对肝脏造成的损伤,促进肝细胞的再生和修复,被称为“天然的保肝药”[7-9];作为强抗氧化剂,能够清除人体内的自由基,延缓衰老[10]。近年来药效学研究表明,水飞蓟宾具有较强的抗癌和抗炎活性[11-13],它被广泛应用于医药、保健品、食品和化妆品等产品中。
然而,水飞蓟宾难溶于水(430 mg/L),吸收率在20%~50%之间,生物利用度低等特点[14],极大限制了其临床应用。鉴于水飞蓟宾的各种生物学功能与其结构的密切关系,国内外学者通过化学修饰的方法制备各种水飞蓟宾衍生物[15]及类似物,或采用结合载体[16,17]、包膜[18,19]以及固体分散体[20,21]等修饰方法,改善其溶解性,增强其疗效。本文拟从结构修饰和化学合成等方面,概述水飞蓟宾及其类似物的化学修饰和生物活性的研究进展。
1 水飞蓟宾及其衍生物
为增加难溶性药物的溶解性,通过修饰成盐、成酯或在主药分子结构上引入亲水基团形成亲水性大分子是常用的化学修饰方法。

图1 水飞蓟素主要活性成分的化学结构式[4,5]Fig.1 Chemical structures of the main active constituents in Silmyarin[4,5]
1.1 水飞蓟宾葡甲胺盐
将水飞蓟宾和有机胺反应制成有机胺盐,可将水飞蓟宾转变为水溶性制剂,是研究最早的水飞蓟素复盐之一。林建广等[22]采用差示扫描量热法分析合成物水飞蓟宾葡甲胺(7)的结构(如图2),并测定了其在25℃水中的溶解度。结果表明,化合物7以盐的形式存在,有别于水飞蓟宾与葡甲胺的简单混合,其溶解度为7182.50 mg/L,明显改善了水飞蓟宾在水中的溶解性能。有文献报道该药能够预防和治疗半乳糖胺所导致的肝损伤。该复合物还可制成冻干注射制剂、片剂、包合物等,用途较为广泛。临床试验表明该药具有作用快、疗效强等特点。

图2 水飞蓟宾葡甲胺结构式[22]Fig.2 Chemical structures of silybin meglumine[22]
1.2 水飞蓟宾的酯化修饰
1.2.1 水飞蓟宾-二偏琥珀酸酯及其钠盐
水飞蓟宾-二偏琥珀酸酯钠盐也是研究比较早的水溶性水飞蓟素复盐,具有强的抗肝损伤作用。Braatz等在上世纪80年代制得化合物9(如图3),其水溶性得到显著的改善,之后被用作治疗急性肝中毒的静脉注射剂而得以推广。该复盐能迅速地与羟基自由基起反应,具有清除活性氧的作用,对羟基自由基的清除作用强于对叔丁氧基自由基的清除作用[23]。朱琳等[24]将水飞蓟宾与丁二酸酐在碱性条件下反应,可以选择性地对水飞蓟宾分子中的醇羟基进行酯化,制得水溶性好的衍生物8和9。对产物进行抗急性肝损伤的研究表明,产物均可降低血清丙氨酸氨基转移酶(ALT)活性,对CCl4致小鼠急性肝损伤具有保护作用。

图3 水飞蓟宾酯化物结构式[24,25]Fig.3 Chemical structures of esterification silybin[24,25]
1.2.2 水飞蓟宾磷酸酯
Raffaello等[25]通过在分子中引入亚磷酸根等亲水性基团(如图3),制得化合物10和11,pH为4时即显示良好水溶性,而水飞蓟宾琥珀酸酯钠盐在更高的pH值时才开始溶解;相比之前有机酯类具有更好的化学稳定性。康怀萍等[26]在之后的试验中得到了相似的结论。
1.2.3 水飞蓟宾酰基化衍生物
Varga等[27]分析了水飞蓟宾及其衍生物对多形核白细胞(PMNLs)中过氧化氢生成和超氧阴离子释放的抑制作用,结果发现5,7,20-三甲基水飞蓟宾(13,如图4)抑制超氧阴离子的活性与维生素E相近,均大于水飞蓟宾及水飞蓟宾酰基化衍生物,活性顺序为:13≈VE>利肝隆 >12>水飞蓟宾>14;作者发现水飞蓟宾及其衍生物的抗氧化活与分子的立体结构与浓度等有密切关系;分子的亲油性增加,其抑制超氧阴离子释放作用也随之增强。朱琳等[28]将水飞蓟宾和冰醋酸在加热条件下,选择性地对水飞蓟宾分子中的醇羟基进行乙酰化,合成了23-O-乙酰水飞蓟宾和3,23-二-O-乙酰水飞蓟宾,产物脂溶性较好,以期增加其口服生物利用度。
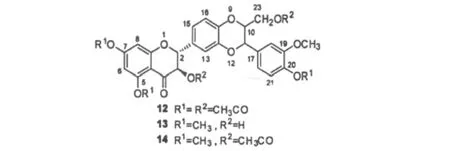
图4 飞蓟宾酰基化结构式[27]Fig.4 Chemical structures of acetylation silybin[27]
1.3 水飞蓟宾糖苷化修饰
糖苷化是对黄酮类化合物进行化学修饰的有效途径之一,它可改善黄酮类化合物的水溶性、稳定性、选择性,提高黄酮类化合物的药效[29]。捷克学者Kren等对水飞蓟宾糖苷化作了系统的研究,早期文献[30]报道了在水飞蓟宾的C-23-OH上引入不同的糖基(如图5)以增加其水溶性。结果显示,化合物16、18、21、23的水溶性分别为13.0、1.7、3.8、5.6 g/L,与水飞蓟宾(0.43 g/L)相比较,水飞蓟宾糖苷化衍生物的水溶性增加4~30倍;水飞蓟宾对乳酸脱氢酶的抑制作用为10%,引入糖基后化合物16的抑制作用为20%,化合物18为23%。随后,Kren所在课题组采用植物细胞培养法将水飞蓟素的C-7-OH进行糖苷化修饰,产物显示出较好的水溶性[31]; Kubisch等[32]采用环糊精葡聚糖转移酶催化合成了水飞蓟宾的C-23位低聚糖苷,复合物显示出较好的抗氧化活性;Kosnia等[33]对化合物16、18、21、23清除自由基和抗脂质过氧化活性进行了系统分析,结果显示,在防治小鼠肝线粒体膜中由叔丁基过氧化氢引起的脂质过氧化实验中,糖苷化衍生物比水飞蓟宾具有更好的效果,而且对于叔丁基过氧化氢引起的肝细胞和血红细胞的损伤,糖苷化衍生物比水飞蓟宾具有更好的保护作用。

图5 水飞蓟宾的β-糖苷结构[30,32]Fig.5 β-Glycoside structure of Silybin[30,32]
2 2,3-脱氢水飞蓟宾及其衍生物
2,3-脱氢水飞蓟宾(24,如图6)是水飞蓟素中的活性成分之一,含量甚微,不易分离得到。Gazka等[34]认为2,3-脱氢水飞蓟宾是水飞蓟宾的一种氧化产物,其对毒鹅膏毒素的抵抗力虽低于水飞蓟宾,但其抗氧化活性强于水飞蓟宾。Kurkin等[35]从水飞蓟中分离得到水飞蓟宾和2,3-脱氢水飞蓟宾,研究了它们对小鼠肝脏匀浆中由硫酸亚铁引起的脂质过氧化物的抑制作用,实验证明2,3-脱氢水飞蓟宾的抗氧化活性比水飞蓟宾高。这提示C环上2,3位双键与化合物的抗氧化活性有密切的关系。
2.1 2,3-脱氢水飞蓟宾烷基化衍生物
Maitrejean等[36]将水飞蓟宾的2和3位脱氢后在6或8位引入异戊烯基和香叶基(如图6),考察其对P-糖蛋白的核苷酸结合区(NBD2)的亲合能力。结果表明水飞蓟宾对NBD2的结合能力Kd= 6.8μM,氧化成脱氢水飞蓟宾以后结合能力增加(Kd=2.2μM),化合物27和28的亲和能力分别提高6倍和9倍,香叶基化后化合物25和26的亲合能力更进一步提高。实验结果预示脱氢水飞蓟宾的烷基化产物具有很强的NBD2亲合能力,有望开发为新的肿瘤多药耐药抑制剂。

图6 2,3-脱氢水飞蓟宾烷基化衍生物[36,37]Fig.6 Chemical structures of alkylation derivatives of 2,3-dehydrosilybin[36,37]
Perez-Victoria等[37]在Maitrejean之后也研究了水飞蓟宾类似物对P-糖蛋白的NBD2的亲合能力,得到了相似的结论;同时还合成化合物30、31、33、34,并将各化合物的NBD2亲合能力做了比较,结果如表1。

表1 不同化合物的NBD2亲合能力[37]Table 1 Binding afflnities of different compounds[37]
2.2 含羧基或酯基取代水飞蓟宾类似物
Gazka等[34]选择性地将水飞蓟宾的23位羟基氧化,得到水飞蓟酸,依据同样的方法将脱氢水飞蓟宾转化为脱氢水飞蓟酸,并检测了它们的抗氧化性,结果表明2,3-脱氢水飞蓟宾的清除超氧自由基活性是水飞蓟宾的25倍,清除脂质过氧化物活性是水飞蓟宾的10倍,但亲水性是水飞蓟宾的0.01倍。与脱氢水飞蓟宾相比,脱氢水飞蓟酸亲水性是前者的100倍,但抗氧化能力只有前者的十分之一。水飞蓟宾转化成水飞蓟酸以后水溶性提高10倍,但抗氧化活性降低一半。通过该研究初步探明了水飞蓟宾衍生物的抗氧化特性。

图7 含酯基取代水飞蓟宾类似物[39]Fig.7 Silybin analogues containing ester groups[39]
Plíšková等[39]通过体外基因分析研究了飞蓟宾类似物(如图7)的雌激素受体和芳香烃受体的介导活性。结果发现,这些化合物在大鼠肝癌细胞中对芳香烃受体的介导活性没有影响,除化合物36外,其余的水飞蓟宾衍生物没有调节雌激素受体介导的活性。有趣的是化合物37本身不具有雌激素样活性,当与17-β-糖二醇(E2)一起使用时却能加强E2调节雌激素受体介导的活性。作者总结出了水飞蓟宾及其类似物的结构活性关系,在23位引入羧基或者乙酰基团的脱氢水飞蓟宾没有雌激素活性,当用特戊酰代替23位的乙酰基团时,所得化合物表现出显著地雌激素活性。提示没有雌激素活性的水飞蓟宾衍生物有望成功用做化学预防药物。
2.3 2,3-脱氢水飞蓟宾甲氧基化衍生物
Dzubak等[40]合成了一系列的O-烷基-2,3-脱氢水飞蓟宾衍生物(如图8),发现化合物44、46~48在较低剂量时就表现出P-糖蛋白所介导药物外排的抑制活性;化合物24、41、42、45也能有效地抑制P-糖蛋白所介导药物外排,但同时对所测细胞系具有内在的细胞毒性;化合物43和49的抑制活性要弱于其母体。研究发现将2,3-脱氢水飞蓟宾的3,20位羟基甲基化或在C-7-OH上引入空间位阻大的苄基,所得衍生物对P-糖蛋白所介导药物外排的抑制活性得到明显的改善。2,3-脱氢水飞蓟宾的C-20-OH甲基化降低了细胞毒性,而在5或7位碳的羟基甲基或苄基化会导致细胞毒性高于母体2,3-脱氢水飞蓟宾。

图8 2,3-脱氢水飞蓟宾甲氧基化衍生物结构[40]Fig.8 Chemical structures of O-alkyl derivatives of 2,3-dehydrosilybin[40]
3 水飞蓟宾及其类似物的全合成制备
鉴于水飞蓟宾及其类似物具有很好的药理活性,为探明水飞蓟宾类化合物的活性构效关系,国内外一些学者对水飞蓟宾及其类似物进行了全合成研究。
3.1 水飞蓟宾的全合成
Merlini等首先报道了以分离得到的黄杉素(Taxifolin)和松柏醇(Coniferyl alcohol)为原料,在无水苯和无水丙酮中,用氧化银为催化剂,经氧化耦合合成了水飞蓟宾。反应产物中有将近一半是异水飞蓟宾。

李绍顺等[41]以查尔酮为原料,经不对称环氧化、手性HPLC柱分离、立体选择性环合得光学纯的2R 3R(+)黄杉素,然后在无水苯和无水丙酮中用碳酸银作催化剂,将所合成的黄衫素与松柏醇耦合得到水飞蓟宾和异水飞蓟宾的混合物。因松柏醇具有特殊的分子立体结构,在水飞蓟宾的合成中多采用其为原料,但经合成得到单一构型水飞蓟宾的反应少有报道。
3.2 Sinaiticin的全合成
Sinaiticin(51)是一种黄酮木脂素,活性实验表明它对动物体内淋巴白血球P-388细胞有强抑制作用。兰州大学潘鑫复教授所在课题组对水飞蓟宾类似物 Sinaiticin的合成进行了大量的研究。She等[42]在之前工作的基础上,以对羟基苯甲醛,咖啡酸为起始原料,先构筑二氧六环,再建造黄酮环化合物50,最终得到了Sinaiticin(51)。作者发现该合成路线(图9、10)具有操作简单、条件温和等优点,适用于各种苯并二氧六环新木脂素及黄酮木脂素的合成。
此外,该课题组以阿魏酸和3-羟基-4-苄氧基为起始原料,通过不对称双羟基化反应,分子内关环及Mistunbou反应,脱保护环合的方法制得单一绝对构型的产物。Gu等[43]认为通过这种方法有望合成单一构型的水飞蓟宾。


图11 Hydnocarpin-D和Hydnocarpin的合成Fig.11 Syntheses of Hydnocarpin-D and Hydnocarppin
3.3 Hydnocarpin类化合物的全合成
5'-Methoxyhydnocarpin(5'-MHC)是大风子油的微量组分,在麻疯病的传统治疗中起重要的作用。Stermitz等[44-46]研究发现5'-MHC本身不具有抗菌活性,当与小檗碱一起使用时,明显加强了小檗碱对金黄色葡萄球菌生长的抑制活性。Guz等[47]以木犀草素(Luteolin)和松柏醇为原料在不同的条件下分别合成了化合物52(Hydnocarpin-D)和53(Hydnocarpin),经检测两者为同分异构体(如图11)。为获得单一的5'-MHC-D(55),Guz等反复试验,最终通过有效地方法制得了中间体54,然后用氧化银为催化剂,与松柏醇氧化偶合合成了产物55(如图12)。
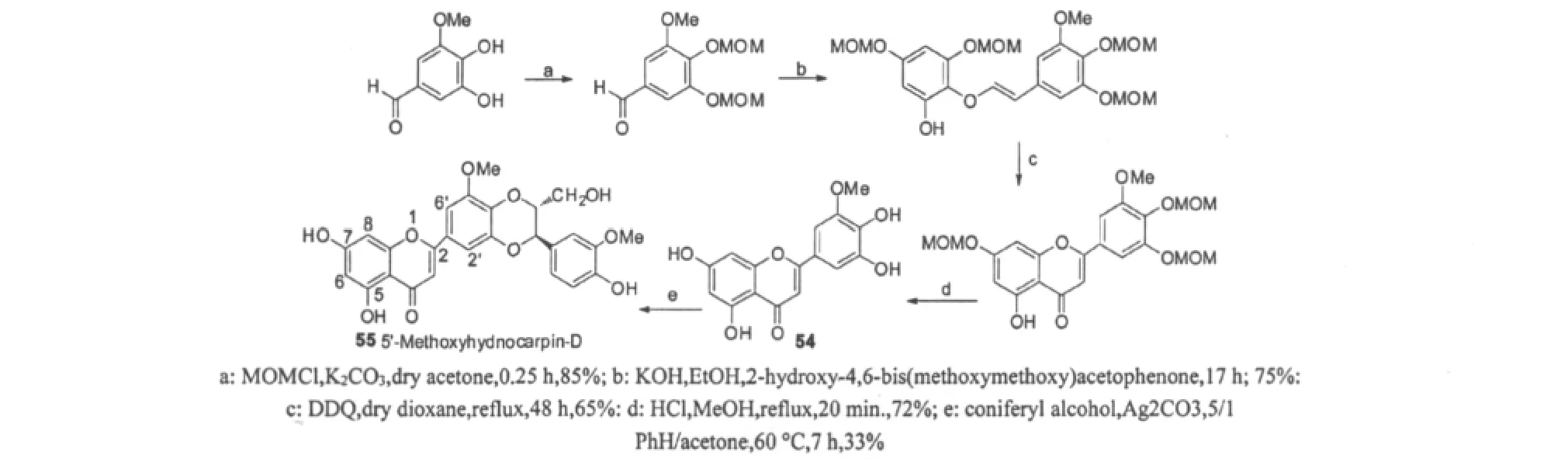
图12 5'-Methoxyhydnocarpin-D的合成[42]Fig.12 Synthesis of 5-Methoxyhydnocarpin-D[42]
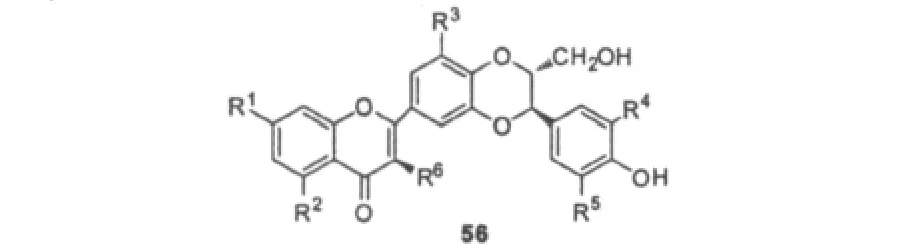
随后Guz等[48]又合成了一系列的水飞蓟宾类似物,并探索了在小檗碱存在下合成产物对金色葡萄球菌抑制作用的构效关系。研究结果显示合成产物的活性与天然产物木犀草素的活性相当或更强,当母体结构56的R1,R2为乙酰基或者氢时,化合物的抑菌活性较高。R3为甲氧基时活性降低,R6为羟基时,活性也降低。R4,R5的结构对于活性的影响起到很大的作用,当它们同时为甲氧基也使活性降低,同时为氢时则所得产物将失去活性。
3.4 新型水飞蓟宾类似物的合成
浙江大学赵昱教授课题组[49,50]对水飞蓟宾的B环或E环结构改造进行了大量研究,设计合成了8种不同的水飞蓟宾类似物(图13),并通过NBT还原比色法考察了它们的抗氧化活性。由表2可以看出化合物60具有很好的清除超氧自由基能力,其半抑菌浓度(IC50)为26.5 μM,而槲皮素IC50=38.1 μM;化合物58、61、64对两种自由基均显示出一定的清除作用。研究表明,在B环和E环上引入甲氧基将会提升水飞蓟宾类似物的清除超氧自由基能力,而只在E环引入甲氧基所得化合物的清除DPPH自由基能力将有所改善。

图13 8种新型水飞蓟宾类似物的合成[49]Fig.13 Synthesis of eight novel silybin analogues[49]

表2 57~64在40 μg/mL浓度下对超氧自由基和DPPH自由基的清除率(%)[49]Table 2 The clearance rate of 57-64 on superoxide anion and DPPH radicals at the concentration of 40 μg/mL (%)[49]
4 结束语
水飞蓟素或水飞蓟宾的部分生物活性在国际上仍有争议[51,52],但大量的研究表明,水飞蓟宾具有广泛的药理活性[53],其中多种活性已经显示出很好的开发潜力,这也预示了水飞蓟宾是一种具有极高研究价值的药用先导化合物。为改善其溶解性和药代动力学性质,对水飞蓟宾3位或23位羟基进行酯化或糖苷化等修饰,可明显改善水飞蓟宾的溶解性,但修饰后产物的生物活性较母体有所减弱;对母体各环结构修饰后的部分化合物表现出比水飞蓟宾更好的生物活性,尤其是2,3-脱氢水飞蓟宾衍生物显示出很好的清除自由基和抗脂质过氧化活性。因此,通过化学修饰筛选出高效低毒的水飞蓟宾衍生物及类似物,研究其在生物体内的作用机理及毒性和生物活性之间的关系,仍然是一项十分有价值和意义的研究工作。
1 Kvasnicka F,et al.Analysis of the active components of silymarin.J Chromatogr A,2003,990:239-245.
2 Kim NC,et al.Complete isolation and characterization of silybins and isosilybins from milk thistle(Silybum marianum).Org Biomol Chem,2003,1:1684-1689.
3 Dhiman RK,Chawla YK.Herbal medicines for liver diseases.Digest Dis Sci,2005,50:1870-1812.
4 Lee JI,et al.Separation and characterization of silybin,isosilybin,silydianin and silychristin in milk thistle extract by liquid chromatography-electrospray tandem mass spectrometry.J Chromatogr A,2006,1116:57-68.
5 Kr~en V,et al.Chemoenzymatic preparative separation of silybins A and B.J Mol Catal B:Enzym,2009,61:247-251.
6 Mayer KE,et al.Silymarin treatment of viral hepatitis:a sys-tematic review.J Viral Hepatitis,2005,12:559-567.
7 Fraschini F,et al.Pharmacology of Silymarin.Clin Drug Invest,2002,22:51-65.
8 Saller R,et al.The use of silymarin in the treatment of liver. Diseases Drugs,2001,61:2035-2063.
9 Ball KR,Kowdley KV.A review of Silybum marianum(milk thistle)as a treatment for alcoholic liver disease.J Clin Gastroenterol,2005,39:520-528.
10 Zhao J,et al.Inhibitory effect of a flavonoid antioxidant silymarin on benzoyl peroxide-induced tumor promotion,oxidative stress and inflammatory responses in SENCAR mouse skin.Carcinogenesis,2000,21:811-816.
11 Singh RP,Agarwal R.Flavonoid antioxidant silymarin and skin cancer.Antioxid Redox Sign,2002,4:655-663.
12 Singh RP,Agarwal R.Prostate cancer prevention by silibinin.Curr Cancer Drug Tar,2004,4:1-11.
13 Gerhauser C,et al.Mechanism-based in vitro screening of potential cancer chemopreventive agents.Mutat Res,2003,523-524:163-172.
14 Kr~en V,Walterová D.Silybin and silymarin-new effects and applications.Biomed Papers,2005,149:29-41.
15 Yang J(杨晋),et al.Adcances in the pharmaceutical research on the silymarin.Nat Prod Res Dev(天然产物研究与开发),2004,16:185-187.
16 Maheshwari H,et al.Preparation and pharmacological evaluation of silibinin liposomes.Arzneimittelforschung,2003,53: 420-427.
17 El-Samaligy MS,et al.Evaluation of hybrid liposomes-encapsulated silymarin regarding physical stability and in vivo performance.Int J Pharm,2006,319:121-129.
18 Kidd P,Head K.A review of the bioavailability and clinical efficacy of milk thistle phytosome:a silybin-phosphatidylcholine complex(Siliphos®).Altern Med Rev,2005,10:193-203.
19 Xiao YY,et al.The preparation of silybin-phospholipid complex and the study on its pharmacokinetics in rats.Int J Pharm,2006,307:77-82.
20 He J(何军),et al.Bioavailability of silymarin-loaded solid lipid nanoparticles.Chin Tradit Pat Med,2005,27:19-21.
21 Sun NY,et al.Enhanced dissolution of silymarin/polyvinylpyrrolidone solid dispersion pellets prepared by a one-step fluid-bed coating technique.Powder Technol,2008,182:72-80.
22 Lin JG(林建广),et al.Structure and solubility of silybin-N-meglumine.Nat Prod Res Dev(天然产物研究与开发),2009,21:214-216.
23 Mira L,et al.Scavenging of reactive oxygen species by silibinin dihemisuccinate.Biochem Pharmacol,1994,48:753-759.
24 Zhu L(朱琳),et al.Preparation and hepatoprotective effects inspection of silybin mono succinate.Asia-Pacific Tradit Med (亚太传统医药),2009,5:46-48.
25 Giorgi R,et al.US Patent 4 886 791,1989-12-12.
26 Kang HP(康怀萍),et al.Preparation and quality inspection of sodium 11-phosphate derivative of silymarin.Chin J Pharm(中国医药工业杂志),2004,35:71-72.
27 Varga Z,et al.Inhibition of the superoxide anion release and hydrogen peroxide formation in PMNLs by flavonolignans. Phytother Res,2001,15:608-612.
28 Zhu L(朱琳),et al.Selective synthesis of acylate Silybin. Syn Chem(合成化学),2009,17:262-264.
29 Hu X(胡昕),et al.Advances in glycosidation modification of flavonoids.Chem Res Appl(化学研究与应用),2007,19: 465-473.
30 Kren V,et al.Glycosylation of silybin.J Chem Soc Perkin Trans,1,1997,17:2467-2474.
31 Kren V,et al.Glucosylation of silybin by plant cell cultures of Papaver somniferum var.setigerum.Phytochemistry,1998,47:217-220.
32 Kubisch J,et al.Chemoenzymatic preparation of oligoglycosides of silybin,the flavonolignan from Silybum.Heterocycles,2001,54:901-915.
33 Kosina P,et al.Antioxidant properties of silybin glycosides.Phytother Res,2002,16:S33-S39.
34 Gažák R,et al.Oxidised derivatives of silybin and their antiradical and antioxidant activity.Bioorg Med Chem,2004,12: 5677-5687.
35 Kurkin VA,et al.Antioxidant properties of flavolignans from Silybum marianum fruits.Rastitel'nye Resursy,2003,39:89-94.
36 Maitrejean M,et al.The flavanolignan silybin and its hemisynthetic derivatives,a novel series of potential modulators of p-glycoprotein.Bioorg Med Chem Lett,2000,10:157-160.
37 Perez-Victoria JM,et al.High-affInity binding of silybin derivatives to the nucleotide-binding domain of a leishmania tropica KP-glycoprotein-like transporter and chemosensitization of a multidrug-resistant parasite to daunomycin.Antimicrob Agents Chem,2001,45:439-446.
38 Perez-Victoria JM,et al.Correlation between the affInity of flavonoids binding to cytosolic site of Leishmania tropica multidrug transporter and their effIciency to revert parasite resistance to daunomycin.Biochemistry,1999,38:1736-1743.
39 Plíšková M,et al.Effects of silymarin flavonolignans and synthetic silybin derivatives on estrogen and aryl hydrocarbon receptor activation.Toxicology,2005,215:80-89.
40 Džubák P,et al.New derivatives of silybin and 2,3-dehydrosilybin and their cytotoxic and P-glycoprotein modulatory activity.Bioorg Med Chem,2006,14:3793-3810.
41 Li SS(李绍顺),et al.Total synthes is of 2R 3R(+)-silybin as an antihepa toxic natural product.Chin J Med Chem (中国药物化学杂志),1997,7:107-111.
42 She XG,et al.Total Synthesis of(+)-Sinaiticin.Tetrahedron Lett,1999,40:4567-4570.
43 Gu WX,et al.First asymmetric synthesis of chiral 1,4-benzodioxane lignans.Tetrahedron Lett,2000,41:6079-6082.
44 Stermitz FR,et al.Synergy in a medicinal plant:antimicrobial action of berberine potentiated by 5'-methoxyhydnocarpin,a multidrug pump inhibitor.P Natl Acad Sci USA,2000,97: 1433-1437.
45 Stermitz FR,et al.5’-Methoxyhydnocarpin-D and pheophorbide A:berberis species components that potentiate berberine growth inhibition of sesistant staphylococcus aureus.J Nat Prod,2000,63:1146-1149.
46 Stermitz FR,et al.Staphylococcus aureus MDR efflux pump inhibitors from a Berberis and a Mahonia(sensu strictu)species.Biochem Syst Ecol,2001,29:793-798.
47 Guz NR,Stermitz FR.Synthesis and structures of regioisomeric hydnocarpin-type flavonolignans.J Nat Prod,2000,63: 1140-1145.
48 Guz NR,et al.Flavonolignan and flavone Inhibitors of a staphylococcus aureus multidrug resistance pump:structureactivity relationships.J Med Chem,2001,44:261-268.
49 Yang LX,et al.Synthesis and antioxidant evaluation of novel silybin analogues.J Enzym Inhib Med Chem,2006,21:399-404.
50 Gong JX,et al.Synthesis and antioxidant properties of novel silybin analogues.Chin Chem Lett,2006,17:465-468.
51 Saller R,et al.The use of silymarin in the treatment of liver diseases.Drugs,2001,61:2035-2063.
52 Jacobs BP,et al.Milk thistle for the treatment of liver disease:a systematic review and meta-analysis.Am J Med,2002,113:506-515.
53 Gazak R,et al.Silybin and silymarin-new and emerging applications in medicine.Curr Med Chem,2007,14:315-338.
Advances in Chemical Modification of Silybin and Its Analogues
LIU Wei1,YU Yan-ying2,CAO Shu-wen1,2*1State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China;2Department of Chemistry,Nanchang University,Nanchang 330031,China
On the basis of flavonoid lead compounds with biological activity,studying the relationship between structures and bioavailability and modifying their structures is an important means of innovation of new drugs.Silybum marianum (L.)Gaertn.has been used for more than 2000 years to treat liver and gallbladder disorders.Silybin,derived from the milk thistle plant,has
considerable attention due to its hepatoprotective,anti-inflammatory and anticancer effects,however,the bioavailability and therapeutic efficiency of silybin is rather limited by its very low solubility.To solve this problem,silybin is modified or altered via various chemical and physical methods by domestic and foreign scholars,and have obtained a certain achievement.In this paper,the chemical modification of silybin and its analogues in recent years are reviewed.
silybin;analogues;chemical modification;structure-activity relationships
1001-6880(2012)01-0124-09
2009-12-04 接受日期:2010-04-20
国家自然科学基金资助项目(20962014)
*通讯作者 Tel:86-791-83969610;E-mail:yuyanying@ncu.edu.cn
O629.9;O621.3
A

