几种检测弓形虫血清抗体方法的比较分析
刘 帅,王贝贝,崔丽丽,靳兴军,张 跃,沈光年,汪 明
(1.中国农业大学动物医学院 国家动物原虫实验室,北京 海淀100193;2.北京市兽医实验诊断所,北京 朝阳100101)
弓形虫是一种人畜共患的细胞内寄生原虫,在人和动物的各种有核细胞内都可寄生与繁殖。对人类健康和畜牧业生产均造成重大威胁。应用血清学技术检测特异的抗体仍然是诊断弓形虫感染的主要手段。但目前国内外商品化的检测试剂盒检测效能差异颇大,难以判定其真实性[1]。本实验室对国内间接血凝试验(IHA)、间接ELISA、SPA-ELISA 弓形虫IgG抗体检测试剂盒和本实验室自建的改良凝集试验(MAT)进行比较分析。
1 材料与方法
1.1 血清 2010年8月采自北京顺义与大兴区猪场的80份血清样本。由北京市兽医实验诊断所提供。
1.2 检测试剂和试剂盒 改良凝集试验(MAT)试剂由本实验室自制。参照Dubey[2]等人1987年发明的改良凝集试验方法,改进速殖子纯化条件,优化检测所需弓形虫速殖子抗原量,固定速殖子全虫为诊断抗原液。血清凝集效价1∶25以上者判为阳性。
间接血凝试验(IHA)试剂,购自中国农业科学院兰州兽医研究所。生产批号:20110529。
间接ELISA试剂盒,购自深圳康百得生物技术有限公司:猪弓形虫抗体检测试剂盒。生产批号:20110613。检测时所有血清分为两个稀释度1∶100与1∶200,称为ELISA-100,ELISA-200。
SPA-ELISA试剂盒,购自珠海海泰生物制药有限公司,动物弓形虫IgG抗体酶联免疫检测试剂盒。生产批号:20110501。
1.3 检测试验 采集的血清样本用上述试剂或试剂盒进行了平行检测,试验操作及结果判定按试剂盒说明书进行。
阳性样本标准:参照全国第二届弓形虫病学术讨论会(武汉,1993.11)推出的诊断方案[3],有3次或以上检测结果为阳性者判定为阳性标准样本。
1.4 评价指标 符合率:两种方法检测结果一致的样本数与检测总样本数之比;敏感性:对阳性标准样本检测为阳性的概率;特异性:对阴性样本检测为阴性的概率;检测效率:检测结果符合实际情况的样本数与总检测样本数之比;Youden指数:敏感性+特异性-1,Youden指数检验采用U检验式[4]。
2 结果
2.1 平行检测血清结果 平行检测80份样品,ELISA-100检出阳性57份;ELISA-200检出阳性21份;SPA-ELISA检出阳性21份;IHA检出阳性17份;MAT检出阳性18份。5次检测的血清阳性率分别为:71.3%,26.3%,26.3%,21.3%,22.5%。见表1。经χ2检验,ELISA-100检测血清抗体阳性率(71.3%)高于其他4种方法检测的血清阳性率(21.3%~26.3%),且差异极显著(P<0.01)。ELISA-200、SPA-ELISA、IHA、MAT 4种方法检测的血清阳性率之间无显著性差异(P>0.05)。
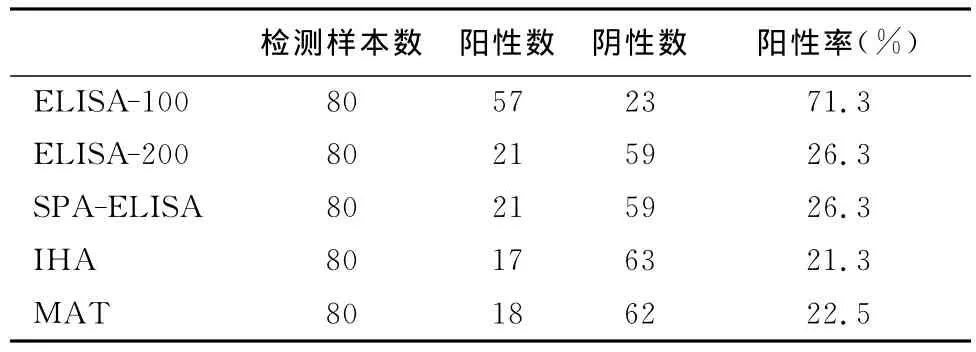
表1 平行检测猪血清结果
2.2 平行检测结果之间的符合率 平行检测的5次结果中,ELISA-100检测结果与其他检测结果符合率较低(<55%),其他4次检测结果相互之间的符合率都在70%以上,其中ELISA-200与IHA检测结果符合率最高,为87.5%。见表2。经配对卡方检验,ELISA-100与其他4种方法检测结果具有极显著差异(P<0.01)。ELISA-200、IHA、MAT、SPA-ELISA 4种方法检测结果两两之间无显著差异(P>0.05)。
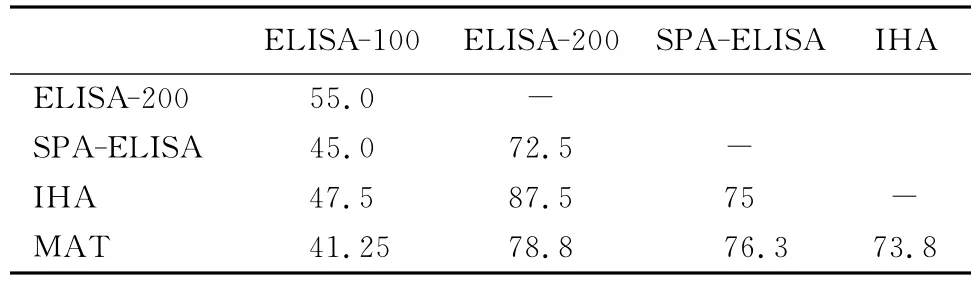
表2 5种方法检测结果符合率 (%)
2.3 各检测方法的敏感性、特异性、检测效率及Youden指数 在平行检测的80份血清样本中,符合阳性标准的样本共20份。5次检测中ELISA-200的敏感性(90%)、特异性(95%)和检测效率(93.75%)均在90%以上,Youden指数为0.85,显著高于其他4种方法。其次是IHA,敏感性稍低(50%),特异性和检测效率都达到90%以上,Youden指数属于中等。本实验室自建的MAT方法敏感性稍低(50%),特异性较好,为88.3%,检测效率为 81.25%,Youden指数为 0.483。SPAELISA敏感性、特异性和检测效率属于中等,Youden指数为 0.45;ELISA-100 敏感性高,为100%,但是特异性低,仅38.3%,检测效率和Youden指数显著低于其他方法。见表3。
3 讨论
随着对弓形虫研究的不断发展和深入,新的诊断技术不断被开发和建立,目前国内外弓形虫感染的诊断技术已经超过10多种,包括一些分子生物学诊断技术[5]。但由于弓形虫感染的特点,在弓形虫感染的诊断中,免疫学方法仍占有极重要的地位,MAT、ELISA、IHA都是广泛应用在弓形虫感染诊断和流行病学调查中的血清学方法。改良凝集试验(MAT)是20世纪80年代,Dubey和Desmonts建立的[2],是特异敏感的检测方法[6],迄今一直在欧美各国广泛应用于动物和人弓形虫病的流行病学调查[7-8]。间接血凝试验(IHA)操作简便快速,作为我国全国性的人、畜弓形虫病流行病学调查方法而被普遍使用。ELISA具有高敏感性和特异性、易于标准化,是目前诊断弓形虫发展最快、应用最广的技术[9]。
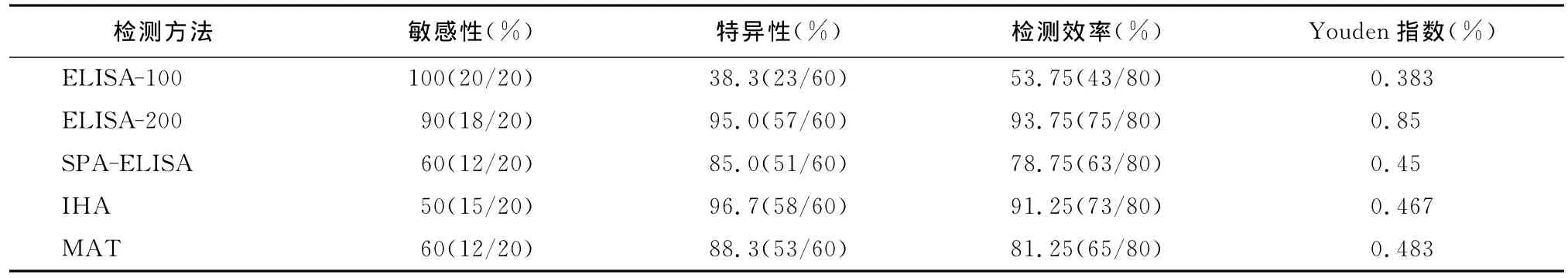
表3 5种方法的敏感性、特异性、检测效率和Youden指数
近来年弓形虫检测方法逐渐增多,市场上也有多家生产厂商的检测试剂盒产品,但我们前期的试验结果显示,不同检测方法,不同生产厂家,甚至不同生产批号的检测试剂盒检测的结果都有较大差异。张述义等人[1,10-12]对国内外一些检测试剂盒进行了比较分析,发现这些试剂盒检测结果也有显著差异。Mainar-Jaime等人的研究也指出,检测方法的差异大小随被检动物的不同而不同,需根据被检动物的不同而评估使用的检测方法[13]。因此我们在开展大规模的流行病学调查前必须对各种方法进行比对,从中选择检测效率相对高的方法开展普查,最大限度的使调查结果贴近真实。另外,对于阳性样品最好还要用另一种方法进行复核。
本试验选择3种市场中的弓形虫抗体检测试剂盒:深圳康百得的猪弓形虫抗体检测试剂盒,珠海海泰的动物弓形虫IgG抗体检测试剂盒,兰州兽医研究所的弓形虫间接血凝试剂盒,还有本实验室自建的改良凝集试验检测方法,对其进行了比较分析。
评价检测方法的指标除了常用的检测效率,还增加了Youden指数。Youden指数是分析敏感性和特异性的综合评价指标,可以避免对于敏感性和特异性的偏移,较客观的反映实际情况[4,14]。
深圳康百得猪弓形虫抗体检测试剂盒建议血清稀释倍数为100倍,但是在试验过程中我们发现,100倍稀释检测的结果与其他3种方法检测结果具有极显著性差异,检测效率和Youden指数显著低于其他方法,检测价值低。我们加大血清稀释倍数,改为200倍,检测结果与其他3种方法无显著性差异。敏感性,特异性和检测效率都到达90%以上,Youden指数达到0.85。可以用来进行大规模的流行病学调查和临床诊断。本实验室自建的MAT方法,与 ELISA-200,IHA,SPA-ELISA 平行检测血清样本,经配对卡方检验,与上述三种方法检测结果之间没有显著性差异。敏感性为60%,特异性高为88.3%,检测效率为81.25%,可为初步血清学筛查后核实阳性样本所用。
[1]何艳燕,蒋守富,马杏宝,等.国内外16种弓形虫诊断试剂盒的评估[J].旅行医学科学,2008(3):43-45.
[2]Dubey J P,Desmonts G.Serological responses of equids fed Toxoplasma gondii oocysts[J].Equine Vet J,1987,19(4):337-339.
[3]张述义,何艳燕,曹琳,等.检测弓形虫IgM抗体的3种试剂盒的比较分析[J].中国人兽共患病杂志,2001(3):72-74.
[4]陈平雁.诊断试验的评价指标及其应用[J].中国卫生统计,1991(5):53-57.
[5]王艳华,李学瑞,张德林,等.弓形虫病诊断方法研究进展[J].中国兽医寄生虫病,2008(1):28-33.
[6]Dubey J P.Validation of the specificity of the modified agglutination test for toxoplasmosis in pigs[J].Vet Parasitol,1997,71(4):307-310.
[7]Dubey J P,Thulliez P,Romand S,etal.Serologic prevalence of Toxoplasma gondii in horses slaughtered for food in North America[J].Vet Parasitol,1999,86(4):235-238.
[8]Garcia-Bocanegra I,Simon-Grife M,Dubey J P,etal.Seroprevalence and risk factors associated with Toxoplasma gondii in domestic pigs from Spain[J].Parasitol Int,2010,59(3):421-426.
[9]Hill D E,Chirukandoth S,Dubey J P,etal.Comparison of detection methods for Toxoplasma gondii in naturally and experimentally infected swine[J].Vet Parasitol,2006,141(1-2):9-17.
[10]蒋守富,张述义,潘彩娥,等.5种市售弓形虫抗体检测试剂盒的评价[J].中国人兽共患病杂志,2003(1):97-99.
[11]张述义,魏梅雄,王龙英,等.改良凝集试验(MAT)与间接血凝试验(IHAT)和酶联免疫吸附试验(ELISA)检测弓形虫抗体的比较分析[J].寄生虫与医学昆虫学报,2001,8(4):199-203.
[12]牛安欧,冯友仁,刘文琦.几种弓形虫ELISA试剂盒初步检测结果比较[J].中国人兽共患病杂志,2000(4):56-58.
[13]Mainar-Jaime R C,Barberan M.Evaluation of the diagnostic accuracy of the modified agglutination test(MAT)and an indirect ELISA for the detection of serum antibodies against Toxoplasma gondii in sheep through Bayesian approaches[J].Vet Parasitol,2007,148(2):122-129.
[14]陈平雁,王斌会,莫一心.几种诊断试验统计方法的比较[J].中国卫生统计,1995(5):8-11.

