洛汀新对5/6肾切除大鼠肾脏保护作用及对转化生长因子-β1表达的影响
王红月,顾春梅,赵 颖,崔明姬
(吉林大学第一医院 肾病科,吉林 长春130021)
肾间质纤维化是各种慢性肾脏病进展至终末期肾衰的共同病变过程,研究如何减缓其进展对保护肾功能具有重大的临床意义。5/6肾切除大鼠模型造模是研究肾小管间质损害的理想模型[1]。血管紧张素Ⅱ(AngⅡ)作为一种血管活性物质可引起肾脏血流动力学异常,但近年来人们更加关注它引起的肾脏疾病进展的非血流动力学机制,目前认为AngⅡ是一种促生长因子,在肾小球硬化及肾小管间质纤维化过程中起十分重要的作用。本研究主要探讨血管紧张素转化酶抑制剂洛汀新是否能改善5/6肾切除动物的肾脏损害,以及这种改善作用是否与抑制TGF-β1蛋白表达有关。
1 材料与方法
1.1 实验动物及分组 选取清洁wistar雄性大鼠10-12W 体重220-250g(236±24g)24只,由吉林大学实验动物中心提供,普通饲料喂养,室温20-24℃。大鼠随机分为4组:即空白对照组(Ctrl):6只,假手术组(Sham):6只,5/6肾切除组(Model):6只,洛汀新治疗组(Loten):6只。
1.2 动物模型的建立 采用2%戊巴比妥钠经腹腔注射麻醉大鼠,选取背左侧切口,暴露左肾,剥离肾包膜,将肾的上下极各1/3切除,无菌线结扎止血。第一次手术后7天,行第二次手术,右侧背部切开暴露右肾,结扎肾蒂,摘除右肾。假手术组与5/6肾切除组动物同期进行二次手术,但仅剥离肾包膜暴露肾脏后关腹。
1.3 治疗途径 Loten组洛汀新按0.6mg/100g/day的剂量与20ml水混合以水溶饮饲方法给药,其余3组予以等量水于同样的时间饮饲,从第二次术后第一天开始给予,连续5周。
1.4 动物的处死及标本的采集 于第二次手术后第5周处死动物,处死前1天将大鼠置于代谢笼中(禁食,不禁水),收集24h尿液测尿量。处死时从下腔静脉取血置于非抗凝试管备各项检查;取左肾组织,一部分放于液氮中保存备用,另一部分组织置于10%中性福尔马林溶液中固定,石蜡包埋。
1.5 标本的处理以及生化、病理指标的检测
1.5.1 血、尿生化指标的测定 全自动生化仪(Ol ympus AU5400)检测24h尿蛋白定量、血浆白蛋白、血清肌酐及尿素氮。
1.5.2 肾组织病理标本制备及评价方法 肾组织经10%中性福尔马林溶液固定、包埋,切成3μm厚石蜡切片,做苏木素-伊红(HE)染色,对小管间质损伤程度进行评分。肾小管间质损伤程度评分:每份标本在100倍光镜下随机检查10个不重复肾小管间质区,按肾小管萎缩、间质炎细胞浸润和纤维化的范围,分别按下述4级半定量评分进行评分,3项评分的累加得分即为肾小管间质损伤程度。1分:无肾小管间质损伤;2分:肾小管间质损伤范围<25%;3分:肾小管间质损伤范围25%-49%;4分:肾小管间质损伤范围>50%。
1.5.3 肾组织标本免疫组织化学染色及评分标准标本用中性福尔马林固定,自动脱水,浸蜡,包埋,切片;再系列脱蜡脱水;3%H2O2孵育25min,阻断内源性过氧化物酶,PBS洗5min×3;正常羊血清封闭;滴加TGF-β1兔抗人多克隆抗体(1∶50稀释浓缩型抗体),室温1h,PBS 5min×3;再滴加生物素化的羊抗兔IgG,37℃30min,PBS洗5min×3;然后滴加辣根过氧化物酶(HRP)标记的亲和素,37℃30min,PBS洗5min×3;DAB显色;用蒸馏水终止反应;苏木素复染核;酒精逐级脱水,树胶封片。用显微镜下观察肾组织中TGF-β1表达情况,照相。免疫组化半定量评分:按染色区大小和染色强度分为:0分:无染色或染色极弱;1分:局部弱染色,染色区<25%;2分:局部染色趋强,染色区25%-49%;3分:染色增强,染色区50%-75%;4分:强染色,染色区>75%。
1.6 统计分析
数据资料用±s表示,采用SPSS 13.5统计软件处理。组间差异采用单因素方差分析,P<0.05有统计学意义。
2 结果
2.1 生化指标检测 Ctrl及Sham组指标无统计学差异(P>0.05),说明假手术对实验结果无影响。Model组BUN、CRE及24小时UPE较Ctrl组升高,有统计学意义(P<0.05);Loten组与 Model组比较,BUN、CRE低于 Model组(P<0.0 5);24小时UPE降低明显(P<0.0 1)。Model组血白蛋白较Ctrl组降低,有统计学意义(P<0.05);Loten组与Model组比较升高,但无统计学意义(P>0.05)(见表1)。

表1 洛汀新对5/6肾切除大鼠ALB,BUN,CRE and UPE的影响
2.2 肾组织病理学检查 肾组织HE染色见图1(A)。Ctrl及 Sham组:肾小管及间质基本正常;Model组:肾间质增宽,呈大灶状损害,间质炎细胞浸润,纤维组织沉积部分肾小管萎缩、消失。Loten组:较Model组的病变减轻,可见灶状间质炎细胞浸润和纤维化,肾小管萎缩。肾小管间质损伤评分见图1(B),Model组评分较Ctrl组明显升高,有统计学意义(P<0.05);Loten组与 Model组比较降低,有统计学意义(P<0.05)。
2.3 免疫组化分析肾小管间质TGF-β1的表达TGF-β1的免疫组化染色见图2(A),TGF-β1阳性表达主要见于病变区肾小管上皮细胞胞质及肾间质。免疫组化半定量评分见图2(B),Model组表达最强,Loten组减弱。
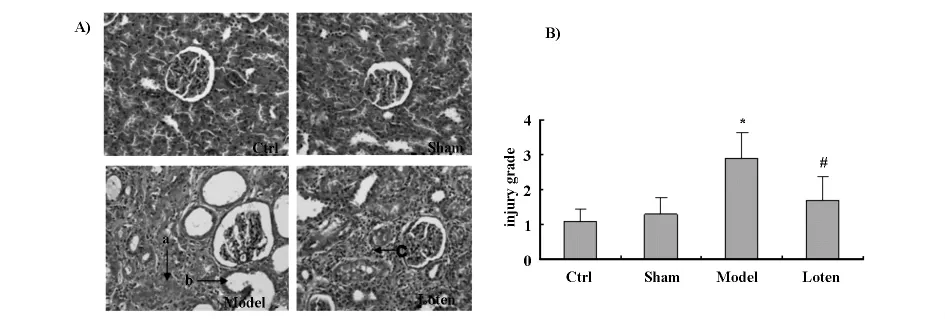
图1 (A)各组大鼠组织形态学变化(HE染色X200);(B)各组大鼠肾间质损伤评分
3 讨论
肾间质纤维化是导致终末期肾衰的病理学基础,其机制认为是由于纤维化有关的细胞因子,尤其是TGF-β1参与炎性损伤而导致成纤维细胞增值的结果。慢性间质性肾炎的动物模型为研究肾间质纤维化发病机制及其干预措施能够提供有效的手段。5/6肾切除动物模型造模方法比较简便,5/6肾切除后,有效肾单位减少,形成剩余肾小球高灌注、高灌注及高压力,最终导致慢性肾衰竭,比较符合人类慢性间质性肾炎的肾小管间质损害的病理改变过程。有研究证实5/6肾切除后第1周已出现血尿素氮及肌酐升高,16周内稳定于氮质血症期,且肾切后尿蛋白升高[1,2],因此是研究肾小管间质损害导致慢性肾衰竭的理想动物模型。
肾素-血管紧张素系统(RAS)是机体进化过程中高度保守的网络,AngII在各种肾脏疾病的慢性化过程中发挥重要的作用,是公认的致肾损害的因子。血管紧张素转化酶抑制剂对肾脏有确切保护作用[3,4],且已广泛用于临床,关于血管紧张素转化酶抑制剂的肾脏保护作用的机制一直是近年来研究的热点。有研究提示,AngII可能涉及细胞外基质在肾脏的沉积,输注AngII可导致间质纤维化,而应用血管紧张素转换酶抑制剂可减少胶原的沉积[5]。Wolf等[6]研究发现,AngII可刺激肾小管上皮细胞产生TGF-β1。ACEI可降低大鼠梗阻性肾病模型的TGF-β1和Ⅳ型胶原 mRNA水平[7]。但 ACEI类药物洛汀新是否对5/6肾切除大鼠的肾脏损害有保护作用以及是否与降低TGF-β1的蛋白表达有关,目前这方面的研究很少,我们的实验主要探讨这一问题。
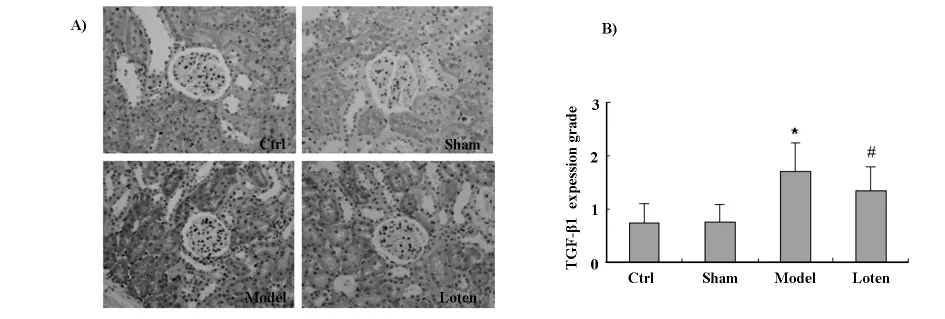
图2 (A)各组大鼠TGF-β1表达(免疫组化X200);(B)免疫组化半定量分析
我们的实验结果显示,从生化及肾组织病理学方面,Ctrl组和Sham组无统计学差异,表明假手术对实验结果无影响。Loten组和Model组,术后第5周与Ctrl组比较,血尿素氮和肌酐升高,24小时尿蛋白增加,血浆白蛋白下降,其中Loten组与Model组比较变化相对较小,说明5/6肾切除大鼠第5周可出现慢性肾功能不全,与既往报导一致[3]。肾脏病理光镜HE染色显示,Ctrl组和Sham组肾小管及间质基本正常,Loten组和Model组肾间质大灶状损害,间质可见炎细胞浸润,纤维组织沉积,部分肾小管萎缩、消失,其中Loten组与Model组比较病变相对较轻,说明5/6肾切除大鼠第5周肾间质纤维化明显,且RSA系统可能参与肾小管间质纤维化的病变过程。
TGF-β1作为介导肾间质纤维化的关键因子,刺激肾小管上皮细胞向肌成纤维细胞转分化。我们的研究结果显示,5/6肾切除大鼠第5周TGF-β1蛋白表达明显上升,且TGF-β1阳性表达主要见于病变区肾小管上皮细胞胞质及肾间质,免疫组化半定量评分结果显示,Model组表达最强,Loten组与 Model组比较相对减弱,由此我们认为5/6肾切除后大鼠TGF-β1的过度表达参与了肾间质纤维化的病变过程,最终至慢性肾衰竭,血管紧张转换酶抑制剂洛汀新有减少TGF-β1表达的作用,与生化及肾组织病理学变化相吻合。提示血管紧张转换酶抑制剂可能阻断RSA系统的激活,减少肾脏成纤维细胞中TGF-β1的生成,保护肾功能。本研究认为TGF-β1与5/6肾切除大鼠肾间质纤维化的关系提供了新的实验依据,阐明了洛汀新在治疗肾间质纤维化的意义。相信随着研究的深入,血管紧张转换酶抑制剂在肾脏疾病治疗中的作用机制将会进一步明确,为临床提供新的思路和方法。
[1]SHEN Yanchun,et al.Renal Pathological Changes in Rats with 5/6Nephrectomy[J].Shanghai Laboratory Animal Science,2005,25(1):21.
[2]Barata K,Yoshida M,Hokao R,et al.Function in 5/6nephrectomized rats-basic study for renal toxicity using 5/6nephrectomized rats[J].J Toxicol Sci,1998,23(5):433.
[3]Ihle BU,Whitworth JA,Shahinfar S,Cnaan A,et al.Angiotensinconverting enzyme inhibition in nondiabetic progressive renal insufficiency:a controlled double-blind trial[J].Am J Kidney Dis,1996,27:489.
[4]Hou FF,Zhang X,Zhang GH,et al.Efficacy and safety of benazepril for advanced chronic renal insufficiency[J].N Engl J Med,2006,354:131.
[5]Wolf G.Angiotensin II is involved in the progression of renal disease:importance of non-hemodynamic mechanisms[J].Nephrologie,1998,19:451.
[6]Wolf G,Mueller E,Stahl RAK,et al.Angiotensin II induced hypertrophy of cultured murine proximal tubular cells is mediated by endogenous transforming growth factor-β1[J].J Clin Invest,1993,92:1366.
[7]Pimentel Jr,Sundell CI,Wang S,et al.Role of angiotensin II in the expression and regulation of transforming growth factor-β1in obstructive nephropathy[J].Kidney Int,1995,48:1233.

