毛竹半纤维素热解特性研究
余紫苹 彭 红 林 妲 胡铮瑢 王 娜 张锦胜 刘玉环 阮榕生
(南昌大学生物质转化教育部工程研究中心,江西南昌,330047)
毛竹半纤维素热解特性研究
余紫苹 彭 红 林 妲 胡铮瑢 王 娜 张锦胜 刘玉环 阮榕生
(南昌大学生物质转化教育部工程研究中心,江西南昌,330047)
采用蒸馏水、2%NaOH和5%KOH从6月龄毛竹竹竿中分级抽提得到水溶性半纤维素HW和碱溶性半纤维素H1~H4。通过热重分析法在升温速率10℃/min条件下分析了这5种半纤维素的热解特性,并对快速热解区建立了一级反应动力学模型。毛竹半纤维素热解主要发生在180~400℃,失重33.91% ~42.54%。在终止温度700℃时残渣率均较高,达到34.52% ~51.31%。毛竹半纤维素组分活化能均较小,为26.068~51.938 kJ/mol。碱溶性组分的活化能大于水溶性组分的活化能,残留木素越多,半纤维素的活化能和终止温度时的残渣率就越高。
毛竹竹竿;半纤维素;热重分析法;热解特性
目前竹子的工业化利用率不高,加工下脚料比例高达50%~70%,是潜在的、重要的可以能源化利用的生物质资源。已有研究者研究了不同农林废弃物的生物质热裂解技术,并且探索了其裂解反应的动力学模型[1-3],而对毛竹生物质资源方面的研究较少,从而使毛竹资源的综合利用缺乏理论依据,限制了毛竹资源的工业化利用。杜瑛等人[4]对毛竹的初步热解表明,所得的主要低分子液体产物均高于稻壳、木屑,还可获得用途广泛的抗氧化剂2,6-二叔丁基-4-甲基苯酚 (BHT),可见毛竹热解具有其独特的优势。因为木质纤维生物质主要是由纤维素、半纤维素和木素组成,生物质热解过程中这3种组分相互作用共同决定生物质资源的热解反应,这也使得此类生物质的热解是个复杂的物理化学反应过程,因此通过单一组分的热解研究探索毛竹资源热解反应过程显得尤为重要。但是由于高纯度半纤维素不易分离获得,且结构复杂,因此关于半纤维素单一组分的热裂解动力学的研究比较少。Shen D K等人[5]采用聚木糖,O-乙酰基聚木糖和4-O-甲基葡萄糖醛酸聚木糖为模型研究半纤维素的热解特性,但这些模型物和实际提取的半纤维素化学结构等方面有很大区别。本实验针对6月龄毛竹竹竿,采用蒸馏水和不同浓度碱液分级分离提取半纤维素,并利用TGA热重分析法对比研究了各毛竹半纤维素组分在恒定升温速率条件下的热解特性。
1 材料与方法
1.1 材料与试剂
6月龄毛竹原料采集于南昌梅岭官溪村当地天然竹林。取竹竿部分,晒干后切成小片 (1~3 cm),用高速粉碎机粉碎,收集40~100目筛之间的部分,干燥,储于密封塑料袋中备用。
KBr为光谱纯,其他试剂均为分析纯。
1.2 主要仪器设备
高速中药粉碎机,瑞安市环球药械厂;DHG-9036A电热恒温鼓风干燥箱,上海精密实验设备有限公司;电热恒温水浴锅,上海亚荣生化仪器厂;TDL-5000B大容量离心机,上海安亭仪器厂;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;Sartorius电子天平,北京赛多利斯仪器系统公司;ALPHAI-2冷冻干燥机,德国Martin Christ;320-S pH计,梅特勒-托利多仪器 (上海)有限公司;Nicolet 5700傅里叶变换红外光谱仪 (FT-IR),美国热电尼高力公司;同步热分析仪,美国PE公司。
1.3 实验方法
1.3.1 半纤维素的提取[6-7]
毛竹竹竿粉末经苯-醇溶液抽提脱除蜡质和色素等杂质,利用亚氯酸钠法脱木素后用大量蒸馏水冲洗至中性,干燥后得到综纤维素。综纤维素分别用蒸馏水、2%NaOH、5%KOH进行分级抽提,得到水溶性半纤维素HW和4种碱溶性半纤维素H1~H4。所有半纤维素经冷冻干燥后进行分析。具体抽提工艺流程见图1。
1.3.2 中性糖组成分析
半纤维素20 mg用3.0 mol/L三氟乙酸 (15 mL)在120℃水解3 h,同时要充入N2封口,油浴加热。然后加入适量无水乙醇,45℃减压蒸馏除去三氟乙酸(常压下沸点72.4℃),如此反复3次,蒸馏至残余物pH值至6~7。水解物充分干燥后,进行硅醚化:产物溶于2.0 mL经无水硫酸钠脱水的无水吡啶中,50℃加热并振荡使含糖降解产物溶解,加入0.8 mL三甲基氯硅烷和1.6 mL六甲基二硅氮烷,振荡使之混合均匀,然后在50℃下反应1 h,冷却,加入无水硫酸钠进一步脱水,静置,取上层液体离心,然后通过GC-MS分析中性糖组成。

图1 6月龄毛竹竹竿半纤维素分级抽提工艺流程
GC-MS条件 色谱柱HP-5ms(30 m×0.25 mm×0.25 μm),进样口温度260℃,进样量 0.2 μL,离子源230℃,升温程序:起始温度100℃,以6℃/min升温至260℃,保留5 min。自动进样,不分流,载气为氦气,EI源。
1.3.3 糖醛酸含量分析
总糖醛酸含量采用间羟基联苯法进行测定[8-9]。
1.3.4 红外光谱 (FT-IR)特征分析
冷冻干燥后的半纤维素 (1 mg)与KBr混合压片,用Nicolet 5700傅里叶变换红外光谱仪在400~4000 cm-1进行扫描测定。
1.3.5 核磁共振 (NMR)分析
利用1H NMR、13C NMR分析了半纤维素H3的空间构成情况。样品制备:分别称取20、80 mg样品于核磁专用管中,溶于1 mL六氘代二甲基亚砜 (DMSO-d6),分别用于1H NMR、13C NMR分析。核磁条件:Bruker MSL 300光谱,600 MHz,室温下扫描30000次,60°的脉冲翻转角,3.9 μs的脉冲宽度和0.85 s的采集时间。
1.3.6 热重实验
半纤维素5~15 mg置于标准陶瓷坩埚中,在N2氛围中从室温升至700℃,恒定升温速率为10℃/min,获取不同组分的热重 (TG)及微分热重 (DTG)数据。
2 结果与讨论
2.1 半纤维素中性糖和糖醛酸分析
分离得到的5种半纤维素组分的中性糖和糖醛酸组成及含量如表1所示。从表1可知,所有半纤维素组分都含有木糖、阿拉伯糖、核糖和糖醛酸,且木糖和阿拉伯糖含量之和均超过91%,说明毛竹半纤维素主要是由木糖和阿拉伯糖组成,半纤维素的主要成分可能是聚阿拉伯木糖。另外,所有半纤维素组分都含有少量的核糖,含量占0.91% ~2.33%;除水溶性半纤维素HW外,4种碱溶性半纤维素还含有一定量的半乳糖;当溶液pH值降低至5.5时,仍能溶解的碱溶性半纤维素组分H3和H4同时还含有少量的甘露糖和葡萄糖。阿拉伯糖与木糖比值可以说明半纤维素的支链情况,比值越大,支链越多。

表1 半纤维素组分的中性糖和糖醛酸组成 %
2.2 FT-IR分析
分级分离所得毛竹竹竿半纤维素的FT-IR谱图如图2所示。所有组分均具有半纤维素的典型特征FT-IR吸收峰。3422 cm-1处强吸收峰由—OH的伸缩振动产生,2932 cm-1处是 C—H的伸缩振动,1644 cm-1处是吸附水的振动峰。1735 cm-1处是酯键的特征峰,如乙酰基、糖醛酸和阿魏酸酯键等,而4种碱溶性半纤维素在此处的吸收峰消失,说明在碱作用下酯键断裂[10]。1417、1376、1322、1245 cm-1处是C—H、C—C、—OH或—CH2弯曲振动或伸缩振动产生的吸收峰[11-12]。1200~1000 cm-1处是环上C—OH和C—O—C的振动谱带区,1048 cm-1处强吸收峰是聚阿拉伯木糖的特征吸收峰,来源于糖苷键C—O—C中 C—O的伸缩振动。1121 cm-1和982 cm-1处吸收峰是侧链阿拉伯糖基的特征峰[13]。且982 cm-1处振动吸收峰的存在说明阿拉伯糖基连接在木糖基 O3位[14]。899 cm-1处吸收峰是 β-糖苷键的特征吸收峰,说明木糖单元之间通过β-键连接形成主链[15]。另外,1508~1511 cm-1处是残留木素的芳香环骨架振动吸收峰,该峰的强度与木素含量多少有关,从图2可以看出,HW中没有明显木素残留,H1和 H2残留木素比 H3和 H4多[16-17]。从FT-IR谱图来看,通过该实验流程分离得到的半纤维素结构符合禾本科植物半纤维素结构的典型特征,主要由聚阿拉伯木糖组成,各组分间结构相似,但支链存在一定差异,可以通过研究半纤维素的热解特性为全面了解毛竹资源的热裂解反应特性提供理论依据。
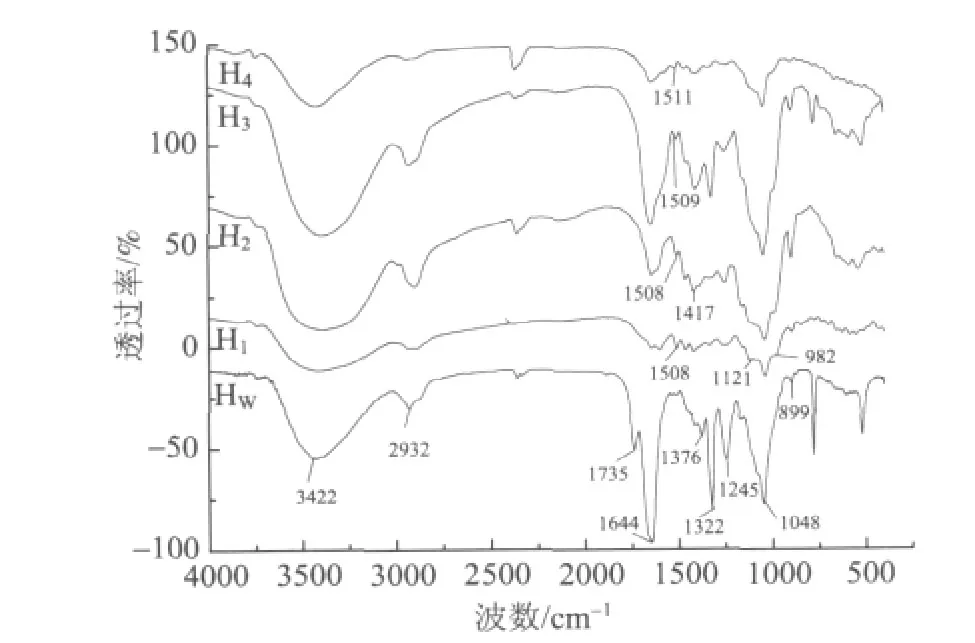
图2 半纤维素组分FT-IR谱图
2.3 NMR分析
以半纤维素组分H3为代表,利用1H NMR、13C NMR进一步分析鉴定其结构,结果如图3和图4所示。
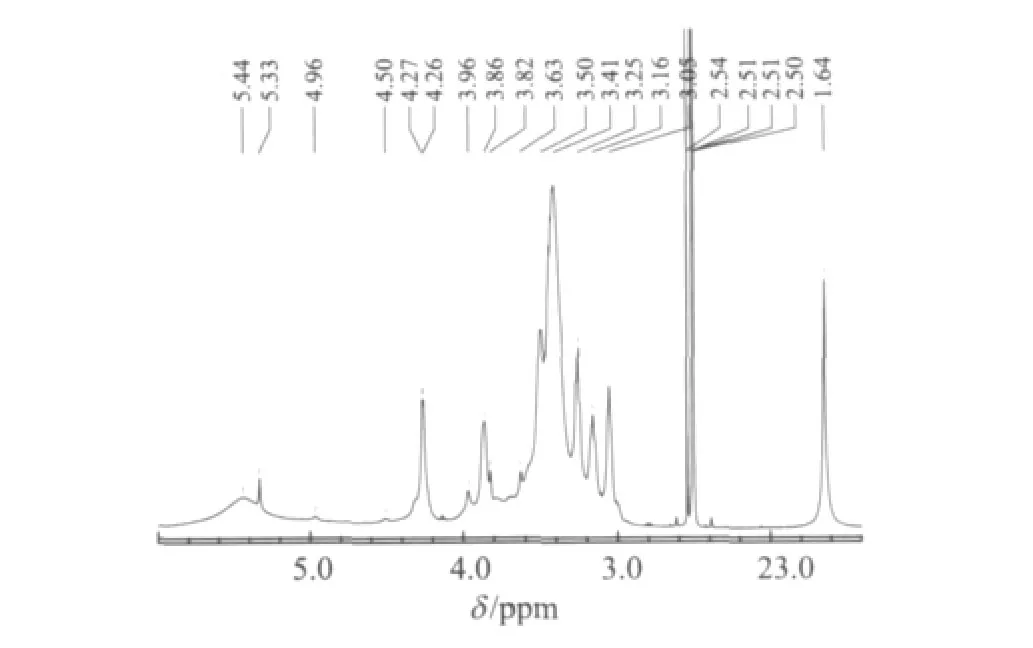
图3 半纤维素H3组分1H NMR谱图(溶剂为DMSO-d6)
在图3中,5.33 ppm处是与聚木糖O3位相连的阿拉伯糖末端基质子的共振吸收峰[18];4-O-甲基-α-D-葡萄糖醛酸的端基质子峰出现在4.96 ppm 处[19],说明阿拉伯糖和葡萄糖醛酸可能以短侧链的形式与主链聚木糖相连。4.27 ppm和4.26 ppm处的双峰是木糖基的β端基C1位质子的共振峰;3.41 ppm处是4-O-甲基-α-D-葡萄糖醛酸的甲基质子峰[20];阿拉伯糖和木糖残基的其他质子峰出现在3.0~4.0 ppm区域内[21];残留的乙酸盐的乙酰基的甲基质子共振峰出现在1.64 ppm 处[22];2.51 ppm 处的强峰是溶剂 DMSO-d6的质子峰。

图4 半纤维素H3的13C NMR谱图(溶剂为DMSO-d6)
在图4 中,39.39 ppm 处是溶剂峰,101.65、75.15、73.89、72.45 和 63.23 ppm 处分别是 β-(1→4)-D-吡喃木糖中C1、C4、C3、C2和C5的振动峰[23],80.24、77.74、61.76 ppm 处分别是 α-L-呋喃阿拉伯糖C2、C3、C5的振动峰,175.7 ppm处是葡萄糖醛酸基C6的振动峰[24],25.2 ppm处是来源于残留乙酸盐上的的甲基振动峰。
由中性糖分析和核磁共振分析可知,通过该流程分离的半纤维素主要是聚葡萄糖醛酸阿拉伯木糖。




2.4 半纤维素热解特性分析
图5~图9是毛竹竹竿水溶性半纤维素和碱溶性半纤维素的TG及DTG曲线图,表2是各热解区间失重特征参数。失重率 (α)表示为:

式中,m0和m∞分别为样品的初始质量和热解终点质量。
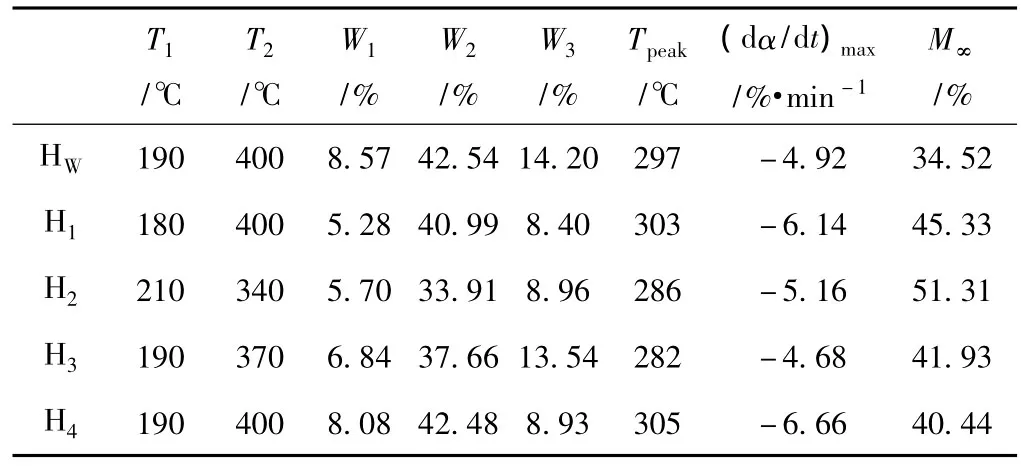
表2 各热解区间失重特征参数
从图5~图9可以看出,所有半纤维素组分热解过程大致可分为3个区间。第一区间从室温到分解点温度T1(见表2和图5~图9),是失水和预热阶段,TG曲线出现较小失重。该区间可以分成两个阶段:第一段从室温到150℃,该段主要是样品中自由水蒸发散失,失重率与样品的含水率有关;第二段从150℃到T1,该段主要是聚糖侧链断裂,分子内部发生解聚重组,产生自由基和官能团,并产生少量挥发性气体如CO、CO2和H2等[25],为更高温度的快速热解做准备。第二区间T1~T2范围内是主热解阶段,聚糖主链糖苷键开始断裂,样品发生剧烈分解,样品的大部分失重发生在这一区间,DTG曲线变化很大,出现了明显的峰值。第三区间从T2到终温700℃,是炭化阶段,即热解残余物缓慢分解的过程,C—C和C—H键进一步断裂,TG-DTG曲线趋于平坦。
Hu S等人[26]研究显示生物质热解过程符合3组分模型,即纤维素、半纤维素、木素进行相对独立的平行热解反应。纤维素是由葡萄糖聚合而成的直链聚糖,具有一定的晶体结构,热解主要发生在300~400℃;半纤维素是由不同单糖组成的聚糖,为无定形结构,比纤维素容易分解,热解主要发生在200~300℃;而木素是无定形的网状结构的芳香族聚合物,热解范围较宽,从200℃开始分解,一直到热解结束,贯穿整个热解过程[27-28]。从表1可以看出,碱溶性组分的平均残渣率高于水溶性组分,这是由残留较多的含碳量高的木素分解炭化导致的,从残渣率来看,H2残渣率最高,因此残留的木素最多,结果与FT-IR相一致 (见图2)。除了H3外,其他组分半纤维素的DTG曲线在T1~Tpeak区间都出现了一个小肩峰,该区间主要是半纤维素发生了缓慢的解聚转变现象[29]。
Liu Q等人[30]研究了生物质热解过程中3组分的相互作用关系,结果显示木素对半纤维素热解的影响最大,木素的存在会降低半纤维素的失重速率,减少半纤维素在低于327℃时的分解,相反,半纤维素也会加速木素的热解,使其最大失重温度降低,明显减少其残渣率,一般木素含量越高残渣率也越高。从FT-IR分析结果可知,水溶性组分含木素较少,碱溶性组分都含一定量的木素,从而使碱溶性半纤维素热解残渣率增加。
从中性糖分析结果来看,HW支链较少,4种碱溶性组分支链相对较多,其中,H2和H3支链较H1和H4的少;因此,从热解性质来看,HW最大热解速率较小,第一、第二区间失重较少;碱溶性组分最大热解速率较大,第一、第二区间失重较多;不同的是,H3的最大热解速率偏小,且第一、第二区间失重较少,可能是因为H3中含有较多糖醛酸基,影响了半纤维素的热解速率。
HW和H3的DTG曲线在第三区间存在一个小的明显的失重峰,其他组分在此温度区间都没有明显的失重表现,说明其他组分大部分在最大失重区间就已经分解完全,高温区间下残渣率炭化过程较稳定,而HW和H3热解速率较低,有一部分聚木糖的戊糖碳链继续在这一区间发生断裂和炭化[5]。
2.5 热解反应动力学参数的确定
生物质半纤维素是大分子物质,其高温热解可以看作是一级反应[31],生物质热解反应过程如下:
A(固体)→B(固体)+C(气体)
非均相反应的动力学方程:

动力学方程中的速率常数k与温度T的关系符合Arrhenius方程:

式中,E为反应活化能,kJ/mol;A为指前因子,min-1;T为热力学温度,℃;f(α)为固体反应物与反应速率的函数关系。采用Coat-Redfern公式积分后[32],等号两边取对数后除以T2得式 (5):

表2 毛竹竹竿半纤维素组分热分解动力学参数 (γ=10℃/min)


从表2可以看出,拟合后的方程线性良好,说明所选的机理函数适合半纤维素的热解反应。相对于碱溶性组分,水溶性组分的活化能较低,说明更容易发生热分解反应;H1和H3的活化能相差不大,说明低浓度碱对半纤维素结构影响较小,H1和H3热解性质相差不大;而H4活化能比H2小很多,与低浓度碱溶性组分的活化能接近,说明高浓度碱对半纤维素残留木素影响较大,碱液会溶解较多木素,从而使H2活化能升高,使其热解不易进行。半纤维素的热解反应动力学参数结果与前述热重实验曲线结果相符。通过蒸馏水和碱分级分离得到的半纤维素组分热解活化能 (26~52 kJ/mol)相比木质纤维素类生物质整体热解半纤维素组分的活化能 (86~90 kJ/mol)要小[33]。
3 结论
3.1 半纤维素的热分解反应可以分为3个温度区间,第一区间从室温到分解点温度 (主热解起始点温度,T1),主要是样品中自由水蒸发散失及预热阶段;第二区间从T1~主热解结束温度 (T2),样品的大部分失重发生在这一区间;第三区间从T2到终温700℃,热解残余物缓慢分解阶段。
3.2 半纤维素提取工艺对其热分解特性影响较大,残留木素含量对半纤维素热解性质影响最大,残留木素越多则残渣率就越高,高浓度碱提取的半纤维素残渣率最高。半纤维素结构对热解性质有一定影响,支链少、糖醛酸基含量多可能会使半纤维素热解速率下降。
3.3 对各半纤维素组分在主要分解温度区间内以一级反应模型进行线性回归分析,线性回归方程有良好的线性关系。毛竹半纤维素组分活化能均较小,其中碱溶性组分的活化能大于水溶性组分的活化能,低浓度碱溶性组分活化能相差不大,高浓度碱得到的半纤维素组分活化能最大,热解所需能量最高。残留木素越多的半纤维素的活化能越高。
[1] 傅旭峰,仲兆平,肖 刚,等.几种生物质热解特性及动力学的对比[J].农业工程学报,2009,25(1):199.
[2] Hashimoto K,Hasegawa I,Hayashi J,et al.Correlations of kinetic parameters in biomass pyrolysis with solid residue yield and lignin content[J].Fuel,2010,90(1):104.
[3] Damartzis Th,Vamvuka D,Sfakiotakis S,et al.Thermal degradation studies and kinetic modeling of cardoon(Cynara cardunculus)pyrolysis using thermogravimetric analysis(TGA)[J].Bioresource Technology,2011,102(10):6230.
[4] 杜 瑛,齐卫艳,苗 霞,等.毛竹的主要化学成分分析及热解[J].化工学报,2004(12):2099.
[5] Shen D K,Gu S,Bridgwater A V.Study on the pyrolytic behaviour of xylan-based hemicellulose using TG-FTIR and Py-GC-FTIR[J].Journal of Analytical and Applied Pyrolysis,2010,87(2):199.
[6] 林 妲,彭 红,余紫苹,等.半纤维素分离纯化研究进展[J].中国造纸,2011,30(1):60.
[7] 张宏书,李筱华,杨精干,等.蔗渣半纤维素的分级抽提和分析[J].中国造纸,1986,5(2):64.
[8] Blumenkrantz N,Asboe-Hansen G.New Method for Quantitative Determination of Uronic Acid[J].Anal.Biochem.,1973,54:484.
[9] 林 妲,彭 红,阮榕生,等.一种快速测定毛竹半纤维素中糖醛酸含量的方法[J].中国造纸,2012,31(3):16.
[10] Sun R C,Sun X F,Ma X H.Effect of ultrasound on the structural and physiochemical properties of organosolv soluble hemicelluloses from wheat straw[J].Ultrasonics Sonochemistry,2002,9(2):95.
[11] Sun R C,Lawther J M,Banks W B.Fractional and structural characterization of wheat straw hemicelluloses[J].Carbohydrate Polymers,1996,29(4):325.
[12] Peng F,Ren J L,Xu F,et al.Comparative studies on the physicochemical properties of hemicelluloses obtained by DEAE-cellulose-52 chromatography from sugarcane bagasse[J].Food Research International,2010,43(3):683.
[13]Kaˇcuráková M,Belton P S,Wilson R H,et al.Hydration properties of xylan-type structures:in FT-IR study of xylooligosaccharides[J].J.of the Sci.of Food and Agriculture,1998,77:38.
[14] Ebringerová A,Hromadkova Z,Alföldi J,et al.Structure and solution properties of corn cob heteroxylans[J].Carbohydrate Polymers.,1992,19:99.
[15] Xu F,Liu C F,Geng Z C,et al.Characterisation of degraded organosolve hemicelluloses from wheat straw[J].Polymer Degradation and Stability,2006,96(12):1342.
[16] Chaa L,Joly N,Lequart V,et al.Isolation,characterization and valorization of hemicelluloses from Aristida pungens leaves as biomaterial[J].Carbohydrate Polymers,2008,74(3):597.
[17] Wen J L,Xiao L P,Sun Y C,et al.Comparative study of alkalisoluble hemicelluloses isolated from bamboo(Bambusa rigida)[J].Carbohydrate Research,2011,346(1):111.
[18] Jin A X,Ren J L,Peng F,et al.Comparative characterization of degraded and non-degradative hemicelluloses from barley straw and maize stems composition,structure,and thermal properties[J].Carbohydrate.Polymers,2009,78:609.
[19] Peng H,Sun Y,Zhang J H,et al.Degradation of cellooligosaccharides in oxidative medium and alkaline medium:HPLC,FTIR,and GC-MS analysis[J].Bioresources,2010(5):616.
[20] Morine C,Krausz P,Chaleix V,et al.Structural characterization and cytotoxic properties of a 4-Omethylglucuronoxylan from Castanea sativa[J].J.Nat.Prod.,2007,70:60.
[21] Chiarini L,Cescutti P,Drigo L,et al.Exopolysaccharidesproduced by Burkholderia cenocepacia recA lineages IIIA and IIIB[J].J.Cyst.Fibros.,2004,3:165.
[22] Jin A X,Ren J L,Peng F,et al.Comparative characterization of degraded and non-degradative hemicelluloses from barley straw and maize stems:composition,structure,and thermal properties[J].Carbohydrate Polymers,2009,78:609.
[23] Yuan T Q,Xu F,He J,et al.Structural and physico-chemical characterization of hemicelluloses from ultrasound-assisted extractions of partially delignified fast-growing poplar wood through organic solvent and alkaline solutions[J].Biotechnol.Adv.,2010,28:583.
[24] Zhang X M,Meng L Y,Xu F,et al.Pretreatment of partially delignified hybrid poplar for biofuels production:characterization of organosolv hemicelluloses[J].Ind.Crops Prod.,2011,33:310.
[25] 周 岭,周福君,蒋恩臣,等.棉秆不同组分热解特性及动力学[J].农业工程学报,2009,25(8):220.
[26] Hu S,Jess A,Xu M.Kinetic study of Chinese biomass slow pyrolysis Comparison of different kinetic model[J].Fuel,2007,86(17/18):2778.
[27] Raveendran K,Ganesh A,Khilar K C.Pyrolysis characteristics of biomass and biomass components[J].Fuel,1996,75(8):987.
[28] Carrier M,Loppinet-Serani A,Denux D,et al.Thermogravimetric analysis as a new method to determine the lignocellulosic composition of biomass[J].Biomass and Bioenergy,2011,35(1):298.
[29] 彭云云,武书彬.蔗渣半纤维素的热裂解特性及动力学研究[J].造纸科学与技术,2009(3):14.
[30] Liu Q,Zhong Z P,Wang S R,et al.Interactions of biomass components during pyrolysis A TG-FTIR study[J].Journal of Analytical and Applied Pyrolysis,2011,90(2):213.
[31] White J E,Catallo W J,Legendre B L.Biomass pyrolysis kinetics:A comparative critical review with relevant agricultural residue case studies[J].Journal of Analytical and Applied Pyrolysis,2011,91(1):1.
[32] Coats A W,Redfern J P.Kinetic parameters from thermogravimetric data[J].Nature,1964,201:68.
[33] Barneto A G,Carmona J A,Alfonso J E M,et al.Simulation of the thermogravimetry analysis of three non-wood pulps[J].Bioresource Technology,2010,101(9):3220. CPP
Pyrolysis Characteristics of Hemicelluloses from Bamboo Stem
YU Zi-ping PENG Hong*LIN Da HU Zheng-rong WANG Na ZHANG Jin-sheng LIU Yu-huan RUAN Rong-sheng
(Engineering Research Center for Biomass Conversion,Ministry of Education,Nanchang University,Nanchang,Jiangxi Province,330047)
Water-soluble hemicelluloses HWand four alkali-soluble hemicellulosic fractions H1~H4were sequentially extracted from sixmonth-old bamboo stem by distilled water,2%NaOH and 5%KOH.The thermal pyrolysis behavior of the five hemicellulosic fractions was characterized by using thermal gravimetric analysis(TGA)at the heating rate of 10℃ /min,and the first-order reaction models were established in the fast pyrolysis temperature ranges.The fast decompositions of the five fractions happened in between 180~400℃ with weight losses 33.91% ~42.54%.The residue percentages were 34.52% ~51.31%at the final temperature of 700℃.The activity energies of all the hemicelluloses fractions were quite low with the values of 26.068 ~ 51.938 kJ/mol.The activity energies of alkali-soluble fractions were higher than that of water-soluble fraction.The hemicellulosic fractions containing higher lignin residue exhibited higher activity energy and residue rate at the final temperature of pyrolysis.
bamboo stem;hemicelluloses;thermal gravimetric analysis;pyrolysis characteristics
TS721+.2
A
0254-508X(2012)11-0007-07

余紫苹女士,在读硕士研究生;主要研究方向:生物质能源。
(*E-mail:penghpez@yahoo.com.cn)
2012-07-13(修改稿)
国家自然科学基金 (30960304);江西省教育厅基金(GJJ10045)。
(责任编辑:郭彩云)

