新型[1,2,4]三唑[4,3-b]均四嗪类化合物的合成及其抗癌活性
陈 辉, 郑彩霞, 杨玉峰, 林婷婷, 袁 栋, 徐 峰
(台州职业技术学院 生物与化学工程学院,浙江 台州 318000)
均四嗪类化合物具有较多生理活性,如抗炎[1]、镇痛[2]、抗病毒[3]及抗菌[4]。均四嗪的衍生物一般分为三类,即1,4-二氢,1,2-二氢和1,6-二氢均四嗪。近年来发现二氢均四嗪类化合物具有抗癌活性而引起人们关注。胡惟孝等[5]发现3,6-二苯基-1,4-二氢-1,4-二甲酰胺均四嗪类化合物具有很强的抗癌活性,其中N,N′-二间甲基苯胺-3,6-二甲基-1,4-二氢均四嗪-1,4-二甲酰胺对小鼠白血病细胞P-388,人实体瘤细胞肝癌BEL-7402,乳腺癌MCF-7和肺腺癌A-549均有较强的增殖生长抑制作用;饶国武等[6]发现3,6-二苯基-1,2-二氢均四嗪类化合物具有较强的抗癌活性,其中1-氯乙酸酰基-3,6-苯基-1,2-二氢均四嗪对P-388和A-549具有较强的抗癌能力。但至今为止,1,6-二氢均四嗪衍生物的抗癌活性研究还未见文献报道。
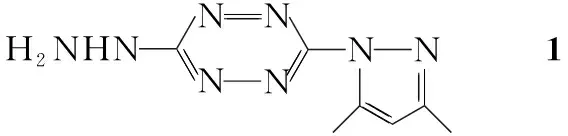
Scheme1
本文以3-(3,5-二甲基吡唑-1-基)-6-肼基均四嗪(1)和芳醛(2a~2f)为原料,经Schiff碱缩合和环合反应合成了6个新型的6-芳基-3-(3,5-二甲基吡唑-1-基)[1,2,4]三唑[4,3-b]均四嗪(4a~4f, Scheme 1),其结构经1H NMR, MS, IR和元素分析表征。以顺铂为对照,采用四氮唑盐还原法(MTT法)测试了体外4a~4f对人白血病细胞株HL-60, A-549, MCF-7和人子宫颈癌细胞株Hela的抗癌活性。结果表明,4a~4f均具有较强的体外抗癌活性。
1 实验部分
1.1 仪器与试剂
XRC-1型熔点仪(温度未经校正);Brucker AC400(400 MHz)型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Nicolex FI-IR-170型红外光谱仪(KBr压片);HP 5989A型质谱仪。
HL-60, A-549, MCF-7和Hela,中国科学院上海生命科学院细胞库;DMEM培养基,Gibco; MTT, Sigma(上海实生细胞生物技术有限公司分装);胎牛血清,青霉素-链霉素,EDTA-胰酶消化液,Gibco;顺铂,齐鲁制药有限公司产品(产品批号1010011DC);其余所用试剂均为分析纯。
1.2 合成
(1) 3a~3f的合成(以3a为例)
在反应瓶中加入1 1.0 g(4.85 mmol)的无水乙醇(20 mL)溶液,搅拌下于室温滴加苯甲醛(2a)0.5 g(4.85 mmol)的无水乙醇(10 mL)溶液,滴毕,反应至终点(TLC跟踪,展开剂:乙酸乙酯)。抽滤,滤饼干燥得砖红色固体1-苯基亚甲基-2-[6-(3,5-二甲基-1H-吡唑-1-基)-1,2,4,5-四嗪-3-基]肼(3a),产率,58.0%, m.p.198 ℃~200 ℃;1H NMRδ: 12.59(s, 1H), 8.37(s, 1H), 7.78(d,J=6.6 Hz, 2H), 7.44~7.49(m, 3H), 6.24(s, 1H), 2.47(s, 3H), 2.25(s, 3H); IRν: 3 217, 3 053, 1 606, 1 485, 1 419 cm-1; MSm/z: 295{[M+H]+}。
用类似的方法合成3b~3f,其表征数据[7]与Scheme 1预期吻合。
(2)4a~4f的合成(以4a为例)
在反应瓶中加入3a1.5 g(4.5 mmol)和氯仿30 mL,搅拌下加入四醋酸铅2.5 g(5.7 mmol)的氯仿(10 mL)溶液,回流反应30 min(溶液变成棕黄色)。冷却至室温,减压抽除溶剂,加入无水乙醇,析出大量固体,冷却至0 ℃,抽滤,滤饼干燥后用无水乙醇重结晶得深黄色固体3-(3,5-二甲基-1H-吡唑-1-基)-6-苯基-[1,2,4]三唑[4,3-b]均四嗪(4a)。
用类似的方法合成黄色固体4b~4d, 4f和棕黄色固体4e。
1.3 抗癌活性测试
以顺铂为对照,采用MTT法测定4a~4f对HL-60, A549, MCF-7和Hela的体外抗癌活性。顺铂和4(1 mg)用DMSO(20 μL)溶解;取2 μL用1 000 μL培养液稀释,使浓度(c)为100 μg·mL-1,再用培养液连续稀释至使用浓度;每1 000 mL培养基中含80万单位青霉素,1.0 g链霉素,10%灭活胎牛血清;将肿瘤细胞接种于培养基中,置37 ℃, 5%CO2培养箱中培养,3 d~5 d传代。
将癌细胞用EDTA-胰酶消化液消化,并用培养基稀释成1.0×105·mL-1,加到96孔细胞培养板中,每孔100 μL,置37 ℃, 5%CO2培养箱中培养。接种24 h 后,倾去培养基,加入用培养基稀释的样品,每孔 200 μL,每个浓度加3孔,置37 ℃, 5%CO2培养箱中培养72 h后在细胞培养孔中加入5 mg·mL-1的MTT,每孔10 μL,置37 ℃孵育3 h;加入DMSO,每孔150 μL,用振荡器振荡,使甲臢完全溶解,用酶标仪于490 nm处测OD值,计算细胞生长抑制率{抑制率/%=[1-(OD药物-OD空白)/(OD对照-OD空白)]×100%},根据细胞生长抑制率,以直线回归方法计算IC50值。以同样条件用不含样品,含同样浓度DMSO的培养基培养的细胞作为对照,计算样品对肿瘤细胞生长的半数致死浓度(IC50)。
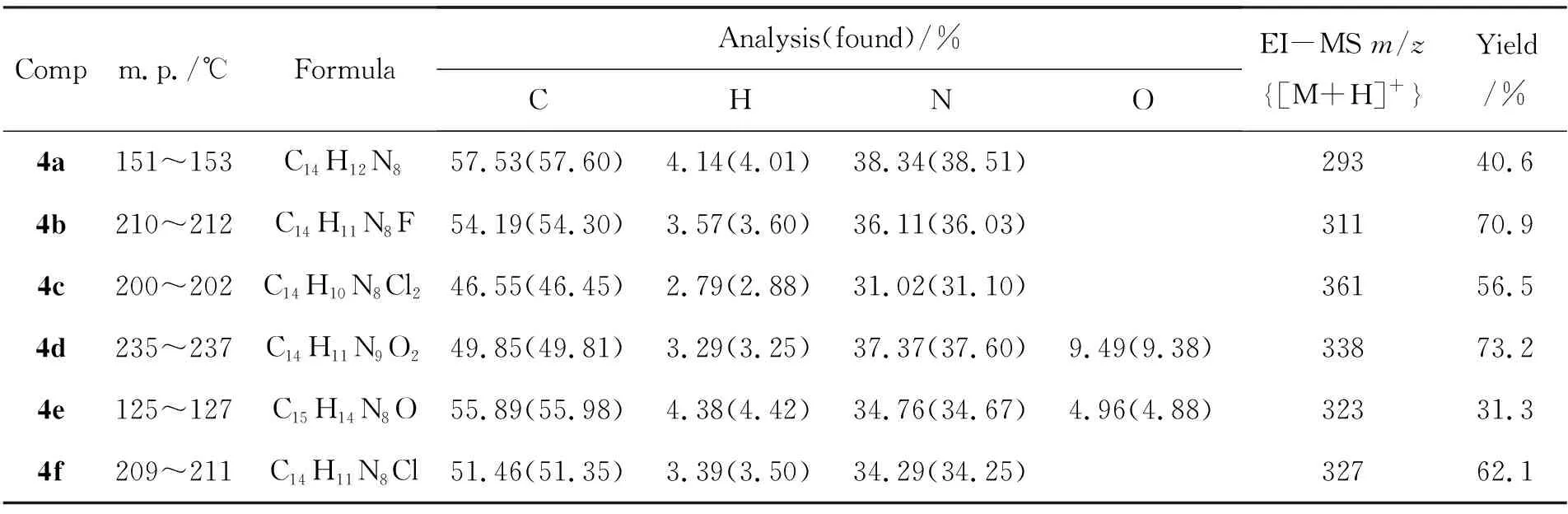
表1 4的实验结果和MS数据Table 1 Experimental results and MS data of 4
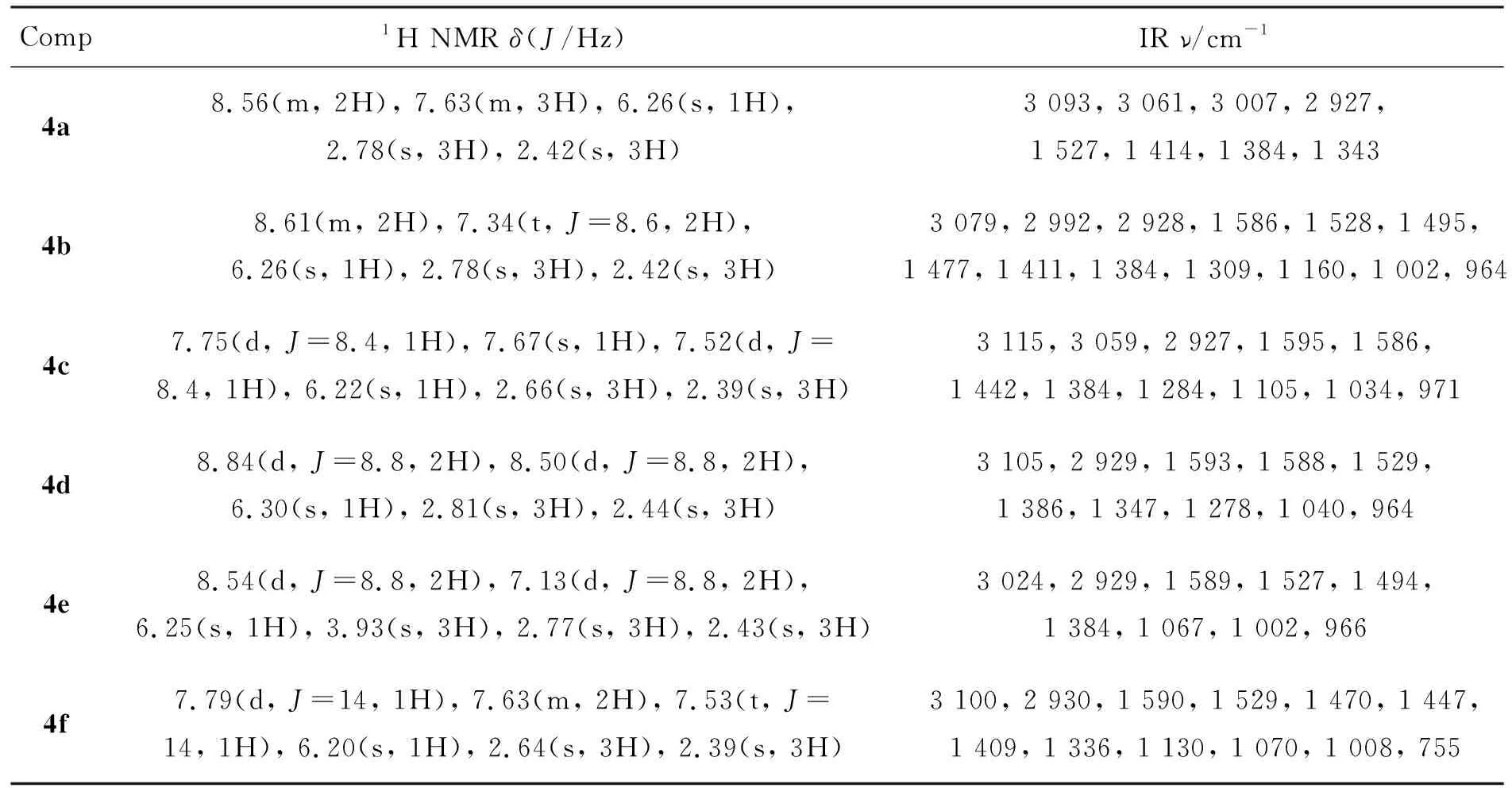
表2 4的1H NMR和IR数据Table 2 1H NMR and IR data of 4
2 结果与讨论
2.1 合成
合成4时,缩合剂可用四醋酸铅,也可用甲磺酸和对甲苯磺酸等磺酸类催化剂,效果均较好。合成4的实验结果和表征数据分别见表1和表2。从表1可见,当苯环上的取代基为吸电子基(2b~2d,2f)时,产物的颜色为亮黄色,且收率较高(56.5%~73.2%);当苯环上的取代基为电子基(2e)或无取代基(2a)时,产物的颜色相对较深,收率也较低(31.3%~40.6%), 4e还极易吸潮发黏。
2.2 抗癌活性
4的抗癌活性结果见表3。由表3可见,4a~4f对四种癌细胞均具有较强的抑制活性,其中4a对HL-60的活性(IC50=3.54 μg·mL-1)约为顺铂(IC50=6.65 μg·mL-1)的2倍; 4b抑制A-549的活性(IC50=2.70 μg·mL-1)与顺铂(IC50=2.62 μg·mL-1)相当;在抑制MCF-7时, 4a~4f的活性(IC50=1.09 μg·mL-1~6.36 μg·mL-1)明显好于或相当于顺铂(IC50=6.38 μg·mL-1);另外,4a~4f虽然显示了较好的抑制Hela的活性(IC50=1.05 μg·mL-1~6.91 μg·mL-1),但比顺铂(IC50=0.58 μg·mL-1)略显逊色。
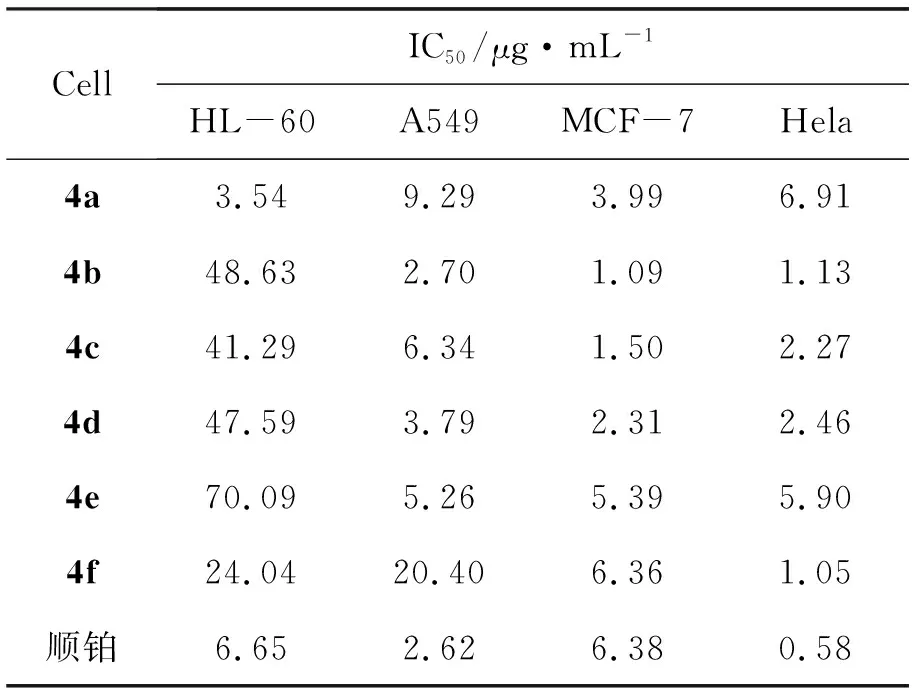
表3 4的抗癌活性Table 3 Anti-cancer activities of 4
[1] Lang J S A, Johnson B, Cohen L E,etal. Aryl-s-tetrazines with anti-inflammatory activity[J].J Med Chem,1976,19(12):1404-1409.
[2] Kigasawa K, Hiiragi M, Wagatsuma N,etal. Novel 1,2,4,5-tetrazine and method[P].JP 54 163 579,1979.
[3] Werbel L M, Mcnamara D J. Synthesis and antimalarial effects ofN,N-dialkyl-6-(substituted phenyl)-1,2,4,5-tetrazin-3-amines[J].J Heterocycl Chem,1979,16:881-894.
[4] Arthur K G, Howard B. Controlling bacterial infections using substituted symmetrical tetrazines[P].GB 1 245 443,1971.
[5] Hu W X, Rao G W, Sun Y Q. Synthesis and antitumor activity ofs-tetrazine derivatives[J].Bioorg Med Chem Let,2004,14:1177-1181.
[6] Rao G W, Hu W X. Synthesis,structure analysis,and antitumor activity 3,6-disubstituted-1,4-dihydro-1,2,4,5-tetrazine derivatives[J].Bioorg Med Chem Let,2006,12:3702-3705.
[7] 3b:绛红色固体,产率42.1%, m.p.204 ℃~207 ℃;1H NMRδ: 12.60(s, 1H), 8.36(s, 1H), 7.84(q,J=8.8 Hz, 5.6 Hz, 2H), 7.32(t,J=8.8 Hz, 2H), 6.24(s, 1H), 2.50(s, 3H), 2.47(s, 3H); IRν: 3 222, 3 036, 1 606, 1 572, 1 423 cm-1; MSm/z: 313({[M+H]+}. 3c:桔红色固体,产率84.3%, m.p.229 ℃~230 ℃;1H NMRδ: 12.82(s, 1H), 8.69(s, 1H), 8.07(d,J=8.6 Hz, 1H), 7.75(s, 1H), 7.55(d,J=8.6 Hz, 1H), 6.24(s, 1H), 2.50(s, 3H), 2.25(s, 3H); IRν: 3 222, 3 065, 1 573, 1 485, 1 421 cm-1; MSm/z: 363{[M+H]+}. 3d:鲜红色固体,产率98.0%, m.p.220 ℃~222 ℃;1H NMRδ: 12.91(s, 1H), 8.45(s, 1H), 8.32(d,J=8.8 Hz, 2H), 8.04(d,J=8.8 Hz, 2H), 6.26(s, 1H), 2.50(s, 3H), 2.26(s, 3H); IRν: 3 257, 3 022, 1 523, 1 485, 1 428 cm-1; MSm/z: 340{[M+H]+}. 3e:暗红色固体,产率83.2%, m.p.198 ℃~200 ℃;1H NMRδ: 12.45(s, 1H), 8.31(s, 1H), 7.72(d,J=8.8 Hz, 2H), 7.04(d,J=8.8 Hz, 2H), 6.23(s, 1H), 3.82(s, 3H), 2.45(s, 3H), 2.25(s, 3H); IRν: 3 230, 3 062, 1 513, 1 488, 1 424 cm-1; MSm/z: 325{[M+H]+}. 3f:桔黄色固体,产率90.4%. m.p.215 ℃~217 ℃;1H NMRδ: 12.77(s, 1H), 8.76(s, 1H), 8.07(d,J=9.6 Hz, 1H), 7.56(s,J=9.6 Hz, 1H), 7.46(m, 2H), 6.25(s, 1H), 2.51(s, 3H), 2.25(s, 3H); IRν: 3 210, 3 055, 1 540, 1 458, 1 420 cm-1; MSm/z: 328{[M+H]+}.

