新型手性Brönsted酸的合成及其在直接不对称Mannich反应中的应用
李虎,Pinaki S Bhadury
(贵州大学精细化工研究开发中心,贵州 贵阳 550025)
手性β-氨基酮及其衍生物是重要的手性中间体和手性药物[1].目前,催化不对称Mannich反应是制备该类化合物较为有效的方法.其中,手性磷酸作为一种极强的Brönsted酸能很好地激活亚胺,从而诱导发生相应的不对称亲电加成反应[2-3].近年来,BINOL及其衍生物与金属形成手性配体广泛并成功地应用于不对称催化合成,特别是3,3′-位杂原子取代的BINOL衍生物因制备方法简单以及在不对称催化合成中对映体选择性高而倍受青睐[4-5].在此基础之上,我们拟筛选出合适的3,3′-位杂原子取代的BINOL类衍生物并探求磷酰化反应条件将其转化为相应的新型手性磷酸,以期获得合成方法简单,产率较高且具有一定催化活性的手性磷酸催化剂.本文中从(R)-BINOL出发,设计并合成了新型(R)-3,3′-双(二苯次膦酰基)-BINOL衍生的手性磷酸催化剂(3,Scheme 1),其结构经1H NMR,31P NMR和MS表征.运用该手性催化剂3催化直接不对称Mannich反应(Scheme 2),并对不对称催化反应条件进行了优化.
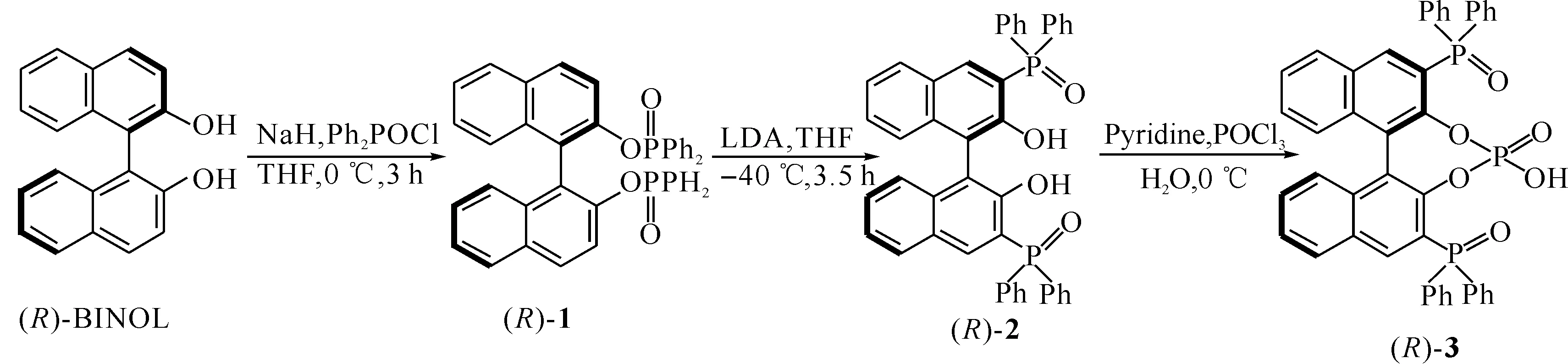
Scheme 1 手性Brönsted酸3的合成
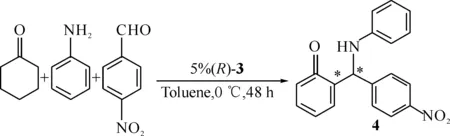
Scheme 2 手性Brönsted酸3催化直接不对称Mannich反应
1 实验部分
1.1仪器与试剂JEOL ECX-500 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Agilent 1100型高效液相色谱仪;AD-H柱,Daicel公司[流动相∶y(正己烷)∶y(异丙醇)=4∶1,室温];Agilent LC/MSD型液质联用仪;AutopolⅣ型旋光仪;Sarforius 电子天平;LABOROTA 4000 旋转蒸发仪(德国Heidolph);X-4型数字显示显微熔点测定仪;GL-2型恒温加热磁力搅拌器.所用试剂均为国产分析纯、Aldrich试剂.
1.2 合成
1.2.1 (R)-1,1′-联二萘酚-2,2′-双(二苯次膦酸酯)(1)的合成 Ar保护,向250 mL圆底烧瓶中加入NaH 0.880 g (22 mmol)的无水THF (35 mL)溶液,冰浴冷却至0 ℃,搅拌下滴加(R)-BINOL 2.86 g (10 mmo1)的THF (15 mL)溶液,滴毕,反应15 min.缓慢滴加二苯基次磷酰氯4.19 mL (22 mmol),滴毕,继续在0 ℃条件下反应15 min,后逐渐升温至室温反应3 h.在冰浴条件下,加入60 mL乙醚和60 mL水稀释并淬灭反应.用乙醚(30 mL×2)萃取,合并有机相,用NaCl溶液洗涤,无水MgSO4干燥,减压旋蒸除溶剂得淡黄色固体1,6.57 g,产率96%.该粗产品不需纯化直接投入下一步反应.(R)-1:31P NMR (200 MHz,CDCl3)δ:33.26 (s,2P).[α]D20=+17.2 (c=1.00,CHCl3). MSm/z:687.2[M+H]+.
1.2.2 (R)-3,3′-双(二苯次膦酰基)-BINOL(2)的合成 Ar保护,向250 mL圆底烧瓶中加入i-Pr2NH 19.2 mL(137 mmol)的无水THF(50 mL)溶液,低温冷却至-40 ℃,搅拌下滴加2.20 mol/L n-BuLi的正己烷溶液(62.3 mL),滴毕,反应30 min.缓慢滴加(R)-19.33 g (13.6 mmol)的无水THF (80 mL)溶液,滴毕,继续在-40 ℃条件下反应3.5 h. 在低温条件下,缓慢加入50 mL乙醚和40 mL食盐水稀释并淬灭反应.用1 mol/L HCl将反应液调制pH=1.然后,用乙醚(30 mL×2)萃取,合并有机相,用NaCl溶液洗涤,无水MgSO4干燥,减压旋蒸除溶剂得浅黄色固体.并经重结晶(甲苯∶正己烷=1∶5)得无色针状晶体8.58 g,产率92%.(R)-2:31P NMR (200 MHz,CDCl3)δ:39.31 (s,2P).[α]D20=+86.8 (c=1.00,CHCl3). MSm/z:687.2[M+H]+.
1.2.3 (R)-3,3′-双(二苯次膦酰基)-BINOL磷酸(3)的合成 Ar保护,向装有(R)-20.34 g (0.5 mmol)的圆底烧瓶中加入1 mL重蒸的吡啶.搅拌至固体完全溶解后,缓慢加入0.8 mL三氯氧磷(1.5~2.0当量),滴毕,室温反应3 h.在冰浴条件下,缓慢滴加水(1 mL)淬灭反应,并继续搅拌30 min.先加入二氯甲烷(30 mL)后加入1 mol/L HCl反相萃取溶液,并重复多次除掉吡啶.无水MgSO4干燥有机相,减压旋蒸除去溶剂,并经硅胶柱层析纯化得白色固体30.32 g,产率86%.(R)-3:mp:212~214 ℃.[α]D20=+163.4 (c=1.00,CHCl3).1H NMR (500 MHz,CDCl3)δ:6.87(s,1H,OH),7.24~7.26(m,4×H),7.41~7.84(m,26×H).31P NMR (200 MHz,CDCl3)δ:-1.46,31.82,35.12 (t,3P). MSm/z:749.2[M+H]+.
1.3催化直接不对称Mannich反应向25 mL圆底烧瓶中加入苯胺36.6 μL(0.4 mmol),对硝基苯甲醛66.0 mg(0.44 mmol),(R)-30.015 g(0.02 mmol),甲苯5 mL.搅拌30 min后,将反应体系降温至0 ℃,并加入环己酮0.4 mL(4 mmol),继续在0 ℃条件下搅拌36 h直至反应完全.减压旋蒸除去溶剂,并经硅胶柱层析(石油醚∶乙酸乙酯=8∶1)纯化得白色固体4,目标化合物结构表征数据与文献[2]报道一致.
2 结果与讨论
2.1手性Brönsted酸催化剂的合成在已报道文献[5-6]的基础之上,进行了合成条件的探索和优化,筛选出反应条件温和(合成催化剂关键步骤所需最低温度为-40 ℃,文献报道为-78 ℃),操作、后处理方法简单(3步反应一天内即可完成),产率较高(3步反应产率均高于80%),快速的初步结构鉴定方法(通过31P NMR的出峰数、峰面积、化学位移及出峰清晰度可大致判断目标产物所接P原子的位置及其纯度);并最终合成出3,3′-位杂原子取代的新型手性Brönsted酸催化剂,(R)-3,3′-双(二苯次膦酰基)-BINOL衍生的手性磷酸催化剂3.
2.2 催化直接不对称Mannich反应的条件优化
2.2.1 催化剂用量对直接不对称Mannich反应的影响 以甲苯为溶剂,在n(4-nitrobenzaldehyde)∶n(cyclohexanone)∶n(aniline)=1∶10∶1.1的条件下,于0 ℃下反应60 h,考察催化剂3用量对直接不对称Mannich反应的影响,结果见表1的entry 1~entry 3.从中可见,随着3用量的增加,4的产率先有明显的增加(从74%升至89%),然后略有下降(82%);对映选择性测则随着3用量的增加不断上升,从12.3%ee升至33.5%ee.综合考虑,选择3用量为 0.02 mmol.
2.2.2 反应温度对直接不对称Mannich反应的影响 以3(0.02 mmol)为催化剂,其余反应条件同2.2.1,考察反应温度对直接不对称Mannich反应的影响,结果见表1 entry 2,entry 4~entry 5.从中可见,于0 ℃反应时,4的产率(89%)和对映选择性(32%)较佳.最佳的反应温度为0 ℃.
2.2.3 反应时间对直接不对称Mannich反应的影响 以3(0.02 mmol)为催化剂,于0 ℃反应,其余反应条件同2.2.1,考察反应时间对直接不对称Mannich反应的影响,结果见表1中entry 2,entry 6~entry 8.从此实验数据中可以看出,反应时间从24 h增加36 h,4的产率先从76%升至87%,对映选择性明显增加,ee值从18.4%升至38%,说明延长反应时间有利于反应;从48 h到60 h (entry 2,entry 8),产率没多大变化,但是ee值略有下降,说明可能有部分外消旋化.本反应选择反应时间为36 h.
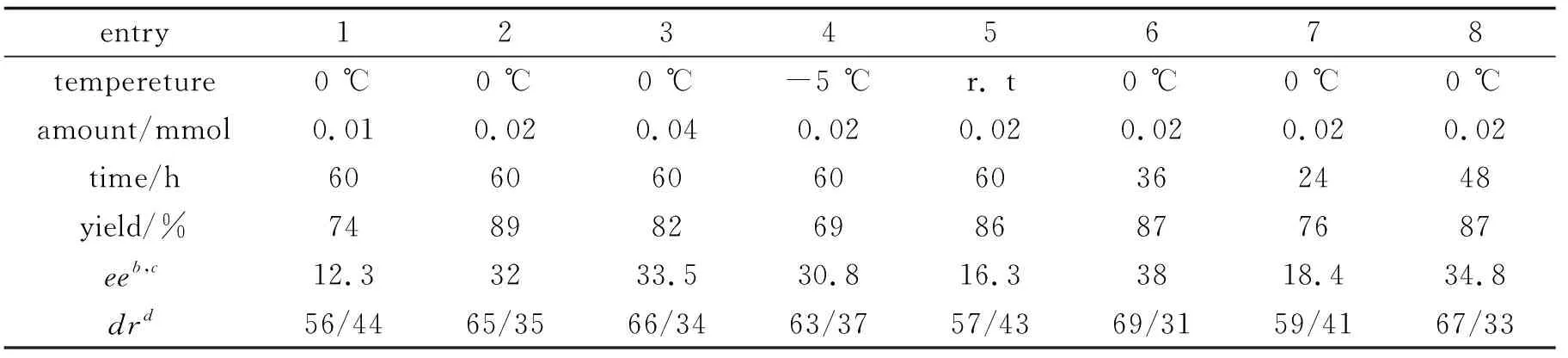
表1 反应条件对直接不对称Mannich反应的影响a
a:reaction condition∶n(4-nitrobenzaldehyde)∶n(cyclohexanone)∶n(aniline)∶n(3)=1∶10∶1.1∶0. 2.b:determined by HPLC on a chiralcel AD-H column.c:the absolute configuration was assigned by comparing HPLC elution order with known literature data[2].d:determined by1H NMR.
综上所述,最佳直接不对称Mannich反应的条件为:以甲苯为溶剂,0.02 mmol 用量的3为催化剂,于0 ℃反应36 h.在此条件下,4的收率为87%,38%ee,69/31dr.与已报道文献[2-3]相比,该方法将一种较易合成的手性Brönsted酸作为催化剂应用于催化直接不对称Mannich反应并获得了较高的收率.
3 结论
经简单的3步反应合成了一种新型的手性Brönsted酸催化剂,并将其应用于催化直接不对称Mannich反应获得了较高的收率和一定的对映选择性.
[1] Kobayashi S, Ishitani H. Catalytic enantioselective addition to imines[J].Chem Rev,1999,99:1069-1094.
[2] Guo Q X, Liu H, Guo C, et al. Chiral Brönsted acid-catalyzed direct asymmetric Mannich reaction[J].J Am Chem Soc,2007,129:3790-3791.
[3] Uraguchi D,Terada M. Chiral Brönsted acid-catalyzed direct Mannich reactions via electrophilic activation[J].J. Am. Chem. Soc.,2004,126:5356-5357.
[4] 李虎,Bhadury P S,费强. 3,3′-位杂原子取代的BINOL类手性催化剂在不对称合成中的应用[J].广东化工,2011,38:69-71.
[5] Hatano M, Miyamoto T, Ishihara K. 3,3′-Diphosphoryl-1,1′-bi-2-naphthol Zn(II) complexes as conjugate acid base catalysts for enantioselective dialkylzinc addition to aldehydes[J].J Org Chem,2006,71:6474-6484.
[6] Tang H Y, Lu A D, Zhou Z H, et al. Chiral phosphoric acid catalyzed asymmetric Friedel-Crafts alkylation of indoles with simpleα,β-unsaturated aromatic ketones[J].Eur J Org Chem,2008,8:1406-1410.

