蛋白酶体抑制剂Bortezomib对宫颈癌Hela细胞的体外作用
丁秀杰 王 雪 冷维春 王立岩 田秀娟 (九台市营城煤机厂职工医院,吉林 九台 30502)
蛋白酶体抑制剂Bortezomib对宫颈癌Hela细胞的体外作用
丁秀杰 王 雪1冷维春1王立岩1田秀娟1(九台市营城煤机厂职工医院,吉林 九台 130502)
目的 探讨蛋白酶体抑制剂Bortezomib对宫颈癌Hela细胞存活率的影响。方法 MTT检测Bortezomib对宫颈癌Hela细胞体外生长及增殖的影响;并用Western印迹、RT-PCR检测NF-κB(P65)蛋白和mRNA表达水平的变化。结果 (1)MTT检测结果显示:与对照组相比,Bortezomib 1.25 μmol/L 组〔(84.9 ±0.08)%〕、Bortezomib 2.50 μmol/L 组〔(67.1 ±0.12)%〕、Bortezomib 5.00 μmol/L 组〔(51.6 ±0.11)%〕、Bortezomib 10.00 μmol/L组〔(41.3±0.13)%〕及Bortezomib 20.00 μmol/L组〔(20.8±0.12)%〕Hela细胞增殖率明显降低(P<0.05)。(2)Western印迹检测结果表明:随着Bortezomib浓度的增高,NF-κB(P65)蛋白表达量有剂量依赖性的降低趋势(P<0.05)。(3)RT-PCR结果显示,与对照组相比,随着Bortezomib浓度的增加,NF-κB(P65)mRNA的表达水平明显降低(P<0.05)。结论 蛋白酶体抑制剂Bortezomib能够体外抑制宫颈癌Hela细胞的短期增殖,其机制与下调NF-κB(P65)的表达密切相关。
蛋白酶体抑制剂;Bortezomib;宫颈癌;Hela细胞
蛋白酶体抑制剂是一类能通过与蛋白酶体内的酶解活性位点结合,而阻碍靶蛋白降解的药物。大多数调节蛋白都存在于蛋白酶体内,它们参与细胞生长、增殖、分化及凋亡。近年来很多研究表明,蛋白酶体抑制剂对多种肿瘤细胞具有明显的增殖抑制作用〔1〕,因此它已经成为治疗恶性肿瘤的新靶点。蛋白酶体抑制剂包括 Bortezomib、MG132、TMC-95A和 Bortezomib等。本实验选用代谢稳定、作用时间较长的Bortezomib,探讨其体外对宫颈癌Hela细胞增殖率的影响,并探讨其机制。
1 材料与方法
1.1 材料
宫颈癌Hela细胞株和蛋白酶体抑制剂Bortezomib均由吉林大学病理生理教研室提供。
1.2 方法
1.2.1细胞培养 Hela细胞株用IMDM培养基(含10%新生胎牛血清、青霉素与链霉素各100 U/ml),37℃ 5%CO2孵箱内培养,以0.25%胰酶消化传代,每1~2 d传代1次,按1∶3传代,试验选用生长状态良好的处于对数生长期的细胞。
1.2.2 MTT检测法 选取对数生长期的Hela细胞,96孔板种细胞数 1×104个/孔,每孔加100 μl完全培养基,24 h后,每孔加入100 μl含不同浓度药物的培养基。分为对照组和Bortezomib 1.25、2.50、5.00、10.00、20.00 μmol/L 五组,每组 5 复孔。培养24 h后每孔加入MTT 10 μl,继续培养4~5 h,弃掉培养液,每孔加150 μl DMSO,振荡10 min至结晶物完全融解。在BIO-TEK酶标仪上,选择570 nm或490 nm波长,测定各孔光吸收值,计算细胞抑制率%=(对照组A均值-实验组A均值)/对照组A均值×100%。细胞存活率%=实验组A均值/对照组A均值×100%。实验重复3次。
1.2.3 Western印迹 收集Hela细胞,胰酶消化后,800 r/min离心5 min,弃上清,1×PBS洗三次,将细胞移入EP管中,每瓶细胞约加入细胞裂解液100~200 μl,12 000 r/min离心5 min,收集蛋白,测定蛋白浓度。聚丙烯酰胺凝胶(SDS-PAGE)电泳、转膜、奶粉封闭,一抗,室温放置30 min,4℃摇床上过夜,二抗(1∶1 000或1∶2 000),摇床上室温放置1~2 h后显色,显色结束后,膜拍照封存,分析核因子(NF)-κB(P65)蛋白的表达情况。
1.2.4 RT-PCR检测NF-κB(P65)mRNA的表达
1.2.4.1 细胞总RNA提取 用Trizol(invitrogen)提取总RNA,用分光光度计测定RNA浓度以及OD260/OD280。
1.2.4.2 逆转录 微量离心管内取1 μg模板RNA溶液、4 μl 5×RT缓冲液、2 μl dNTP 混合液(每种10 mmol/L)、20 U Oligo(dT)18 Primer和 10 U AMV Reverse Transcriptase,用 0.1%DEPC水补足至20 μl,混匀后室温放置10 min,再移入42℃恒温水浴中1 h,然后冰水中冷却2 min,进行逆转录。
1.2.4.3 PCR NF-κB 上游引物:5'-ACCACTGCTCAGGTCCACT-GTC-3',下游引物:5'-GCTGTCACTATCCCGGAGTTCA-3';GAPDH上游引物:5'-TGTGTCCGTCGTGGATCTGA-3'5'-GGGTGATGCTGGTGCTGAGTATGT-3',下 游 引 物 5'-TTGCTGTTGAAGTCGCAGGAG-3',5'-AAGAATGGGTGTTGCTGTTGAAGTC-3'。PCR 扩增体系总体积为 25 μl,内含 12.5 μl TaKaRa Taq酶、10.5 μl ddH2O、1 μl模板 cDNA 和1 μl引物。扩增条件:变性(94℃、2 min);退火,复性(30 s),延伸(72℃、30 s)、30 个循环。扩增后的产物经1%琼脂糖凝胶电泳后,采用GIS凝胶成像系统照相,分析电泳条带光密度值,NF-κB(P65)mRNA的含量以目的基因与内参GAPDH比值确定。
1.3 统计学处理
2 结果
2.1 Bortezomib对宫颈癌Hela细胞体外增殖的抑制作用
MTT检测结果显示:与对照组相比,Bortezomib 1.25 μmol/L组〔(84.9 ± 0.08)%〕)、2.50 μmol/L 组 〔(67.1 ± 0.12)%〕、5.00 μmol/L组〔(51.6 ±0.11)%〕、10.00 μmol/L 组〔(41.3 ±0.13)%〕及 20.00 μmol/L 组〔(20.8±0.12)%〕Hela细胞增殖率明显降低(P<0.05)。
2.2 Bortezomib体外作用后Hela细胞NF-κB(P65)蛋白的表达
分别用0、2.50、5.00、10.00 μmol/L Bortezomib 体外作用于Hela细胞发现Bortezomib浓度越高,NF-κB(P65)蛋白表达减弱的越明显(P<0.05)。见图1。
2.3 Bortezomib体外对Hela细胞的NF-κB(P65)mRNA表达的影响
RT-PCR电泳结果显示,与对照组相比,随着Bortezomib浓度的增加,NF-κB(P65)mRNA的表达明显减弱(P<0.05)。见图2。
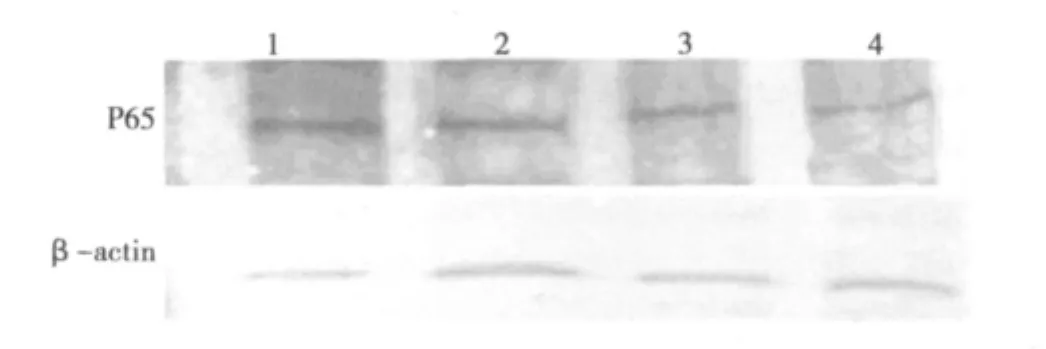
图1 宫颈癌Hela细胞中NF-κB(P65)蛋白表达
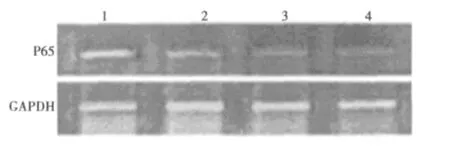
图2 宫颈癌Hela细胞中NF-κB(P65)mRNA表达
3 讨论
近年来,宫颈癌的发病率呈现明显的上升趋势,宫颈癌的药物治疗仍然主要是靠传统的抗肿瘤药物,缺少选择性的抑制肿瘤作用;而蛋白酶体抑制剂则不同,它是一组ATP依赖性蛋白水解酶复合体,通过抑制蛋白酶体的活性来阻断细胞蛋白的降解,进而促进肿瘤细胞的凋亡。研究表明,蛋白酶体与肿瘤的进展和转移密切相关,在细胞稳态和维持细胞功能的调节方面发挥着重要的作用,它能水解催化多种蛋白,是细胞中除溶酶体以外最主要的蛋白质降解场所。也就是说,蛋白酶体抑制剂是一类能阻碍靶蛋白降解的药物,与蛋白酶体内的酶解活性位点结合,阻断细胞内蛋白质的降解,进而影响细胞原有的增殖、分化和凋亡〔2〕。近年来,很多研究表明蛋白酶体抑制剂具有明显的抗肿瘤活性〔3〕,并且对多种恶性肿瘤具有明显的抑制作用〔4〕。
Bortezomib是蛋白酶体抑制剂的一种,属于合成的肽硼酸酯类抑制剂,可以抑制体内蛋白酶体的糜蛋白酶样活性和胰蛋白酶样活性,Bortezomib的抑制作用属于可逆性抑制,不仅与活性位点的结合速度慢,与之解离的速度也比较慢,因此,它在体内不易被氧化,不易失效,代谢稳定,作用时间较长。有研究证实,当应用计量为推荐剂量时,即1.3 mg/m2时,细胞内60% ~70%的蛋白酶体的功能将受到抑制,一般恢复时间在72 h内。Bortezomib对肿瘤细胞的抑制作用更强,因为肿瘤细胞对蛋白酶体抑制的敏感性为正常细胞的100~1 000倍〔5〕。
本次体外实验表明,Bortezomib对宫颈癌Hela细胞有明显的体外增殖抑制作用。另外,NF-κB作为一种以非活性状态广泛存在于各种类型细胞胞质中的转录因子,介导免疫应答及细胞增殖等多种基因的表达调控密切相关的多种信号转导途径,是控制早期基因表达的基因开关〔6〕。当细胞受到多种因素刺激后,NF-κB被激活,随之转位入细胞核内,通过与κB位点结合而调节许多靶基因的表达,影响细胞的生物学行为〔6〕。NF-κB 包括五种基因,即 NF-κB1(p50/p105)、NF-κB2(p52/p100)、RelA(p65)、RelB以及c-Rel,这五种基因可以翻译成七种蛋白。蛋白酶体降解 IκB在NF-κB激活中有重要作用,由于在NF-κB的激活过程中存在瞬时性,同时具备可诱导性,因此在肿瘤细胞内,各种分子改变都可能阻碍NF-κB激活调节机制,从而使NF-κB激活调节机制失去可控性,同时也就促使NF-κB的持续激活,最终使 NF-κB的靶基因表达失控。因此,肿瘤细胞的生长、增殖、凋亡、黏附、转移、耐药等过程都可能有NF-κB的参与〔7〕。研究表明,肿瘤细胞增殖是NF-κB通过上调细胞周期素 cyclin D1,D2,D3,cyclin E 实现的〔8〕。诱导 NF-κB 表达可以增加血管内皮生长因子和环氧合酶-2的激活,促进肿瘤血管的生成〔9〕。NF-κB可以上调多药耐药蛋白 P-gly的表达,而 P-gly蛋白可以通过能量依赖的方式将进入细胞内的化疗药物排除到细胞外,使化疗药物无法伤害肿瘤细胞,肿瘤的耐药过程可能有NF-κB的激活〔10〕。蛋白酶体抑制剂 Bortezomib有化疗增敏作用,与其对 NF-κB的抑制作用有关。因此,我们推测,肿瘤细胞的凋亡和化疗的增敏作用,可能是通过阻碍 NF-κB激活而抑制肿瘤细胞的生长和转移来发挥作用的。本实验结果表明,与对照组相比,不同浓度Bortezomib处理组的Hela细胞中NF-κB(P65)蛋白的表达明显下降,说明Bortezomib可能通过阻碍NF-κB蛋白激活来抑制宫颈癌Hela细胞增殖。
1 孔晓霞.Bcl-2在氧化应激诱导神经胶质瘤细胞自吞噬和凋亡中的作用机制〔D〕.长春:吉林大学博士论文,2009.
2 Latonen L,Moore HM,Bai B,et al.Proteasome inhibitors induce nucleolar aggreg ation of proteasome target proteins and polyadenylated RNA by altering ubiquitin avai lability〔J〕.Oncogene,2011;30(7):790-805.
3 Orlowski RI,Kuhn DJ.Proteasome inhibition in cancer therapy〔J〕.Clin Cancer Res,2008;14(15):1649.
4 Montagut C,Rovira A,Mellado B,et al.Preclinical and clinical development of the proteasome inhibitor bortezomib in cancer treatment〔J〕.Drugs Today,2005;41(5):299-315.
5 Tanaka K.The proteasome:Overview of structure and functions〔J〕.Proc Jpn Acad Ser B Phys Biol Sci,2009;85(1):12-36.
6 An J,Sun Y,Fisher M,et al.Maximal apoptosis of renal cell carcinoma by the prot easome inhibitor bortezomib is nuclear factor-κB dependent〔J〕.Mol Cancer Ther,2004;3(6):727-36.
7 Chen F,Wang M,O'Connor JP,et al.Phosphorylation of PPARgamma via active ERK1/2 leads to its physical association with p65 and inhibition of NF-kappabeta〔J〕.Cell Biochem,2003;90(4):732-44.
8 Yu Q,Geng Y,Sicinski P.Specific protection against breast cancers by cyclin D1 ablation〔J〕.Nature,2001;411(6841):1017-21.
9 Hayden MS,Ghosh S.Signaling to NF-kappaB〔J〕.Genes Dev,2004;18(18):2195-224.
10 Dolcet X,Llobet D,Pallares J,et al.NF-κB in development and progression of human cancer〔J〕.Virchows Arch,2005;46(5):475-82.
R73
A
1005-9202(2012)23-5210-03;
10.3969/j.issn.1005-9202.2012.23.049
1 吉林大学中日联谊医院
田秀娟(1964-),女,副教授,硕士生导师,主要从事妇科肿瘤学研究。
丁秀杰(1965-),女,主治医师,主要从事妇产科临床工作。
〔2012-02-10收稿 2012-05-21修回〕
(编辑 徐 杰)

