lgr5启动子甲基化在上皮性卵巢癌中的表达及临床意义
费 梦
(荆州市第二人民医院妇产科,湖北 荆州 434000)
张传宏
(荆州市第二人民医院MRI室,湖北 荆州 434000)
lgr5启动子甲基化在上皮性卵巢癌中的表达及临床意义
费 梦
(荆州市第二人民医院妇产科,湖北 荆州 434000)
张传宏
(荆州市第二人民医院MRI室,湖北 荆州 434000)
目的:探讨lgr5甲基化与人类卵巢癌临床病理之间的联系,以及其作为判定总的生存率的价值。 方法:采用甲基化特异性聚合酶链式反应(methylation specific polymerase chain reaction,MSP)方法分析卵巢癌患者石蜡组织中lgr5启动子DNA甲基化情况。 结果:lgr5在正常卵巢组织中几乎无甲基化改变,而在良性卵巢肿瘤中频率升高,上皮性卵巢癌组织中甲基化频率明显升高(P<0.01);lgr5甲基化与低分化上皮性卵巢癌 (P<0.01)、肿瘤分期Ⅲ~Ⅳ(P<0.05)以及淋巴结转移(P<0.01)相关,但与组织类型关系不明显(P>0.05)。在70例上皮性卵巢癌患者组织中,lgr5甲基化频率为62.9%(44/70),并且5年总的生存率明显低于未甲基化的患者(P<0.05)。结论:lgr5甲基化与上皮性卵巢癌分化程度、肿瘤分期Ⅲ~Ⅳ以及淋巴结转移密切相关,同时也可以作为上皮性卵巢癌患者总的生存率的判定指标之一。
lgr5 甲基化;上皮性卵巢癌;总的生存率;甲基化特异性聚合酶链式反应(MSP)
卵巢癌是女性生殖系统常见的3种恶性肿瘤之一,因其早期临床症状不明显,起病隐匿,许多患者确诊时已是晚期。卵巢癌分型中上皮性约占90%,手术和以铂类为基础的化疗是上皮性卵巢癌的主要治疗方式,但大部分患者癌细胞耐药导致肿瘤复发,致使卵巢癌患者5年生存率不到30%[1-2]。因此,寻找卵巢癌致瘤基因以及治疗靶点是阻止或根治卵巢癌的研究热点。lgr5是近年来发现的一种致瘤基因,与卵巢癌、结肠癌、皮肤基底细胞癌以及肝细胞肝癌的发生发展都有着密切联系[3-5],特别是lgr5可以作为结肠癌和皮肤癌的肿瘤干细胞标志,并被认为是肿瘤的致瘤起源[6-7]。最近日益重视的肿瘤致瘤机制中DNA甲基化是一个重要的表观修饰方式,致瘤基因的高甲基化通常会导致肿瘤的发生发展[8]。我们试图通过检测lgr5甲基化状态改变,分析其甲基化与临床病理之间的联系,继而分析甲基化对卵巢癌预后判定的意义。
1 对象与方法
1.1对象
选取荆州市第二人民医院2000年到2006年间手术切除的卵巢石蜡组织标本。患者年龄27~82岁,平均49.75岁。所有标本经病理切片确诊,其中上皮性卵巢癌70例,交界性卵巢癌25例,良性卵巢肿18例瘤和正常卵巢组织30例。上皮性卵巢癌中,浆液性囊腺癌35例,粘液性囊腺癌19例,卵巢子宫内膜样腺癌11例,透明细胞癌5例;高分化15例,中分化22例,低分化33例;按照国际妇产科联盟(FIGO)2000年制定的临床手术病理分期标准,Ⅰ~Ⅱ期25例,Ⅲ~Ⅳ45例;淋巴结转移41例,未转移29例。所有病例手术前均未进行放射治疗及化学药物治疗。组织标本经过10%福尔马林固定,石蜡包埋。70例上皮性卵巢癌纳入随访病例,随访期限为60个月,无1例失访。
1.2方法
1.2.1 石蜡标本中DNA提取和亚硫酸盐修饰 用75%酒精擦拭切片刀、切片台等,紫外线照射消毒30min,取3~5片10μm的石蜡切片置入干净的1.5EP管。加入二甲苯1ml,室温静置15min,50℃孵育35min,70℃孵育5min。待液体清澈后,12000rpm,离心5min后,去掉上清,然后按照DNA提取试剂盒说明书操作(Qiagen)。操作完毕后,测定DNA浓度,取500ngDNA 按照DNA亚硫酸盐修饰试剂盒操作(Zymo reseach)。
1.2.2 MSP及电泳 应用在线工具methyprimer分析lgr5启动子序列,设计甲基化引物和未甲基化引物[9],并提交上海英伟杰基公司合成。取2μl修饰后的DNA加入到12.5μl 热启动 premix (Takara),MSP引物各1μl;USP引物各1μl,然后用DEPC水补充到25μl。MSP 引物序列为: CGGTAATCGGTATTTTTGTTTTC(上游),TAAACTTCTACAACTCAACGAACGT(下游);USP引物序列为: GGTGGTAATTGGTATTTTTGTTTTTT(上游),AAACTTCTACAACTCAACAAACATC(下游)。模板以ddH2O为空白对照。反应条件为:95℃5min;95℃45s,60℃1min(MSP)/ 59℃1min(USP),72℃50s,40个循环;72℃7min。反应结束后,取10μl产物在2%琼脂糖胶电泳分析。
1.3统计学分析
实验结果均采用SPSS13.0统计软件分析,组间差异采用多个样本率的χ2检验,总的生存率分析采用Kaplan-Meier分析,α=0.05。
2 结 果
2.1lgr5甲基化在各种卵巢组织中表达的变化
在正常卵巢组织检测到1例甲基化,良性卵巢肿瘤检测到2例(占11.1%),在交界性囊腺瘤组织中甲基化8例(占32.0%),在上皮性卵巢癌中甲基化44例(占62.9%)。在上皮性卵巢癌组织和卵巢交界性囊腺瘤组织中,lgr5甲基化频率相对于正常卵巢组织和卵巢囊腺瘤组织中明显升高,两组之间比较有明显统计学意义(χ2=39.372,P<0.01)。而上皮性卵巢癌组织与卵巢交界性囊腺瘤相比(χ2=7.079,P=0.008),统计学上有显著差异。结果说明,lgr5甲基化在卵巢组织癌变过程中逐步升高。
2.2lgr5与上皮性卵巢癌临床病理之间的关系
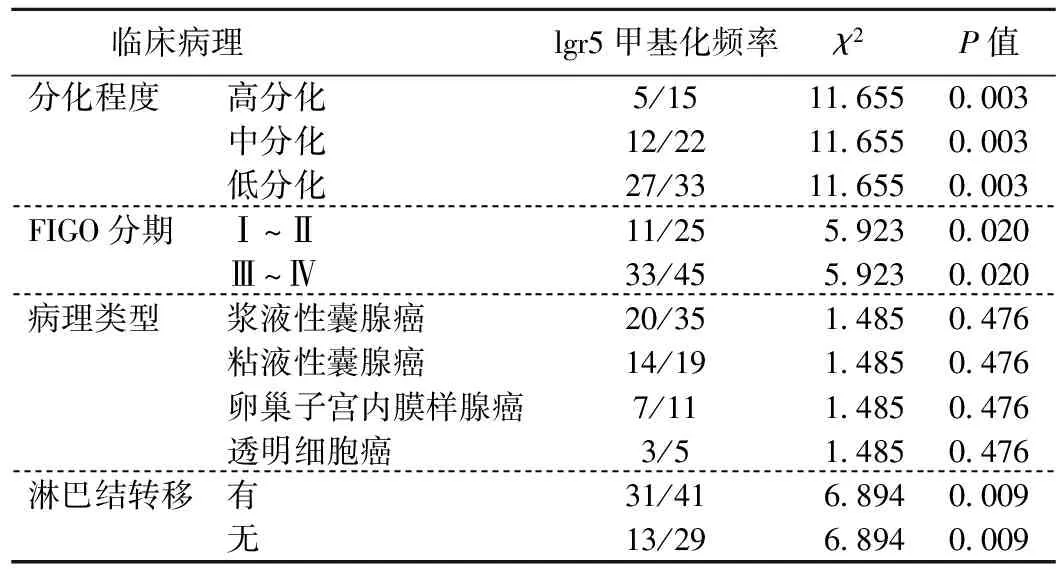
表1 lgr5甲基化与上皮性卵巢癌临床病理之间的关系
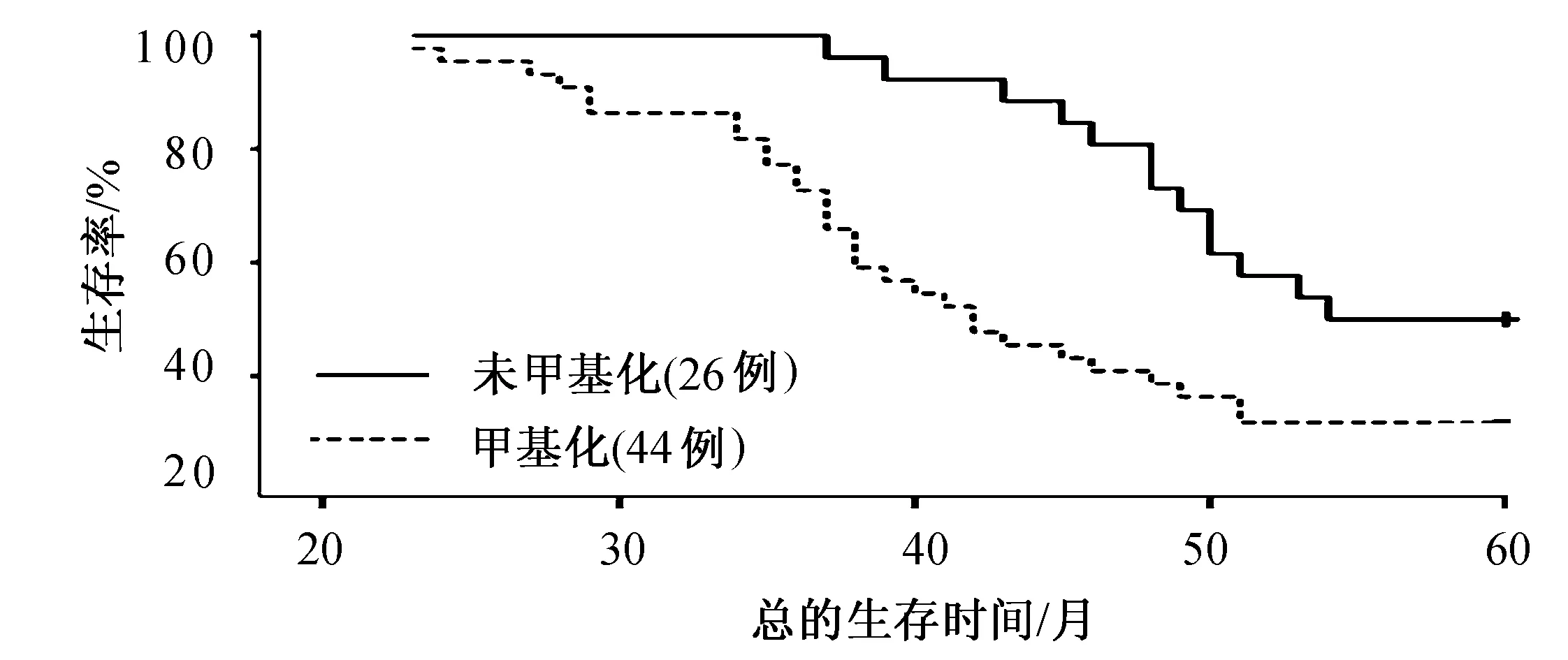
图1 lgr5甲基化与未甲基化预测卵巢癌患者总的生存率
lgr5甲基化频率在上皮性卵巢癌组织分型中改变无差异,浆液性囊腺癌中甲基化频率为20/35,粘液性囊腺癌14/19,卵巢子宫内膜样腺癌7/11,透明细胞癌3/5,组间差异无明显统计学意义(χ2=1.485,P=0.476)。在上皮性卵巢癌中,低分化癌组织中lgr5甲基化频率明显高于高、中分化(χ2=11.655,P=0.003);在Ⅲ~Ⅳ期卵巢癌中,lgr5甲基化明显增高,与Ⅰ~Ⅱ期相比有显著差异(χ2=5.923,P=0.020);并且lgr5高甲基化预示着淋巴结转移(χ2=6.894,P=0.009)(见表1)。
2.3lgr5甲基化与卵巢癌总的生存预后的关系
在70例上皮性卵巢癌患者组织中,lgr5高甲基化患者约占62.9%(44/70),与未甲基化的卵巢癌患者相比,5年生存率明显降低(P=0.020),lgr5甲基化患者的中位生存时间为44.8个月,而无甲基化的患者中位生存时间为53.5个月(见图1)。
3 讨 论
lgr5是一种独立的G蛋白偶联受体分子,属于G蛋白偶联激素受体家族一员,基因中包含了丰富色氨酸重复序列,也被称作G蛋白偶联受体49 (GPR49)[10]。与cyclinD1和c-myc类似,lgr5也被认为是受WNT信号途径调节的靶基因之一。许多研究也证实lgr5在多种肿瘤中表达升高,如肝细胞癌、皮肤基底细胞癌等[3,5]。在结肠癌细胞中,采用siRNA干扰技术敲出lgr5会导致细胞凋亡,相反,过表达lgr5可以促进结肠肿瘤细胞增殖,增强细胞致瘤能力[1,2]。最近有研究表明lgr5可以作为结肠肿瘤干细胞的标志[11]。另外有研究也发现lgr5在卵巢癌组织高表达(53%),并且与肿瘤Ⅲ~Ⅳ相关[4]。DNA甲基化被认为是肿瘤发生过程中一种非常重要的表观修饰方式[8]。多种基因如BRAC1等在卵巢癌中高甲基化可以促进肿瘤发生和发展,并且与肿瘤的病理分期或转移相关[12]。
在本研究中,我们采用lgr5启动子区特异的甲基化引物分析lgr5在卵巢癌中的甲基化状态,证实了lgr5甲基化从正常组织到上皮性卵巢癌过程中明显升高,并且在良性肿瘤中也有少量改变,尽管统计学上没有明显差异,但这可以提示lgr5甲基化可能是癌变早期的一个分子信号。另外,我们也检测了lgr5与上皮性卵巢癌临床病理之间的联系,结果发现,lgr5与肿瘤组织类型无关,但与肿瘤的分化、FIGO分期Ⅲ~Ⅳ、淋巴结转移有密切关系,从而证实了lgr5甲基化有助于判定肿瘤低分化,并且可以作为淋巴结转移的一种分子标志。 我们进一步回顾性分析了lgr5甲基化与上皮卵巢癌患者5年总的生存率之间的联系,发现在有lgr5甲基化的患者与无甲基化的患者比较而言,总的生存率明显下降。由于我们所选样本并不能代表整个卵巢癌患者群体,所以lgr5甲基化作为一种判断预后生存指标的价值还需要进一步扩大样本进行证实。
综上所述,我们认为在卵巢癌组织中,lgr5启动子区存在高甲基化状态,并且与上皮性卵巢癌临床分期Ⅲ~Ⅳ、低分化以及淋巴结转移相关,同时也论证了lgr5甲基化可以作为判断上皮性卵巢癌患者总的预后的一个指标。尽管如此,lgr5甲基化致瘤和调节转移的机制还需要深入研究,以便为卵巢癌分子生物治疗提供一个新的探索方向。
[1]刘琴,霍晓溪,刘彦,等. Wilms瘤基因在卵巢上皮性癌组织中的表达及临床意义[J]. 苏州大学学报:医学版,2009,29(4):761-762.
[2]戴宇,焦伊胜,王永来. 骨桥蛋白和基质金属蛋白酶9在上皮性卵巢癌中的表达及二者相关性[J]. 中国医科大学学报,2009,38(10):775-777.
[3]Yamamoto Y,Sakamoto M,Fujii G,et al. Overexpression of orphan G-protein-coupled receptor,Gpr49,in human hepatocellular carcinomas with beta-catenin mutations[J]. Hepatology,2003,37:528-533.
[4]McClanahan T,Koseoglu S,Smith K,et al. Identification of overexpression of orphan G protein-coupled receptor GPR49 in human colon and ovarian primary tumors[J]. Cancer Biol Ther,2006,5:419-426.
[5]Tanese K,Fukuma M,Yamada T,et al. G-protein-coupled receptor GPR49 is up-regulated in basal cell carcinoma and promotes cell proliferation and tumor formation[J]. Am J Pathol,2008,173:835-843.
[6]Barker N,van Es J H,Kuipers J,et al. Identification of stem cells in small intestine and colon by marker gene Lgr5[J]. Nature,2007,449:1003-1007.
[7]Vermeulen L,Todaro M,de Sousa Mello F,et al. Single-cell cloning of colon cancer stem cells reveals a multi-lineage differentiation capacity[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105:13427-13432.
[8]Herman J G,Baylin S B. Gene silencing in cancer in association with promoter hypermethylation[J]. The New England Journal of Medicine,2003,349:2042-2054.
[9]Li L C,Dahiya R. MethPrimer: designing primers for methylation PCRs[J]. Bioinformatics (Oxford,England),2002,18:1427-3141.
[10]Hsu S Y,Kudo M,Chen T,et al. The three subfamilies of leucine-rich repeat-containing G protein-coupled receptors (LGR): identification of LGR6 and LGR7 and the signaling mechanism for LGR7[J]. Molecular Endocrinology,2000,14:1257-1271.
[11]Barker N,van Es J H,Jaks V,et al. Very Long-term Self-renewal of Small Intestine,Colon,and Hair Follicles from Cycling Lgr5 Stem Cells[J]. Cold Spring Harbor Symposia on Quantitative Biology,2008,73:351-356.
[12]Chiang J W,Karlan B Y,Cass L,et al. BRCA1 promoter methylation predicts adverse ovarian cancer prognosis[J]. Gynecologic Oncology,2006,101:403-410.
[编辑] 一 凡
10.3969/j.issn.1673-1409(R).2012.10.003
2012-09-02
湖北省卫生厅科研基金指导性项目(JX3C54)
费梦(1979-),女,湖北荆州人,主治医师,硕士,主要从事妇产科临床与研究工作。
R737.31
A
1673-1409(2012)10-R006-03

