产油脂真菌PJX-29抗氧化活性成分研究
林 涛 杨海燕 刘天行 辛志宏
(南京农业大学食品科技学院1,南京 210095)
(新疆农业大学食品科学与药学学院2,乌鲁木齐 830052)
产油脂真菌PJX-29抗氧化活性成分研究
林 涛1杨海燕2刘天行1辛志宏1
(南京农业大学食品科技学院1,南京 210095)
(新疆农业大学食品科学与药学学院2,乌鲁木齐 830052)
对一株红树林来源的产油脂真菌PJX-29发酵产物中的抗氧化成分进行分离和鉴定。利用溶剂萃取、硅胶柱色谱及制备HPLC等分离手段从发酵产物中分离得到2个甘油酯类化合物和其他5个化合物,通过理化性质分析及波谱学方法鉴定其化学结构分别为:十五碳单甘油酯,9″,12″-十七碳二烯酸,十六烷基甘油酯,6-戊基-α-吡喃酮,4,6-二羟基-9,10-二甲基苯乙酮,双(8-8'-7羟基-4-甲氧基-5-甲基香豆素),对羟基苯甲酸,6-氨基苯甲醛,并以DPPH法评价了化合物的抗氧化活性,结果表明化合物1,化合物2 和化合物6 具有较强的抗氧化活性,其 IC50分别为:(11.38 ±0.61)、(9.33 ±0.80)和(11.12 ±1.01) μg/mL。
产油脂真菌 发酵产物 抗氧化活性
微生物油脂(microbial oils),也称为单细胞油脂,是很多微生物如霉菌、细菌、酵母菌及藻类等在一定条件下产生的油脂,其组成大多与一般植物油脂类似,为C16、C18脂肪酸。早在20世纪40年代,微生物油脂的研究就已经开始[1],到80年代初,日本的研究已初现成果,成功的利用发酵法生产长链二元酸[2],此后英国在1986年首先推出微生物油脂γ-亚麻酸生产的功能性饮料、保健食品等产品[3]。90年代后,各国对微生物来源的功能性油脂的研究与开发更加关注,且从真菌、细菌、酵母和藻类中陆续寻找到能产生活性油脂的新菌种,为功能性油脂的大量生产提供了技术依据[4]。然而,已发现的能够产生油脂的微生物种类依然有限,且大多都来源于陆地,产量较低。近年来,随着海洋科学的发展,人们发现海洋微生物能够产生化学与活性多样的化合物,其中,包括产生功能性油脂的藻类和微生物[5],因此,从海洋微生物中探寻功能性油脂成为现代食品科学的发展方向之一,而红树林则是发现海洋微生物的重要来源之一。
红树林是指位于热带、亚热带海岸潮间带的一种特殊的木本植物群落,处于陆地生态系统与海洋生态系统的过渡带,是海岸带极为独特的生态景观,孕育了丰富多样的微生物资源,从而能够产生结构多样、生物活性独特的特殊代谢产物[6],如源于红树林的微藻破囊壶-裂殖壶菌属(thraustochytrid-Schizochytrium)不仅产生三酰甘油和卵磷脂,而且还产生n-3多不饱和脂肪酸DHA[7],因此,红树林来源的海洋微生物是盛产油脂的重要菌种资源。
本研究以分离自红树林泥土的产油脂真菌PJX-29为研究对象,通过大量发酵、有机溶剂提取和分离纯化,得到发酵产物中的单体化合物,应用现代波谱学手段对化合物进行结构鉴定,采用DPPH法评价了这些化合物的抗氧化活性,以期为寻找具有抗氧化活性的天然功能性油脂开辟一条新的途径。
1 材料与方法
1.1 材料与试剂
红树林泥土:采自中国南海(海南省海口市);Sephadex LH-20:Pharmacia公司;硅胶H(100~400目):青岛海洋化工厂产品;活性测试试剂 DPPH(1,1-diphenyl-2-picrylhydrazyl)、VC:美国 Sigma公司;常规提取分离试剂乙醇、甲醇、丙酮、乙酸乙酯、石油醚、氯仿等均为工业用化学纯产品,重蒸后使用,液相色谱甲醇为色谱纯。
1.2 主要仪器
Waters 600分析型高效液相色谱(Waters 996二极管阵列检测器,Empower 2工作站,ODS-C18柱:5!m,4.6 × 250):美国Waters公司;Waters 1525 制备型高效液相色谱(Waters DAD检测器,WatersBreeze工作站,ODS-C18柱:5!m,10 × 250):美国Waters公司;Mariner API-TOF质谱仪:美国应用生物系统公司;JEOL JNM-ECP600核磁共振仪:日本JEOL公司;Spectra CountTM酶标仪:美国Packard公司;EYELAN-N旋转蒸发仪:日本东京理化器械株式会社;TC-C-100R摇床:日本高崎科学器械株式会社;洁净工作台:苏净集团安泰公司。
1.3 菌株的分离与培养
1.3.1 菌株来源
真菌菌株PJX-29是本实验室从采自中国南海(海南省海口市)红树林泥土中分离得到的。
菌株分离采用PDA固体培养基:土豆20%,葡萄糖2%,琼脂2%,食盐3%,氯霉素0.1%。
菌株分离:在无菌操作台中将泥土用无菌水润湿成糊状,取适量加入PDA平板上,涂布,平行3个重复,于培养箱中28℃培养。培养3~5 d后,挑取菌落边缘长出的菌丝,划线转接于PDA平板上,经2~3次划线分离,得到形态完全一致的单菌落,4℃下冰箱保藏。
1.3.2 发酵培养
采用真菌二号液体培养基:麦芽糖2%,味精1% ,KH2PO40.05%,MgSO4· 7H2O 0.03%,葡萄糖1%,酵母膏0.3%,玉米浆0.1%,甘露醇2%,CaCO32% ,pH 6.5,陈海水配制。
将冰箱保藏的菌株PJX-29接种于PDA斜面培养基上,于28℃培养箱中活化培养5~8 d后,接种到盛有300 mL液体培养基的三角培养瓶中,共发酵30 L于28℃温度下摇床培养10 d。
1.4 发酵产物的提取分离
1.4.1 菌株PJX-29发酵产物的提取
发酵培养液30 L经布氏漏斗过滤,分为菌丝体和发酵液。发酵液用等量的乙酸乙酯萃取3次,减压浓缩至干,得到发酵液的乙酸乙酯粗提浓缩物。菌丝体用丙酮-水(8∶1)溶液浸泡提取1 h,过滤后的菌丝体再用丙酮-水(8∶1)溶液重复提取2次后,合并提取液,减压浓缩至不含丙酮后,用等量的乙酸乙酯萃取3次,合并乙酸乙酯萃取液并减压浓缩至干,得到菌丝体的乙酸乙酯提浓缩物。合并发酵液与菌丝体的乙酸乙酯提浓缩物,用适量的甲醇-水(9∶1)溶解后,加入等量的石油醚萃取3次后,分别得到石油醚层和甲醇水层,分别减压浓缩至干。
1.4.2 菌株PJX-29发酵产物的分离
用氯仿-甲醇(1∶1)溶解甲醇水层的浓缩粗提物(10 g),然后拌入35 g 100~200目的硅胶,用旋转蒸发仪抽干溶剂后装入已装好200~300目硅胶的减压柱中,以石油醚-氯仿、氯仿-甲醇为溶剂进行梯度洗脱,每个梯度用1 000 mL溶剂洗脱,收集不同组分,分别减压浓缩至干,通过薄层色谱(TLC)将相同的组分合并,最终得到7个组分:记为 Fr.1~Fr.7。
组分 Fr.6经过 Sephadex LH-20纯化得到Fr.6 -2(200 mg)。Fr.6 -2 经过硅胶柱分离,石油醚 -丙酮(15∶1)洗脱,再通过半制备HPLC分离(90%甲醇-水、4 mL/min)得到化合物 1(15 mg、tR=17 min)和化合物2(15 mg、tR=20 min)。
组分Fr.5经过Sephadex LH-20纯化,半制备型HPLC分离(60%甲醇-水、4 mL/min)得到化合物 3(50 mg、tR=10 min)。
组分 Fr.4经过 Sephadex LH-20纯化得到Fr.4 -2(340 mg)、Fr.4 -3(500 mg)。Fr.4 -2 经过硅胶柱分离,石油醚-丙酮(15∶1)洗脱,再通过半制备型HPLC分离制备(55%甲醇-水、4 mL/min)得到化合物 4(20 mg、tR=13 min);Fr.4 -3 经过硅胶柱分离,石油醚-丙酮(10∶1)洗脱,再通过半制备型HPLC分离制备(65%甲醇-水、4 mL/min)得到化合物 5(10 mg、tR=13 min)。
组分 Fr.3经过 Sephadex LH-20纯化得到Fr.3 -3(400 mg)、Fr.3 -4(450 mg)。Fr.3 -3 经过硅胶柱分离,石油醚-丙酮(5∶1)洗脱,再通过半制备型HPLC分离(65%甲醇-水、4 mL/min)得到化合物6(10 mg、tR=11 min);Fr.3 -4 经过硅胶柱分离,石油醚-丙酮(5∶1)洗脱,再通过半制备型HPLC分离(65%甲醇-水、4 mL/min)得到化合物7(13 mg、tR=15 min)。
1.5 抗氧化活性测定
抗氧化活性测定采用DPPH法[8]。
1.5.1 抗氧化活性的测定原理
DPPH的乙醇溶液在可见光下为深紫色,在517 nm处有较强吸收,自由基清除剂能与其单电子配对而使其吸收逐渐消失,且褪色程度和与其配对的电子数成比例关系,因而可用分光光度法进行定量分析其自由基清除的程度,该方法快速、简便,是目前评价抗氧化活性的常用方法之一。
1.5.2 抗氧化活性的测试方法
分别将3 mL 1×10-4mol/L的DPPH乙醇溶液与0.1 mL不同浓度的样品溶液混合均匀,在室温条件下暗室反应30 min。用乙醇作为空白对照,在517 nm下测定吸光度(A1),同时将0.1 mL样品溶液与3.0 mL 乙醇混合,测定吸光度(A2),0.1 mL 乙醇与3.0 mL DPPH乙醇溶液混合,测定吸光度(A0)。阳性对照为VC。
1.5.3 抗氧化活性的评价方法
2 结果与分析
2.1 化合物的结构解析
化合物1:无色油状物,阳离子低分辨ESI-MS在m/z 317[M+H]+处给出准离子峰,提示该化合物的相对分子质量为316,该化合物1H-NMR谱给出丙三醇自旋体系的特征共振信号:δ 4.20(2H,m),3.81(1H,m),3.56(2H,m),说明该化合物为单取代的丙三醇结构。1H-NMR谱在高场区(δ1.13~1.68)出现长链烷烃信号,因此初步推断该化合物为单甘油酯,结合文献数据确定该化合物为十五碳单甘油酯[9],结构如图1所示。该化合物的详细核磁数据如下所示:1H - NMR(600 MHz,CDCl3)δ:4.20(2H,m,H -1),3.81(1H,m,H -2),3.56(2H,m,H -3),2.33(2H,m,H -2'),1.68(2H,m,H -3'),1.45~ 1.17(20H,m,H - 4'~ 13'),1.14(2H,m,H -14'),0.86(3H,m,H -15')。
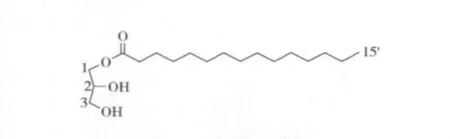
图1 化合物1的结构
化合物2:无色油状物,阳离子低分辨ESI-MS在m/z 579[M+H]+处给出准离子峰,提示该化合物的相对分子质量为578,由1H-NMR中 δ 4.20、3.91和3.60,并与化合物1的波谱数据进行比较,可知该化合物中也含有丙三醇结构,1H-NMR谱在高场区(δ1.25~2.78)出现长链烷烃信号,δ5.35 处出现双键信号,因此推测该化合物为二取代的含有双键的甘油酯,根据文献[10]并结合化合物1可确定该化合物为9″,12″-十七碳二烯酸,十六烷基甘油酯,结构如图2所示。该化合物的详细核磁数据如下所示:1H - NMR(600 MHz,CDCl3) δ:0.88(3H,t,J=6.9 Hz,H - 16'),0.88(3H,t,J=6.9 Hz,H -17″),1.31(2H,m,H -15'),1.31(2H,m,H -16″),1.26(16H,m,H -5'~12'),1.29(14H,m,H -3',13',14,4″~ 7″,15″),2.35(4H,m,H - 2',2″),3.61(1H,dd,J=5.8,11.4Hz,H - 3),3.69(1H,dd,J=4.0,11.4Hz,H -3),4.16(1H,dd,J=6.6,11.2 Hz,H-1),4.21(1H,dd,J=4.4,11.5 Hz,H -1),5.35(1H,m,H -2),5.35(4H,m,H -9″,10″,12″,13″);13C - NMR(150 MHz,CDCl3)δ:14.2(C -16',17″),22.7(C -15',16″),25.7(C -3',3″,11″),27.3(s,C -14″),27.8(s,C-8″),29.2~29.7(C -4'~13',4″~7″),31.6(s,C -2'),34.2(s,C -2″),63.4(s,C -3),65.3(s,C -1),71.9(s,C -2),127.9(s,C -10″),130.1(s,C -12″),130.3(s,C -13″),132.5(s,C - 9″),167.8(s,C - 1″),174.4(s,C -1')。
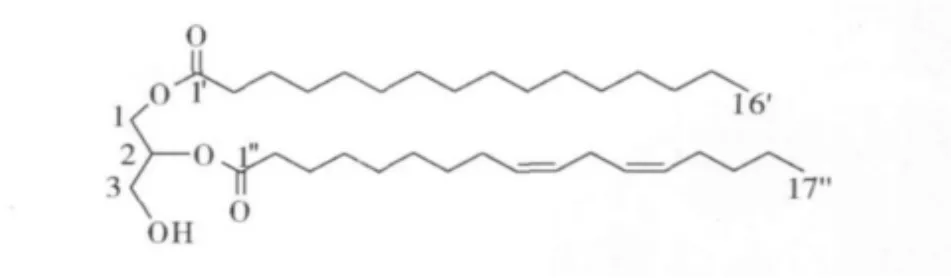
图2 化合物2的结构
化合物3:浅黄色油状物,阳离子低分辨ESIMS在m/z 167[M+H]+处给出准离子峰,提示该化合物相对分子质量为166,结合1H-NMR和13CNMR,确定分子式为C10H14O2,DEPT谱显示化合物含有1个甲基、4个亚甲基、3个次甲基和2个连氧碳,碳谱中 δC166.8推测可能为羰基信号,且 δC143.9、113.0 和102.7 为芳香区域的碳,通过分子式计算不饱和度为4,可推测该化合物中可能含有1个α-吡喃酮基,再结合上面推测的1个甲基和4个亚甲基,并与文献数据比较[11-12],确定化合物3为6-戊基-α-吡喃酮,结构如图3所示。该化合物的详细核磁数据如下所示:1H-NMR(600 MHz,CDCl3)δ:0.90(3H,t,H -5'),1.29 ~ 1.37(4H,m,H - 3',H -4'),1.67(2H,m,H -2'),2.48(2H,t,H -1'),6.00(1H,d,J=6.6 Hz,H -5),6.15(1H,d,J=9.4 Hz,H - 3),7.28(1H,dd,J=6.6,9.3 Hz,H - 4);13C - NMR(150 MHz,CDCl3)δ:13.9(s,C -5'),22.3(s,C -4'),26.6(s,C -2'),31.2(s,C -3'),33.8(s,C -1'),102.7(s,C -5),113.0(s,C -3),143.9(s,C -4),163.0(s,C -2),166.8(s,C -6)。

图3 化合物3的结构
化合物4:无色针状物,阴离子低分辨ESI-MS在m/z 179[M-H]-处给出准离子峰,提示该化合物相对分子质量为180,结合1H-NMR和13CNMR,确定分子式为 C10H12O3,δH2.02、2.14 和 2.5推测为甲基信号,δH7.52 和碳谱中 δC130.8、116.4、112.6、110.8信号,结合分子式计算出不饱和度为4,提示该化合物中含有一个苯环结构,δH9.58,12.92出现两个活泼氢信号,推测为—OH信号,碳谱中δC161.2、161.1 提示为连氧碳,δC203.6 提示为羰基碳,再结合氢谱和碳谱,并与文献数据比较[13-14],确定化合物4为4,6-二羟基-9,10-二甲基苯乙酮,结构如图4所示。该化合物的详细核磁数据如下所示:1H -NMR(600 MHz,DMSO -d6) δ:2.02(3H,s,H -9),2.14(3H,s,H -10),2.52(3H,s,H -1),7.52(1H,s,H - 8),9.58(1H,s,6 - OH),12.92(IH,s,4 - OH);13C -NMR(150 MHz,DMSO - d6)δ:8.7(s,C - 10),16.7(s,C - 9),26.7(s,C - 1),110.8(s,C -3),112.7(s,C -5),116.4(s,C -7),130.8(s,C -8),161.1(s,C -4),161.2(s,C -6),203.6(s,C -2)。
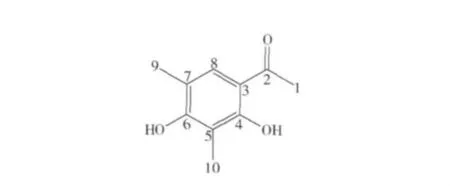
图4 化合物4的结构
化合物5:无色油状物,阳离子低分辨ESI-MS在 m/z 411[M+H]+、433[M+Na]+、阴离子低分辨ESI-MS在m/z 409[M-H]-处给出准离子峰,提示该化合物的相对分子质量为410。在1H-NMR中一共出现4个单峰,结合13C-NMR推测为1个甲基,1个甲氧基,2个芳香区域的氢,13C-NMR中一共出现11个碳信号,结合DEPT谱推测其分别为7个季碳,2个次甲基和2个甲基,再根据相对分子质量推测该化合物可能为对称结构,分子式可能为C22H18O8,结合化合物分子质量计算出不饱和度为14,推测该化合物中至少含有4个环状结构,在碳谱的低场部分提示含有—OH和羰基的信号,通过与文献数据比较[15-16],确定化合物5为双(8-8'-7羟基-4-甲氧基-5-甲基香豆素),结构如图5所示。该化合物的详细核磁数据如下所示:1H-NMR(600 MHz,DMSO - d6) δ:2.59(3H,s,H - 12/12'),3.93(3H,s,H - 11/11'),5.56(1H,s,H - 3/3'),6.71(1H,s,6 -H/H'),10.27(1H,s,7/7'- OH);13C -NMR(150 MHz,DMSO - d6)δ:23.3(s,C -12/12'),56.6(s,C -11/11'),86.5(s,C -3/3'),105.8(s,C -10/10'),106.1(s,C - 8/8'),115.7(s,C - 6/6'),137.1(s,C - 5/5'),154.0(s,C - 4/4'),158.7(s,C -7/7'),161.9(s,C -9/9'),169.8(s,C -2/2')。
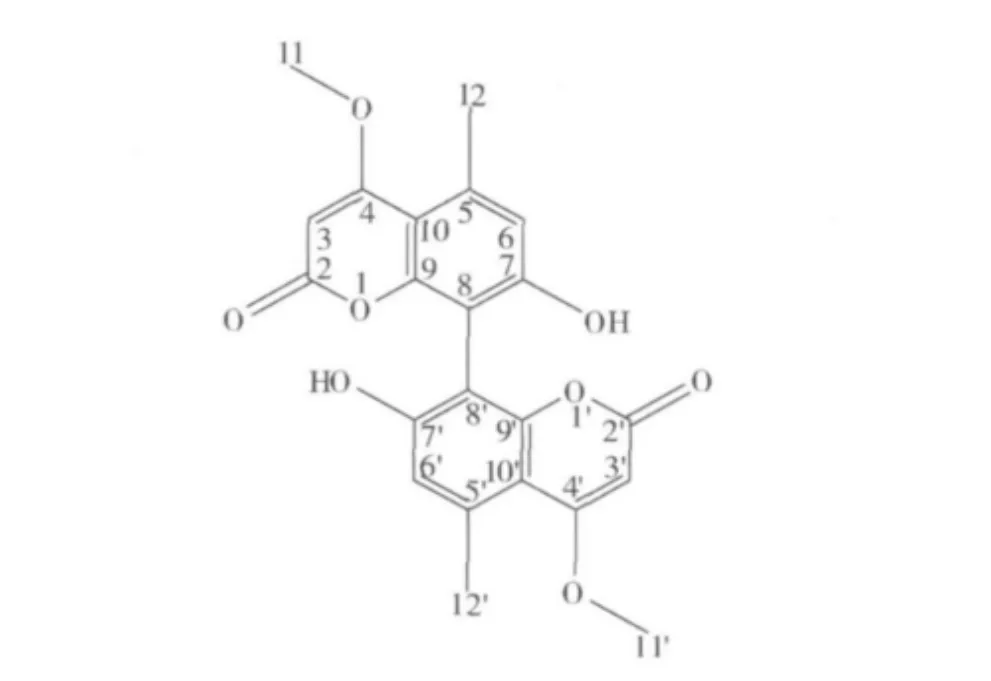
图5 化合物5的结构
化合物6:无色油状物,阳离子低分辨ESI-MS在m/z 139[M+H]+处给出准离子峰,提示该化合物的相对分子质量为138,在1H-NMR中有一组双二重峰 δH7.79(d,J=8.8 Hz,1H)和 6.83(d,J=8.3 Hz 1H),提示为苯环上的对位取代,在低场δH11.3左右出现活泼氢信号,推测为-OH信号,结合13CNMR中低场δC167.8处有1个连氧碳信号,推测该化合物中含有一个羧基信号。在低场δC162.1处有一个碳信号,推测该碳原子位于苯环上且与羟基相连,通过与文献数据比较[17-18],确定化合物 6为对羟基苯甲酸,结构如图6所示。该化合物的详细核磁数据如下所示:1H-NMR(600 MHz,DMSO-d6)δ:7.79(2H,d,J=8.8 Hz,H -2,6),6.83(2H,d,J=8.3 Hz,H - 3,5),11.37(2H,brs,4,7 - OH);13C -NMR(150 MHz,DMSO - d6)δ:115.6(s,C -3,5),122.1(s,C -1),132.1(s,C - 2,6),162.1(s,C -4),167.8(s,C -7)。

图6 化合物6的结构
化合物7:淡黄色油状物,阳离子低分辨ESIMS在m/z 122[M+H]+处给出准离子峰,提示该化合物的相对分子质量为121,1H-NMR中 δ 7.42、7.27和7.16处出现4个氢信号,并根据化学耦合常数判断其为苯环上的氢,根据峰裂分情况(2个二重峰,2个三重峰),可知其为邻位取代的苯的衍生物,通过与文献数据[19-20]比较,可确定该化合物为6-氨基苯甲醛,结构如图7所示。该化合物的详细核磁数据如下所示:1H-NMR(600 MHz,CD3OD)δ:7.43(1H,d,J=8.2 Hz,H -2),7.27(1H,m H -4),7.18(1H,m,H - 3),7.16(1H,d,J=7.7 Hz,H -5);13C - NMR(150 MHz,CD3OD)δ:191.4(s,C -1'),141.3(s,C -6),130.1(s,C -4),162.1(s,C -4),126.9(s,C -2),124.1(s,C -1),121.1(s,C -3),111.9(s,C -5)。
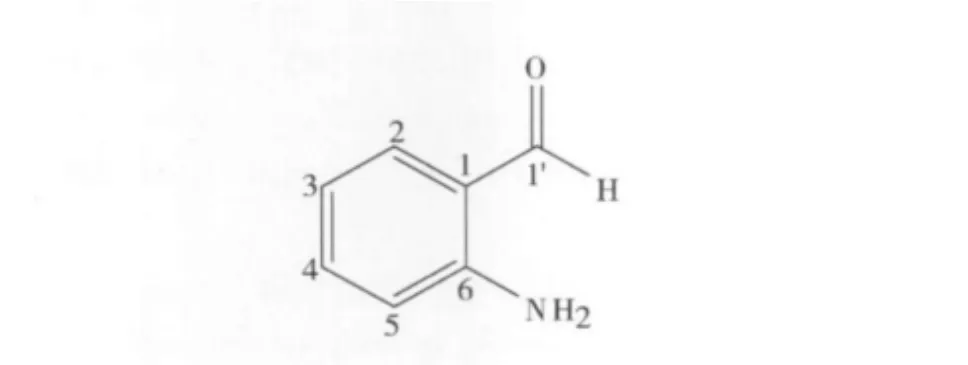
图7 化合物7的结构
2.2 化合物的抗氧化活性
采用DPPH法对菌株PJX-29发酵产物中分离得到的7个化合物进行抗氧化活性评价,测定结果如表1所示。由表1可知,化合物1~化合物7对DPPH均具有一定的清除能力,特别是化合物1、化合物2和化合物6具有较强的抗氧化活性,其IC50分别为(11.38 ±0.61)、(9.33 ±0.80)和(11.12 ±1.01)μg/mL,说明甘油酯类化合物具有较强的抗氧化活性,这可能是由于甘油酯类化合物侧链中含有不饱和双键的缘故。
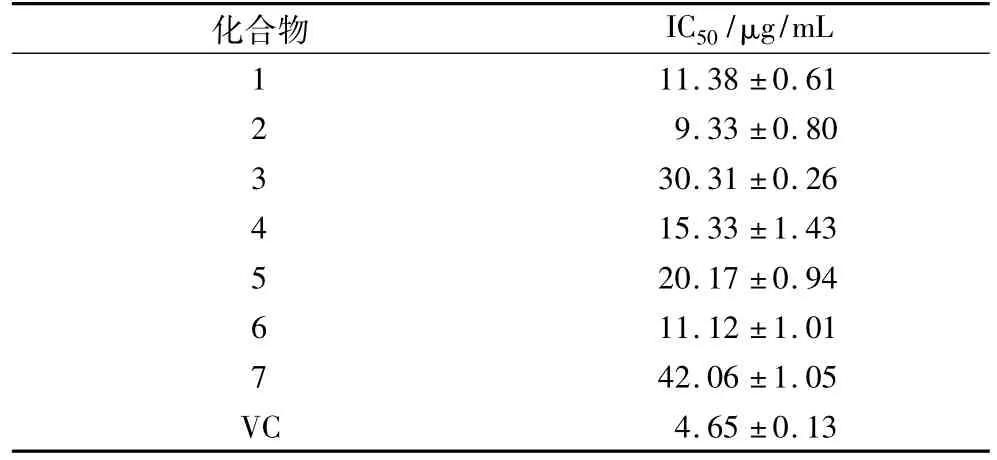
表1 7个化合物的抗氧化活性评价结果(以IC50计)
抗氧化活性物质常常在自由基清除方面发挥着重要的作用。在正常的生理情况下,机体内的自由基不断的产生并被不断清除,处于动态平衡,低浓度的自由基不仅可以保护机体,还具有独特的生理功能,但在病理和日益衰老的情况下,体内的自由基通常会代谢紊乱,产生量远远大于清除量,机体内的动态平衡被破坏,氧化应激过度而损伤机体,产生不良的生物学效应[21-22],如过量的自由基会破坏体内的生物大分子脂质、DNA、蛋白质等,使机体发生病变[23]。研究已经证实自由基与衰老[24]、高血压[25]、癌症[26]、炎症[27]等疾病有着密切关系,因此,寻找和开发天然抗氧化剂一直是食品科学研究的重要内容之一,而油脂,特别是不饱和油脂,作为人体日常必须摄入的一类物质,对保护人体健康和维持机体生理功能的正常发挥非常重要。
传统生产油脂的原料主要来源于植物的种子和果实,但受植物生长情况、产量与收获季节制约,而微生物来源的油脂可通过发酵技术大量生产,不受原料与季节限制,已成为功能性油脂生产的新途径,特别对一些具有生物活性的不饱和油脂的生产具有重要意义,如γ-亚油酸、花生四烯酸、DHA、EPA等。常用的产油脂菌主要有乳酸菌[28]、瘤胃菌[29]、丙酸菌[30],以及其他一些通过基因改造产生的工程菌种等[31-33],但是现有的产油脂微生物种类相对较少,油脂产量较低,且大多来源于陆地。本研究从海洋红树林来源真菌PJX-29的发酵产物中分离到7个化合物,其中2个甘油酯类化合物和1个苯的衍生物类化合物具有较强的抗氧化活性,说明红树林来源真菌能够产生功能性油脂与活性化合物,这为寻找产油脂的微生物提供了重要的资源菌和新的生产途径。
3 结论
利用溶剂萃取、硅胶柱色谱及制备HPLC等分离手段从一株红树林来源的产油脂真菌PJX-29发酵产物中分离了2个甘油酯类化合物和其他5个化合物,通过理化性质分析及波谱学方法鉴定其化学结构,并以DPPH法评价了化合物的抗氧化活性,结果表明化合物1,2和6具有较强的抗氧化活性,其IC50分别为(11.38 ±0.61)、(9.33 ±0.80)和(11.12 ±1.01)μg/mL,该研究结果说明红树林来源的海洋真菌能够产生具有抗氧化活性的功能性油脂,拓宽了海洋微生物研究的新领域,为进一步深入研究微生物来源的功能性油脂提供了理论基础。
[1]Connell G,Skinner C,Hurd R.Lipomyces starkeyi on the skin surface of the human body[J].Mycologia,1954:12 - 15
[2]Kiso M,Tanaka S,Tanahashi M,et al.Synthesis of 2 - deoxy -4-O-phosphono-3-O-tetradecanoyl-2-[(3R-and(3S) -3 - tetradecanoyloxytetradecanamido]——glucose:a diastereoisomeric pair of 4-O -phosphono——glucosamine derivatives(GLA -27)related to bacterial lipid A[J].Carbohydrate research,1986,148(2):221 -234
[3]Sanderson P,Finnegan Y E,Williams C M,et al.UK food standards agency a - linolenic acid workshop report[J].British Journal of Nutrition,2002,88:573 -579
[4]Li Q,Du W,Liu D.Perspectives of microbial oils for biodiesel production[J].Applied Microbiology and Biotechnology,2008,80(5):749 -756
[5]朱伟明,王俊锋.海洋真菌生物活性物质研究之管见[J].菌物学报,2011,30(2):218 -228
[6]管东生,覃朝锋.广东和海南红树林的生物地球化学特征[J].热带亚热带土壤科学,1998(4):267-271
[7]Fan K W,Jiang Y,Faan Y W,et al.Lipid characterization of mangrove thraustochytrid - schizochytrium mangrovei[J].Journal of Agricultural and Food Chemistry,2007,55(8):2906-2910
[8]Fenglin H,Ruili L,bao H,et al.Free radical scavenging activity of extracts prepared from fresh leaves of selected chinese medicinal plants[J].Fitoterapia,2004,75(1):14 - 23
[9]Zhao Q,Mansoor TA,Hong J,et al.New lysophosphatidylcholines and monoglycerides from the marine sponge stelletta sp[J].Journal of Natural Products,2003,66(5):725 -728
[10]Tallman K A,Kim H - YH,Ji J- X,et al.Phospholipid -protein adducts of lipid peroxidation:synthesis and study of new biotinylated phosphatidylcholines[J].Chemical Research in Toxicology,2007,20(2):227 -234
[11]Pittet AO,Klaiber EM.Synthesis and flavor properties of some alkyl- substituted .alpha.- pyrone derivatives[J].Journal of Agricultural and Food Chemistry,1975,23(6):1189-1195
[12]Cooney J M,Lauren D R,Poole P R,et al.Microbial transformation of the trichoderma metabolite 6-n-pentyl-2H-pyran -2 - one[J].Journal of Natural Products,1997,60(12):1242-1244
[13]Celli A M,Lampariello L R,Chimichi S,et al.New cyclohexane-and cyclohexene-1,3-diones from tetraacetylethylene[J].Canadian Journal of Chemistry,1982,60(11):1327-1332
[14]Astudillo L,Schmeda - Hirschmann G,Soto R,et al.Acetophenone derivatives from Chilean isolate of Trichoderma pseudokoningii Rifai[J].World Journal of Microbiology and Biotechnology,2000,16(6):585 -587
[15]Cutler H G,Crumley F G,Cox R H,et al.Orlandin:a nontoxic fungal metabolite with plant growth inhibiting properties[J].Journal of Agricultural and Food Chemistry,1979,27(3):592-595
[16]Hüttel W,Müller M.Regio-and stereoselective intermolecular oxidative phenol coupling in kotanin biosynthesis by Aspergillus Niger[J].Chemistry & Biochemistry,2007,8(5):521-529
[17]Hsieh T J,Su C C,Chen C Y,et al.Using experimental studies and theoretical calculations to analyze the molecular mechanism of coumarin,p - hydroxybenzoic acid,and cinnamic acid[J].Journal of Molecular Structure,2005,741(1-3):193-199
[18]Rukachaisirikul V,Khamthong N,Sukpondma Y,et al.Cyclohexene,diketopiperazine,lactone and phenol derivatives from the sea fan-derived fungi Nigrospora sp.PSU -F11 and PSU - F12[J].Archives of Pharmacal Research,2010,33(3):375-380
[19]Haddadin MJ,Zerdan RMB,Kurth MJ,et al.Efficient syntheses of the unknown quinolino[2,3 - c]cinnolines;synthesis of neocryptolepines[J].Organic Letters,2010,12(23):5502-5505
[20]Maddani M R,Moorthy S K,Prabhu K R.Chemoselective reduction of azides catalyzed by molybdenum xanthate by using phenylsilane as the hydride source[J].Tetrahedron,2010,66(1):329 -333
[21]Kaufmann JA,Bickford PC,Taglialatela G.Free radicaldependent changes in constitutive nuclear factor kappa B in the aged hippocampus[J].Neuroreport,2002,13(15):1917
[22]陈志宏,齐聪儒,杨松鹤,等.器官衰老机理和自由基学说[J].承德医学院学报,2003,20(2):143 -145
[23]Wolfe K L,Kang X,He X,et al.Cellular antioxidant activity of common fruits[J].Journal of Agricultural and Food Chemistry,2008,56(18):8418 -8426
[24]Thompson J,Legge R,Barber R.Tansley review No.8.the role of free radicals in senescence and wounding[J].New Phytologist,1987:317 - 344
[25]Sagar S,Kallo I,Kaul N,et al.Oxygen free radicals in essential hypertension[J].Molecular and cellular biochemistry,1992,111(1):103 -108
[26]Dreher D,Junod A.Role of oxygen free radicals in cancer development[J].European Journal of Cancer,1996,32(1):30-38
[27]McCord JM.Free radicals and inflammation:protection of synovial fluid by superoxide dismutase[J].Science,1974,185(4150):529
[28]R KC,B TS.Biohydrogenation of unsaturated fatty acids III.purification and properties of a-linoleate delta-12-cis,delta-11-trans-isomerase from butyrivibrio fibrisolvens[J].Journal of Biological Chemistry,1967,242(24):5686-5692
[29]YJ K,H Li R,L R J.The enrichment of a ruminal bacterium(megasphaera elsdenii YJ24)that produces the trans-10,cis- 12 isomer of conjugated linoleic acid[J].Journal of Applied Microbiology,2002,92(5):976 -982
[30]Rainio A,VahvaselkäM,Suomalainen T,et al.Production of conjugated linoleic acid by propionibacterium freudenreichii ssp.shermanii[J].Le Lait,2002,82(1):91 - 101
[31]于国萍,李庆章,霍贵成.共轭亚油酸高产菌株的诱变选育[J].食品科学,2006(12):146-148
[32]何东平,陈涛,孙松柏,等.丝状真菌发酵生产多不饱和脂肪酸的研究[J].中国粮油学报,2001(6):20-25
[33]张秀鲁,陈霄,吴昕,等.发酵法生产高含量γ-亚麻酸油脂的研究[J].中国粮油学报,1993(2):24-29.
The Study of Antioxidant Components from Oil Producing Fungi PJX-29
Lin Tao1Yang Haiyan2Liu Tianxing1Xin Zhihong1
(College of Food Science and Technology,Nanjing Agricultural University1,Nanjing 210095)
(College of Food Science and Pharmacy,Xinjiang Agricultural University2,Wulumuqi 830052)
The antioxidant components were isolated and identified from the fermentation product of the Oil production fungus PJX -29 derived from Ocean Mangroves.Two glyceride compounds and other five compounds were isolated with solvent extraction,silica gel column chromatography and preparative HPLC and their structures were identified as monoglycerides,9″,12″- Heptadecadienoic acid,1 - (hydroxymethyl) - 2 - [(1 - oxohexadecyl)oxy]ethyl ester,6-Pentyl-α -pyrone,4,6-dihydroxy-9,10-dimethylacetophenone,bis[8-8'-(7-hydroxy-4 -methoxy-5-methylcoumarin)],Hydroxybenzoic acid,6-Aminobenzaldehyde by physicochemical properties and spectral analyses,respectively.The antioxidant activity of the compounds were evaluated by DPPH method,the result showed that compounds 1,2 and 6 have potential antioxidant activity,and their IC50are(11.38 ±0.61),(9.33 ±0.80)and(11.12 ±1.01) μg/mL,respectively.
oil production fungus,fermentation product,antioxidant activity
TS201.2
A
1003-0174(2012)09-0053-07
国家自然科学基金(31071586),中央高校基本科研业务费专项(KYZ201118)
2011-11-27
林涛,男,1987年出生,硕士,食品营养与化学
辛志宏,男,1974年出生,副教授,硕士生导师,食品营养与化学

