水飞蓟素对小鼠肝损伤保护作用及机理研究
黄彩玲 肖柳英 潘竞锵
1.广东省从化市中心医院药剂科,广东 广州 510900;2.广东省广州市中医医院 (中医中药研究所),广东 广州 510130
水飞蓟素对小鼠肝损伤保护作用及机理研究
黄彩玲1肖柳英2潘竞锵2
1.广东省从化市中心医院药剂科,广东 广州 510900;2.广东省广州市中医医院 (中医中药研究所),广东 广州 510130
目的:探讨水飞蓟素对小鼠免疫性肝炎及实验性肝损伤保护作用。方法:小鼠iv卡介苗 (BCG)5×106个菌/鼠;11天后再iv脂多糖 (LPS)7.5pg/只,造成免疫性肝炎模型及对小鼠四氯化碳 (CCL4)和硫代硫酰胺 (TAA)所引起实验性中毒模型;观察水飞蓟素对免疫性肝炎及四氯化碳和硫代硫酰胺致实验性肝损伤小鼠的保护作用。结果:水飞蓟素和联苯双酯两药能明显降低免疫性肝炎及实验性肝损伤模型小鼠血清谷丙氨酸转氨酶 (ALT),谷草转氨酶 (AST)的作用 (P<0.01);血清的超氨化物岐化酶 (SOD)的活性升高、丙二醛及机理 (MDA)和一氧化氮 (NO)含量明显降低。结论:水飞蓟素对小鼠免疫性肝炎及实验性肝损伤有保护作用。
水飞蓟素;免疫性肝炎;实验性肝损伤
水飞蓟 (Silybum marianum L.Gaertn),是菊科水飞蓟属草本植物,原产于南欧、北非[1]。水飞蓟是欧洲民间的一种草药,用于治疗肝胆疾病。我国早在20世纪50年代初就引入了水飞蓟,但仅用于观赏,直到20世纪60年代末以H.Wagner为代表的德国药学家,对其有效成分进行提取后,我国才将它作为一种保肝药用植物推广种植。其中,以水飞蓟宾含量最高,活性也最强。它具有保肝[2]降血脂、抗氧化[3]。为此,我们进一步探讨水飞蓟素对小鼠免疫性肝炎及急性肝损伤的药理学机理的影响及预防和治疗作用的可能性,现报道如下。
1 材料
1.1 动物 NIH小鼠,体质量20±1.6g,由广东省医学实验动物中心提供;SD大鼠:使用许可证SYXK[粤]2008-0002生产许可证SCXK[粤]2008-0002。
1.2 药物 水飞蓟素由江苏中兴药业有限公司出品,批号20070303。卡介苗 (BCG):由广东省结核病防治研究所生产,批号:20080613-7。脂多糖 (LPS)由晶美生物工程广州分公司产品。硫代乙酰胺 (TAA)分析纯,由中国医药 (集团)上海化学试剂公司提供,批号:20070315。四氯化碳 (CCL4)分析纯,由广州市新港化工有限公司提供,批号:2007028。花生油由番禺合兴油脂有限公司提供,产品标准号GB153486生产,批号:2008028。联苯双酯由广州市市桥药业有限公司 (原市桥制药厂)生产,批号:080812。丙二醛 (MDA)测定试剂盒由南京建成生物所生产,批号:20080716。超氧化物歧化酶 (SOD)测定试剂盒由南京建成生物所生产,批号:20080413。一氧化氮(NO)测定试剂盒由南京建成生物所生产,批号:20080403。
1.3 仪器 BIO-TEK ELX-800酶标仪;日本奥林巴斯AU-400-生化分析仪。
2 实验方法[4-5]
2.1 水飞蓟素对小鼠免疫性肝炎的保护作用 取NIH小鼠100只,雌雄各半,分成5组:正常对照组,空白模型组,联苯双酯组 (150mg/kg·d),水飞蓟素高剂量组 (0.3g/kg·d),水飞蓟素低剂量组 (0.15g/kg·d)。各组小鼠分别以0.2 ml/10g灌胃给药 (正常对照组和模型对照组小鼠用等量的蒸馏水灌胃),每天灌胃1次,连续给药11d。同时,除正常对照组外,其余4组小鼠在灌胃给药的当天在小鼠尾分别静脉注射 (iv)BCG 5×106个菌/鼠;在第11天末次给药前的16小时静脉注射 (iv)脂多糖 (LPS)7.5ug/鼠,造成免疫性肝炎模型,以观察水飞蓟素对小鼠免疫性肝炎的保护作用。在给药的第12天全部小鼠眼眶放血,离心血清,测定ALT、AST、SOD、MDA、NO等生化指标。
2.2 水飞蓟素对四氯化碳 (CCL4)致急性肝损伤小鼠的保护作用 取NIH小鼠100只,雌雄各半,分成5组:正常对照组,空白模型组,联苯双酯组 (150mg/kg·d),水飞蓟素高剂量组 (0.3g/kg·d),水飞蓟素低剂量组(0.15g/kg·d)。各组小鼠分别以0.2 ml/10g灌胃给药 (正常对照组及空白模型组分别灌胃等量的蒸馏水),每天灌胃1次,连续给药8d。在第8天给药1小时后,正常对照组腹腔注射花生油,其余4组小鼠分别以0.1ml/10g进行腹腔注射0.1%四氯化碳,造成急性肝损伤模型,以观察水飞蓟素对CCL4致急性肝损伤小鼠的保护作用。各组小鼠在染毒20小时后,眼眶放血,离心血清,分别测定ALT、TP、GLB、AST生化指标与SOD、NO和MDA含量。
2.3 水飞蓟素对硫代乙酰胺 (TAA)致急性肝损伤小鼠的保护作用 取NIH小鼠100只,雌雄各半,动物分组,给药方法、剂量及时间同实验方法2.2。末次给药1h后,除正常对照组腹腔注射花生油 (0.5ml/只)外,其余各组分别进行腹腔注射TAA(50mg/kg)0.5ml/只,造成急性肝损伤模型,以观察水飞蓟素对TAA致急性肝损伤小鼠的保护作用。各组小鼠在染毒20小时后,眼眶取血,离心血清,分别测定ALT、ALB、AST、TP、MDA、SOD和NO含量。
3 结果
3.1 水飞蓟素对小鼠免疫性肝炎的保护作用 正常对照组的SOD、NO和MDA含量与空白模型组比较差异有统计学意义 (P<0.01),说明本实验的造模是成功的。水飞蓟素的高、低剂量组及联苯双酯组均能降低致免疫性肝炎模型小鼠血清的ALT、AST和ALB活性的升高, (P<0.01);但TP没有差异,血清SOD活性升高,血清MDA和NO的含量明显降低。结果见表1。
表1 水飞蓟素对小鼠免疫性肝炎保护作用 (±SD)
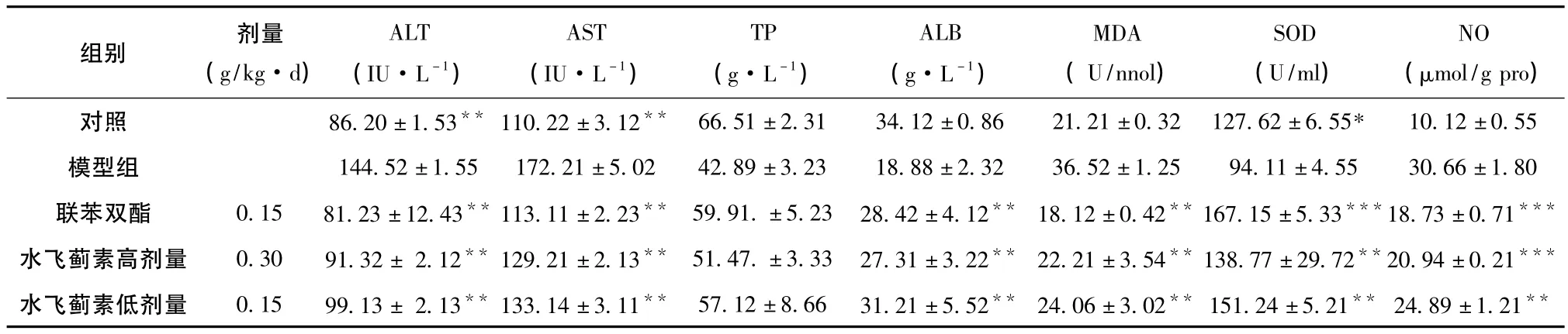
表1 水飞蓟素对小鼠免疫性肝炎保护作用 (±SD)
注: 同模型组比较,*P>0.05,*P<0.05,**P<0.01。
组别 剂量(g/kg·d)ALT(IU·L-1)AST(IU·L-1)TP(g·L-1)ALB(g·L-1)MDA(U/nnol)SOD(U/ml)NO(μmol/g pro)10.12±0.55模型组 144.52±1.55 172.21±5.02 42.89±3.23 18.88±2.32 36.52±1.25 94.11±4.55 30.66±1.80联苯双酯 0.15 81.23±12.43** 113.11±2.23** 59.91.±5.23 28.42±4.12** 18.12±0.42**167.15±5.33***18.73±0.71***水飞蓟素高剂量 0.30 91.32± 2.12** 129.21±2.13** 51.47.±3.33 27.31±3.22** 22.21±3.54**138.77±29.72**20.94±0.21***水飞蓟素低剂量 0.15 99.13± 2.13**133.14±3.11** 57.12±8.66 31.21±5.52** 24.06±3.02** 151.24±5.21** 24.89±1.21对照 86.20±1.53** 110.22±3.12** 66.51±2.31 34.12±0.86 21.21±0.32 127.62±6.55***
3.2 水飞蓟素对CCL4致急性肝损伤小鼠的保护作用 正常对照组的SOD、NO和MDA含量与空白模型组比较差异有统计学意义 (P<0.01),说明本实验的造模是成功的;各组小鼠血清中AL T和A ST活性变化CCl4模型组的ALT和AST活性较正常对照组明显升高 (P<0.01),与模型组比较,ALT和AST活性均有明显下降 (P<0.01)。水飞蓟素高、低剂量组及联苯双酯组均能明显降低CC14急性肝损伤模型小鼠血清ALT、AST和GLB(P<0.01),但TP没有差异,血清MDA和NO含量的明显降低,血清的超氧化物歧化酶 (SOD)的活性均升高,结果见表2。
表2 水飞蓟素对CCL4小鼠急性肝损伤的实验研究(+SD)
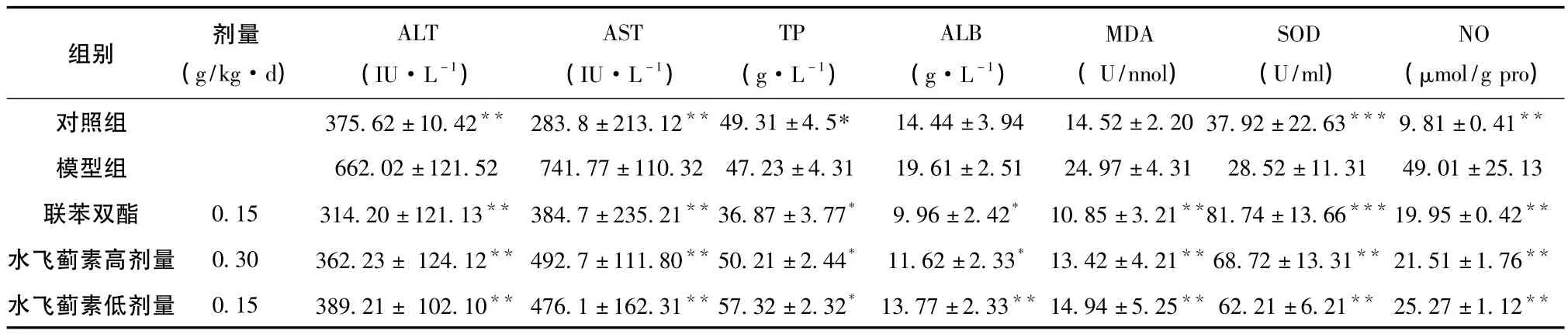
表2 水飞蓟素对CCL4小鼠急性肝损伤的实验研究(+SD)
组别 剂量(g/kg·d)ALT(IU·L-1)AST(IU·L-1)TP(g·L-1)ALB(g·L-1)MDA(U/nnol)SOD(U/ml)NO(μmol/g pro)对照组 375.62±10.42** 283.8±213.12** 49.31±4.5* 14.44±3.94 14.52±2.20 37.92±22.63*** 9.81±0.41**模型组 662.02±121.52 741.77±110.32 47.23±4.31 19.61±2.51 24.97±4.31 28.52±11.31 49.01±25.13联苯双酯 0.15 314.20±121.13** 384.7±235.21**36.87±3.77* 9.96±2.42* 10.85±3.21**81.74±13.66***19.95±0.42**水飞蓟素高剂量 0.30 362.23± 124.12** 492.7±111.80**50.21±2.44* 11.62±2.33* 13.42±4.21**68.72±13.31** 21.51±1.76**水飞蓟素低剂量 0.15 389.21± 102.10** 476.1±162.31**57.32±2.32* 13.77±2.33** 14.94±5.25** 62.21±6.21** 25.27±1.12**
注:同模型组比较,*P>0.05,*P<0.05,**P<0.01。
表3 水飞蓟素对TAA小鼠急性肝损伤的实验研究 (+SD)
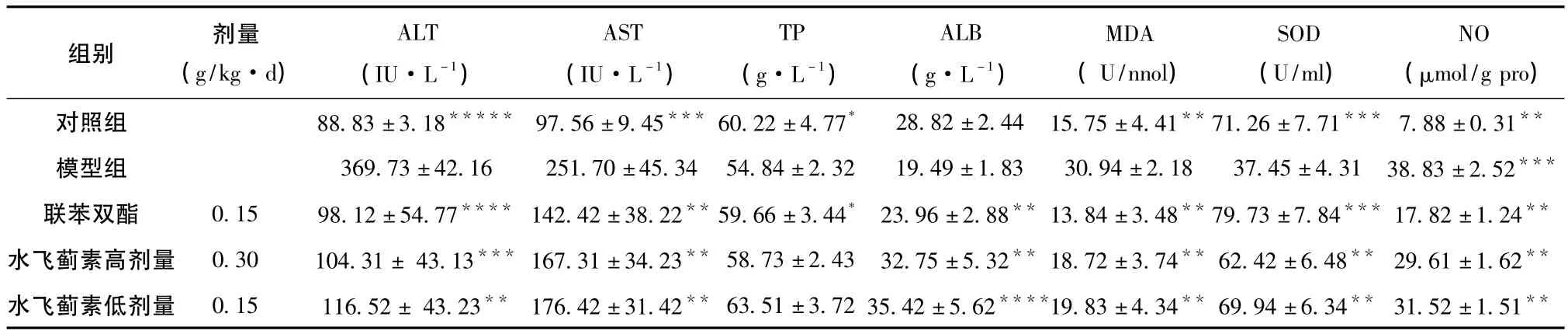
表3 水飞蓟素对TAA小鼠急性肝损伤的实验研究 (+SD)
注: 同模型组比较,*P>0.05,*P<0.05,**P<0.01。
组别 剂量(g/kg·d)ALT(IU·L-1)AST(IU·L-1)TP(g·L-1)ALB(g·L-1)MDA(U/nnol)SOD(U/ml)NO(μmol/g pro)对照组 88.83±3.18***** 97.56±9.45*** 60.22±4.77* 28.82±2.44 15.75±4.41**71.26±7.71*** 7.88±0.31**模型组 369.73±42.16 251.70±45.34 54.84±2.32 19.49±1.83 30.94±2.18 37.45±4.31 38.83±2.52***联苯双酯 0.15 98.12±54.77**** 142.42±38.22**59.66±3.44* 23.96±2.88** 13.84±3.48**79.73±7.84*** 17.82±1.24**水飞蓟素高剂量 0.30 104.31± 43.13*** 167.31±34.23** 58.73±2.43 32.75±5.32** 18.72±3.74** 62.42±6.48** 29.61±1.62**水飞蓟素低剂量 0.15 116.52± 43.23** 176.42±31.42** 63.51±3.72 35.42±5.62****19.83±4.34** 69.94±6.34** 31.52±1.51**
3.3 水飞蓟素对TAA致急性肝损伤小鼠的保护作用 正常对照组的SOD、NO和MDA含量与空白模型组比较差异显著 (P<0.01),说明本实验水飞蓟素对TAA致急性肝损伤小鼠的造模是成功的。水飞蓟素高、低剂量组及联苯双酯组均能明显降低 TAA急性肝损伤模型小鼠血清ALT、AST和GLB(P<0.001),但TP没有差异,血清MDA和NO含量的明显降低,血清的超氧化物歧化酶SOD的活性均升高。结果见表3。
4 讨论
免疫性肝炎与用化学物质造成的肝损伤的动物模型比较,在病理机制上更接近人体的肝炎。陈奇[6]治疗肝炎的中药的药效学研究,有各种经典的动物模型。韩永辉等[7]用CCl4引起肝细胞损伤时,破坏了膜的结构,肝细胞内的多种酶可透过肝细胞膜到肝窦状隙,进入血液,使血中的多种酶活性增高,由于转氨酶是肝细胞损伤最敏感的指标之一。因此,转氨酶升高,在一定程度反映了肝细胞损害的程度。
促进肝细胞修复、再生水飞蓟素进入肝细胞后可与雌二醇受体结合并使之激活,活化的受体则可增强肝细胞核内RNA聚合酶I的活性,使核糖体RNA转录增强,细胞内核糖体数目增多,促进酶及结构蛋白的合成,并间接促进DNA的合成,有利于肝细胞修复,再生。这种作用可见于受伤的肝细胞及肝切除后剩余的肝细胞,而未见于正常肝细胞及多种恶性肿瘤细胞[8]。Ph ilippe等人[11]报道水飞蓟素对CCl4诱导的脂质过氧化的保护作用,并讨论了作用机制,指出水飞蓟素具有防止CCl4的代谢激活生成的自由基和对这些自由基有清除作用。水飞蓟素能使CCl4对脂质的共价结合明显减少,CCl4所致的脂质过氧化被水飞蓟素减少72%。水飞蓟宾为抗氧自由基活性物质,其抗脂质过氧化的作用已经被实验证实。水飞蓟宾具有防止CCl4诱导的脂质过氧化作用,即能减少并清除CCl4的代谢激活生成的自由基。还有认为水飞蓟宾能使CCl4对脂质的共价结合明显减少[12]。水飞蓟宾能促进细胞DNA及结构蛋白等的合成,从而促进肝细胞修复和再生。SPC是我室自行合成的水飞蓟宾与磷脂酰胆碱的分子型复合物,具有较好的生物利用度,并且复合物中所含磷脂酰胆碱也具有抗自由基活性、抗脂质过氧化作用[13]。
实验结果表明:水飞蓟素高、低剂量组有促进免疫性肝损伤和急性肝损伤血清ALT、AST恢复的作用,提示该药具有稳定肝细胞膜作用,主要的机制可能是水飞蓟素有清除自由基,抑制脂质过氧化,抑制肝组织MDA的升高,阻止SOD的耗竭,提高SOD的活性,说明水飞蓟素对免疫性肝损伤和急性肝损伤所致小鼠急性肝损伤有明显的保护和治疗作用,能明显减轻所致小鼠肝损伤程度。从而避免肝细胞的损害,起到保护肝细胞的作用。我们利用这一模型研究证实水飞蓟素对免疫性肝炎和急性肝损伤具有很好的拮抗和保肝护肝的作用。
近年来,由于水飞蓟素显示出保肝和抗氧化以外的活性而备受关注,其中水飞蓟素表现出的抗癌和肿瘤预防作用已经显示出很好的开发潜力。它被广泛应用于医药、保健品、食品和化妆品等产品中。被称为“天然的保肝药”;作为强抗氧化剂,能够清除人体内的自由基,延缓衰老。因此我们若能积极开发生物利用度高,临床疗效好的水飞蓟素类制剂,对于开发新型抗肝病药物并扩大其临床应用范围具有非常重要的意义。
[1]西安植物园中草药研究组.水飞蓟[J].中草药通讯,1973,(6):28~35.
[2]柯铭清.中草药有效成分理化与药理特性[M].长沙:湖南科学技术出版社,1982:266.
[3]闫玉峰,于建东.水飞蓟化学成分及药理研究进展[J].中国药事,2000,14(5):335~337.
[4]张丹,林培英,肖柳英,等.健肝灵胶囊对小鼠免疫性肝炎的影响[J].中成药,2000,22(5):356-357.
[5]肖柳英,潘竞锵,饶卫农,等.荔枝核颗粒对小鼠肝损伤保护作用的实验研究[J].中华中医药杂志 (原中国中医药学报),2005,20(1):42.
[6]陈奇.中药药理学实验方法[M].北京:人民卫生出版社,1993:725.
[7]韩永辉,吕东霞,卢秉久.中药复肝解毒冲剂对四氯化碳所致大鼠急性肝损伤保护作用的实验研究[J].中华中医药学刊,2008,26(5):1074-1075.
[8] Leng - Peschlow E,strenge - Hesse A.The milk thistle and silyma2 rin as hepatic therapeutic agents[J].Phytotherap ie,1991,12(1):1621.
[9] Ph ilipp e L,et al.Biochem Pharm aco l,1993,29:2209.
[10]孙铁民,李铣.水飞蓟素药理研究进展[J].中草药,2000,31(3):229-230.
[11]徐承水,衣艳君.磷脂酰胆碱对小鼠过氧化损伤的保护作用[J].中国现代应用药学杂志,2001,18(5):375-376.
The study of Prorection effect of model silmyarin on hepatic injured in mice
HUANG cai-ling1,XIAO liu-ying2,PAN jing-qiang2
1.Department of Pharmacy,Cong Hua Central Hospital of Guangzhou,Guangzhou 510900,China;2.Guangzhou Hospital Traditional Chinese medicine(Guangzhou institute of traditional Chinese Medicine and Materia Medica),Guangzhou 510130,China
Objective:To observe the study the effect prorection of model silmyarin on Immunological hepatitis and experimental hepatotoxicity in mice.Mothods:The mouse model of immunological hepatits was established by intravenously injecting of BCG(5×106bacilli/mouse)and after 11 days intravenously injecting of lipopdysaccharide(7.5μg/mouse)and experimental hepatotoxicity mice model induced by Carbon Tetrchloride(CCL4)and Thioacetamide(TAA).The research of effect Prorection of machemism silmyarin on Immuological Hepatitis and experimental hepatotoxicity in mice.Results:The effected of silmyarin significantly decrease the liver of serum ALT、AST in mouse immulogical hepatitis model.The silmyarin could obviously increase the activity by SOD in serum of mice and the content of MDA could obviously decrease of serum.Conlusious:silmyarin could frotect mice from immunological liver injury and experimental hepatotoxicity.
silmyarin;immunological hepatitis;experimental hepatotoxicity
R965.2
A
1007-8517(2012)15-0036-03
2012.05.27)

