拌种灵丙氨酸衍生物的合成及其对大豆细胞穿透行为研究
赵 阳,胡 奎,李俊凯,方祖凯,杜铁钢(长江大学农学院,湖北 荆州434025)
拌种灵丙氨酸衍生物的合成及其对大豆细胞穿透行为研究
赵 阳,胡 奎,李俊凯,方祖凯,杜铁钢(长江大学农学院,湖北 荆州434025)
通过将拌种灵与丙氨酸拼接,合成了拌种灵丙氨酸衍生物,利用核磁共振氢谱和质谱进行了表征。以拌种灵为对照药剂,检测了该衍生物对水稻纹枯病的室内活性,以及悬浮培养条件下大豆细胞对拌种灵丙氨酸衍生物的吸收行为。结果表明,拌种灵及其丙氨酸衍生物对水稻纹枯病菌的EC50分别为(2.91±1.39)mg/L和(8.05±1.25)mg/L;在20mg/L的该药剂培养液中培养2h后,利用HPLC法检测大豆细胞内拌种灵丙氨酸衍生物含量为30.56mg/kg(FW),而相同条件下拌种灵在大豆细胞中含量仅为4.96mg/kg(FW)。可见,拌种灵氨基酸衍生物杀菌活性下降,但对大豆细胞的穿透能力显著增强。说明丙氨酸官能团能引导该衍生物通过主动吸收的方式进入植物细胞。
拌种灵丙氨酸衍生物;合成;大豆细胞;穿透
内吸性杀菌剂由于能渗透到植物体内并可传导至施药部位,自20世纪60年代应用于防治植物病害以来,使得植物病害化学防治的面貌大为改观,已经成为植物病害化学防治的主力军[1]。但由于大多数内吸性杀菌剂只有向顶性传导,不能有效地从上向下传导或者传导作用微弱,使得根部不能达到有效的防治浓度,因此采用叶面喷雾控制植物根部或微管束病害以及土传病害达不到防病的效果。长期以来,人们一直寻求能通过喷雾防治植物根部病害的药剂,特别是能双向传导的药剂[2]。
导向农药是农药的有效成分在导向基团引导下能向植物特定部位传导积累的农药[3]。作为导向基团,必须具备能引导整个分子进入植物体并向特定部位传导的功能。氨基酸在植物的生命活动中,具有重要的地位,并且在植株体内的运转主要在韧皮部内进行[4],这个过程需要质膜上特定的载体来完成,设想如果将氨基酸和高效杀菌剂进行结合,在不屏蔽各自功能结合位点的前提下,有望得到能被氨基酸载体转运的新的化合物分子[5]。Chollet等[6]采用藕合的方法从天门冬氨酸、谷氨酸和赖氨酸出发,合成了一系列α-氨基酸的衍生物,并试验了赖氨酸-2,4-D对蚕豆离体叶片从溶液中吸收葡萄糖、蔗糖和苏氨酸的影响,发现这种影响非常显著[7],同时该化合物在叶片中的吸收也明显增加[8];利用蚕豆植株进行的生物活性试验,发现该化合物具有与2,4-D同样的生物活性;通过在8叶期的蓖麻植株上的传导试验证明,当施用在植株的第4、5片叶上后,在植株上下各部位都能检测到这种化合物的存在,并且在临近的叶片和旺盛的生长点的含量高于对照所使用的赖氨酸和2,4-D的含量,由此提出了假设,可能赖氨酸-2,4-D能在载体的介导下在植株的韧皮部移动[9]。
本研究从导向农药的角度,将丙氨酸与拌种灵通过拼接合成,并试验了悬浮培养条件下大豆细胞对新化合物的吸收,为进一步筛选能在韧皮部传导的杀菌剂奠定基础,并为构建能在韧皮部传导的新型杀菌剂的开发提供新的思路。
1 材料与方法
1.1 材料、仪器与试剂
(1)供试植物及处理 将大豆(Glycinemax(L.) Merrill)种子进行无毒处理后在固体培养基上无菌萌发。从1周龄的无菌实生苗取茎尖顶端大约3~5mm的部分直接用作外植体。按照成雄鹰[10]的方法,诱导用基本培养基为MS培养基,愈伤组织形成后,转移至液体培养基中在恒温摇床上进行悬浮培养,培养条件为温度25℃,摇床转速为121r/min。培养15d进行继代转接培养,继续培养8d后供试验用。
(2)供试植物病原菌 供试菌种水稻纹枯病菌(Rhizoctoniasolani)由华中农业大学植物科技学院植物病理系提供。
(3)主要试剂 丙氨酸:上海生化试剂公司生产;97%(w/w)的拌种灵原粉:江苏南通江山农药化工股份公司提供;95%(w/w)的氯代甲酸苄酯:江苏省新沂市汇力精细化工有限公司生产;40%(w/w)HBr的冰醋酸溶液:湖北省南漳县襄九精细化工有限责任公司;醋酸锌、多聚甲醛、对甲苯磺酸、氯化亚砜等试剂均为市售分析纯。
(4)主要仪器 6ml的C18反相键合固定相SPE柱;LABOROTA 4001型旋转蒸发仪(德国博励行公司);Bruker 400型核磁共振仪(瑞士布鲁克公司);Agilent 1100 HPLC-MS仪(美国安捷伦公司);WRR熔点测定仪(上海精密科学仪器有限公司)。
1.2 试验方法
(1)拌种灵丙氨酸衍生物的合成 拌种灵丙氨酸衍生物合成路线如图1所示。在500ml圆底烧瓶中,将15g L-丙氨酸溶于200ml 2mol/L的NaHCO3溶液中,0~10℃下加入35g氯代甲酸苄酯,搅拌反应1h,转入分液漏斗中,用乙醚洗涤2次,水相用6mol/L的HCl调pH至2左右,用乙酸乙酯萃取50ml×3,乙酸乙酯层用无水硫酸钠干燥,减压浓缩,析出白色结晶,得化合物Ⅰ。将0.01mol的化合物Ⅰ和0.05mol(3.7ml)的氯化亚砜及2ml四氯化碳加入到50ml长颈烧瓶中,加上冷凝和干燥设备,回流至无气体放出,蒸去溶剂至无HCl和SO2放出,再加入干燥的二氯甲烷10ml,然后蒸去溶剂,得化合物Ⅱ。
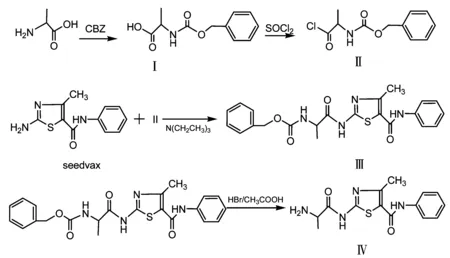
图1 拌种灵丙氨酸衍生物合成路线
在100ml的长颈烧瓶中,将拌种灵原药样品0.01mol(2.33g)溶于25ml的经金属钠干燥过的四氢呋喃中,通干燥的氮气,加入1.1ml干燥的三乙胺,冰浴中分次少量滴加0.01mol的化合物Ⅱ。60℃回流3h,冷却至室温,反应15h,薄层色谱跟踪反应进程。待反应结束后,减压蒸去四氢呋喃,体系溶于50ml的二氯甲烷中,混合物用15ml水洗,15ml 0.5mol/L的HCl溶液洗涤,15ml NaHCO3饱和溶液洗涤,再用水洗至中性。有机相用MgSO4干燥,蒸去溶剂,柱层析净化,流动相为石油醚和乙酸乙酯梯度洗脱。产物为白色固体Ⅲ。在50ml的圆底烧瓶中加入待脱保护的化合物0.01mol,加入HBr的冰醋酸溶液10ml,常温反应2h,减压浓缩蒸发掉HBr和冰醋酸,加入10ml水溶解,加入0.5mol/L的NaOH溶液至不再产生沉淀,过滤,用10ml的冰水洗固体,然后用甲醇重结晶,得产物Ⅳ,产率为47%,白色固体,熔点高于260℃。
(2)室内抑菌活性试验 采用菌丝生长速率抑制法[11]测定拌种灵氨基酸衍生物室内抑菌活性,并用拌种灵原粉作为对照,按照下式计算药液对菌丝生长的抑制率,计算药剂对水稻纹枯病菌的EC50。
(3)悬浮培养条件下大豆细胞对拌种灵氨基酸衍生物的吸收检测 配制一定量的植物细胞悬浮培养的营养液,灭菌处理。准确称取一定量的拌种灵氨基酸衍生物,用少量溶剂溶解后,用营养液定容到一定体积,使营养液中供试药剂的浓度为20mg/L。将处于生长旺盛期的植物细胞过滤,迅速转入含药营养液中,继续悬浮培养一定时间,按照文献[12]的方法利用HPLC分别测定0.5、1、2、3、5h后细胞中供试药剂的含量。
2 结果与分析
2.1 拌种灵氨基酸衍生物的表征
目标化合物拌种灵氨基酸衍生物(化合物IV)的结构经NMR和MS分析,核磁共振谱测定结果如下:1HNMR (400MHz,CH3COCH3)δ:1.38(d,J=6.8,3H,CH3-C-N),2.62(s,3H,CH3-thiazol),3.79(t,J=6.8,1H,OC-CH-N),7.08~7.78(m,5H,C6H5)。13CNMR (400MHz,CH3COCH3) δ: 16.1,17.5,54.1,120.0,121.0(2C),124.6,129.4(2C),140.0,152.4,156.4,161.5,176.2;质谱测定结果为(ESI-MSm/z): 609.4[2M+H]+,305.2[M+H]+,234.2[M-C3H6NO]+。
2.2 拌种灵氨基酸衍生物室内抑菌活性
以水稻纹枯病菌为供试菌种,拌种灵丙氨酸衍生物对水稻纹枯病菌的毒力曲线方程为y=3.8533+1.2657x,相关系数为0.9591,EC50为(8.05±1.25)mg/L。而对照药剂拌种灵对水稻纹枯病的毒力曲线方程为y=4.2592+1.5990x,相关系数0.9876,EC50为(2.91±1.39)mg/L。可见,从生物活性的测定结果看,拌种灵丙氨酸衍生物的生物活性与拌种灵相比有所下降。
2.3 处理不同时间后大豆细胞中供试药剂的含量
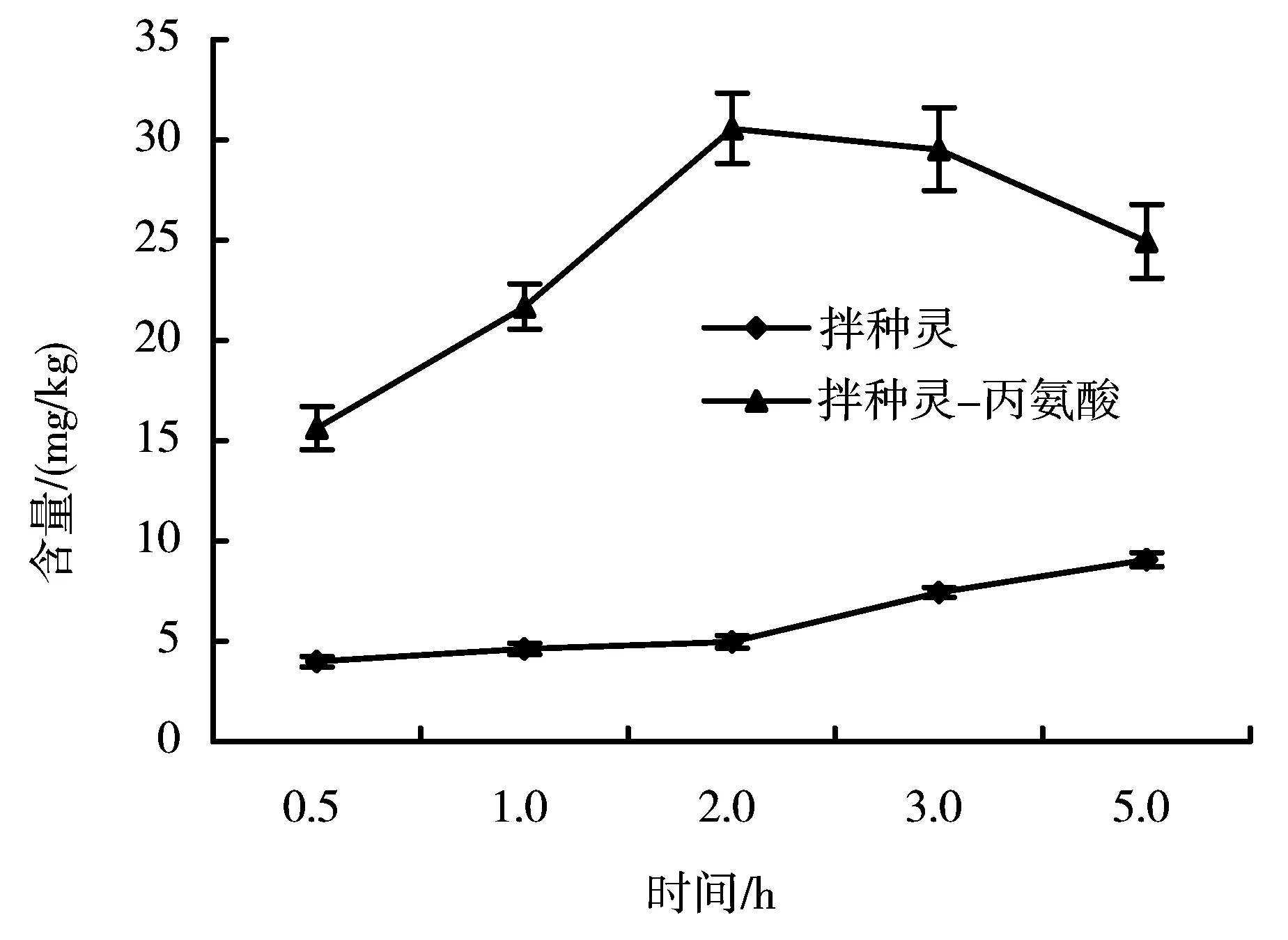
图2 处理不同时间后细胞内供试药剂的含量
大豆细胞分别在20mg/L拌种灵和拌种灵丙氨酸衍生物的液体培养液中悬浮培养不同时间,HPLC测定细胞内化合物含量的结果见图2。
从图2可知,拌种灵进入细胞体内的量随着时间的推移逐渐增加,到5h时,也未超过细胞外的浓度。而拌种灵丙氨酸衍生物进入大豆细胞的速率远远高于拌种灵,悬浮培养1h后就高于细胞外浓度,2h达到最高值,在随后的时间逐渐降低。这一结果初步说明拌种灵进入细胞内的过程是一个被动扩散的过程,拌种灵氨基酸衍生物由于存在氨基酸官能团,细胞的吸收可能由于位于细胞膜上氨基酸的载体参与了运载,是个主动吸收的过程。对于植物细胞而言,载体的参与可以使细胞内的量高于环境中的浓度,因此在短时间内细胞中化合物含量迅速升高;而这些进入细胞内的氨基酸的衍生物毕竟不是植物合成蛋白质所需要的氨基酸,因此同样可以在载体的协助下被排除细胞体外。因此当细胞内拌种灵丙氨酸衍生物的含量达到最高值后会逐渐降低到某一相对平衡的水平。
3 讨论
拌种灵作为一种顶向传导的内吸性杀菌剂,经过与丙氨酸化合后形成了拌种灵丙氨酸的衍生物,虽然杀菌活性有一定程度的降低,但其进入植物细胞的能力得到了提升,拌种灵丙氨酸衍生物能够借助于大豆细胞膜上的转运载体,通过主动吸收的方式进入细胞内。
在农药的施用过程中,人们都努力使药剂覆盖有害生物的整个栖境及被保护作物本身,由于雾滴飘移和其它环境因素的影响,到达生物靶体的农药量极低。以植物体为间接靶体,农药的有效沉积率为20%~40%,损失浪费的农药约60%~80%;以农业害虫为靶体,有效利用率为1/104~1/1011,平均为1/107。而以病原物为靶标,能到达病原物寄居部位的农药有效成分就更低[13]。拌种灵作为一种内吸性杀菌剂,杀菌谱广。但由于单向输导性,使用受到限制。与丙氨酸结合后,虽然杀菌活性有所下降,但能在丙氨酸官能团的引导下,通过主动运输的方式接入大豆细胞。这一过程可能借助于细胞膜上的氨基酸的载体完成的,因为细胞膜上氨基酸的载体既有一定的专一性,又有一定的广谱性。目前这些载体蛋白的大多数调控基因已经被定位,并用这些载体蛋白基因缺失体的植株来进行许多克隆基因的生理功能的研究。如命名为YPL265W的DIP5基因能调控谷氨酸和天门冬氨酸这2种酸性氨基酸的载体蛋白,而命名为YKR039W的GAP1基因几乎可以调控常规的氨基酸的载体蛋白。
一些具有杀菌谱广、活性高的内吸杀菌剂通过衍生,改善其传导性后有可能焕发新的活力,是新型杀菌剂开发的新思路。结合本研究结果,对化合物在植物体内的传导性可作进一步深入研究。
[1] 李俊凯,徐汉虹,王 勇.杀菌剂在韧皮部的传导性研究进展[J].世界农药,2009,31(1):26-31.
[2] Edgington L V.Structural requirements of systemic fungicides[J].Annu Rev Physiol.,1981,19:107-114.
[3]徐汉虹,张志祥,程东美,等.导向农药[J].世界农药,2004,26(5):3-10.
[4]Bush D R.Proton-coupled sugar and amino acid transporters in plants[J].Annu Rew Plant Physiol Plant Mol Bio,1993,44:513-542.
[5] Milton H S.Families of transmembrane transporters selective for amino acids and their derivatives[J].Microbiology,2000,146:1775-1795.
[6] Chollet J F,Miginiac L,Rudelle J,et al.A convenient method of protection and mild deprotection of α-amino acid group for the synthesis of functional α-amino acids[J].Synthetic communications,1993,23:2101-2111.
[7]Dufaud A,Chollet J F,Rudelle J,et al.Derivatives of pesticides with an α-amino acid function:Synthesis and Effect on threonin uptake[J].Pestic Sci,1994,41:297-304.
[8]Chollet J F,Deletage C,Faucher M,et al.Synthesis and structure-activity relationship of some pesticides with an α-amino acid function[J].Biochimeca Et Biophysica Acta,1997,1336:331-334.
[9] Grandon D,Chollet J F,Faucher M,et al.Carrier-mediated uptake and phloem systemy of a 350-Dalton Chlorinated xenobiotic with an α-amino acid function[J].Plant Physiol,2001,125:1620-1632.
[10] 成雄鹰.Somatic Embryogenesis from Protoplast-derived Callus in Soybean (GlycinemaxL.)[J].浙江大学学报(农业与生命科学版),1991,17(1):106-114.
[11] NY/T 1156.2-2006.农药室内生物测定试验准则[S].北京:中国农业出版社,2006.
[12] 胡 奎,赵 阳,张 旭,等.故乡萃取HPLC法测定烟草植株中拌种灵残留量研究[J].安徽农业科学,2012,40(13):7737-7738.
[13] 陈万义,薛振祥,王能武.新农药的研究与开发[M].北京:化学工业出版社,1995:143-145.
S482.2
A
1673-1409(2012)05-S012-04
2012-04-10
国家自然科学基金项目(30971948);湖北省教育厅资助项目(Q200712002);国家大学生创新性实验计划项目(101048913)。
赵 阳(1988-),男,宁夏隆德人,现从事新农药开发研究。
李俊凯,E-mailjunkaili@sina.com。
10.3969/j.issn.1673-1409(S).2012.05.004

