黑壳楠对低温胁迫的生理响应及耐寒性分析
黑壳楠对低温胁迫的生理响应及耐寒性分析

以1年生黑壳楠(LinderamegaphyllaHemsl)实生苗为材料,观察4种温度(5、0、-5、-10℃)胁迫下黑壳楠幼苗叶的形态变化,测定叶片中游离脯氨酸(Pro)含量、丙二醛(MDA)含量以及超氧化物歧化酶(SOD)活性的变化,研究黑壳楠的耐寒性。结果表明,1年生黑壳楠幼苗在5℃下生长发育良好,但0℃以下易使幼苗叶片发黄枯萎,叶片中Pro和MDA含量总体呈先上升后下降趋势,SOD活性则随胁迫时间延长持续下降。说明黑壳楠具备一定的抗寒能力,但0℃以下低温易使幼苗产生冻害症状。
黑壳楠(LinderamegaphyllaHemsl);低温胁迫;抗寒性;生理指标
黑壳楠(LinderamegaphyllaHemsl)是樟科山胡椒属常绿乔木,又名楠木、八角香、枇杷楠等,主要分布于我国陕西、甘肃、四川、贵州、湖北、湖南、安徽、江西、福建、广东、广西等省,多生于山坡、谷地、溪边海拔600~2000m的常绿阔叶林中[1-2]。其木材黄褐色,通直圆满、纹理美观、结构致密、奇香不衰,是建筑、家具和装饰薄木的上等良材;黑壳楠为常绿阔叶树种,叶大色亮、树形优美,还具备驱虫、净化空气和药用等多种功效,是集观赏、生态和经济于一体的庭院观赏和园林绿化树种。但黑壳楠不耐寒,对低温反应敏感,大大限制了这一优良的园林树种在北方地区的推广应用[3]。前人对黑壳楠幼苗低温胁迫下的生理效应和膜胝过氧化作用进行了初步的研究[3]。本研究以人工驯化的黑壳楠为材料,分析不同温度条件下黑壳楠叶片中游离脯氨酸(Pro)含量、丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性变化,以期为黑壳楠种质创新以及抗寒新品种的培育奠定基础。
1 材料与方法
1.1 材料
供试的黑壳楠为种植在长江大学柑橘园内的黑壳楠1年生实生苗。
1.2 方法
于2011年3月选取长势一致的幼苗移栽于相同口径的花盆中,每盆1株,置于温室中,常规管理。待新叶形成后,选取生长一致的苗木分别放于(5±1)℃(对照处理)、(0±1)、(-5±1)、(-10±1)℃的培养箱中进行低温处理,每组5盆,光照强度的5000lx。并于处理当天和处理后第3、6、9d后进行观测和统计,判断处理苗木的受冻情况,并测定其叶片中Pro、MDA含量和SOD活性。Pro含量测定采用酸性茚三酮比色法[4],MDA含量测定采用硫代巴比妥酸法[5],SOD活性参照李合生的方法[6]。取样时间为上午8:00~9:00,同一生理指标的测定选取自下而上第二片起的同一序号叶片,重复3次。
2 结果与分析
2.1 低温胁迫下黑壳楠的生长发育状况及形态变化
从处理的第2天开始,植株均表现出了不同程度的萎蔫。5℃处理后,随着处理时间的延长,植株能逐渐恢复正常,并生长良好;0℃下的植株老叶枯黄,嫩叶从叶缘叶尖向中心枯萎;-5、-10℃下植物叶面出现冰晶,叶色明显变浅变黄,沿着叶脉出现冻伤症状。
2.2 低温胁迫下黑壳楠的生理响应
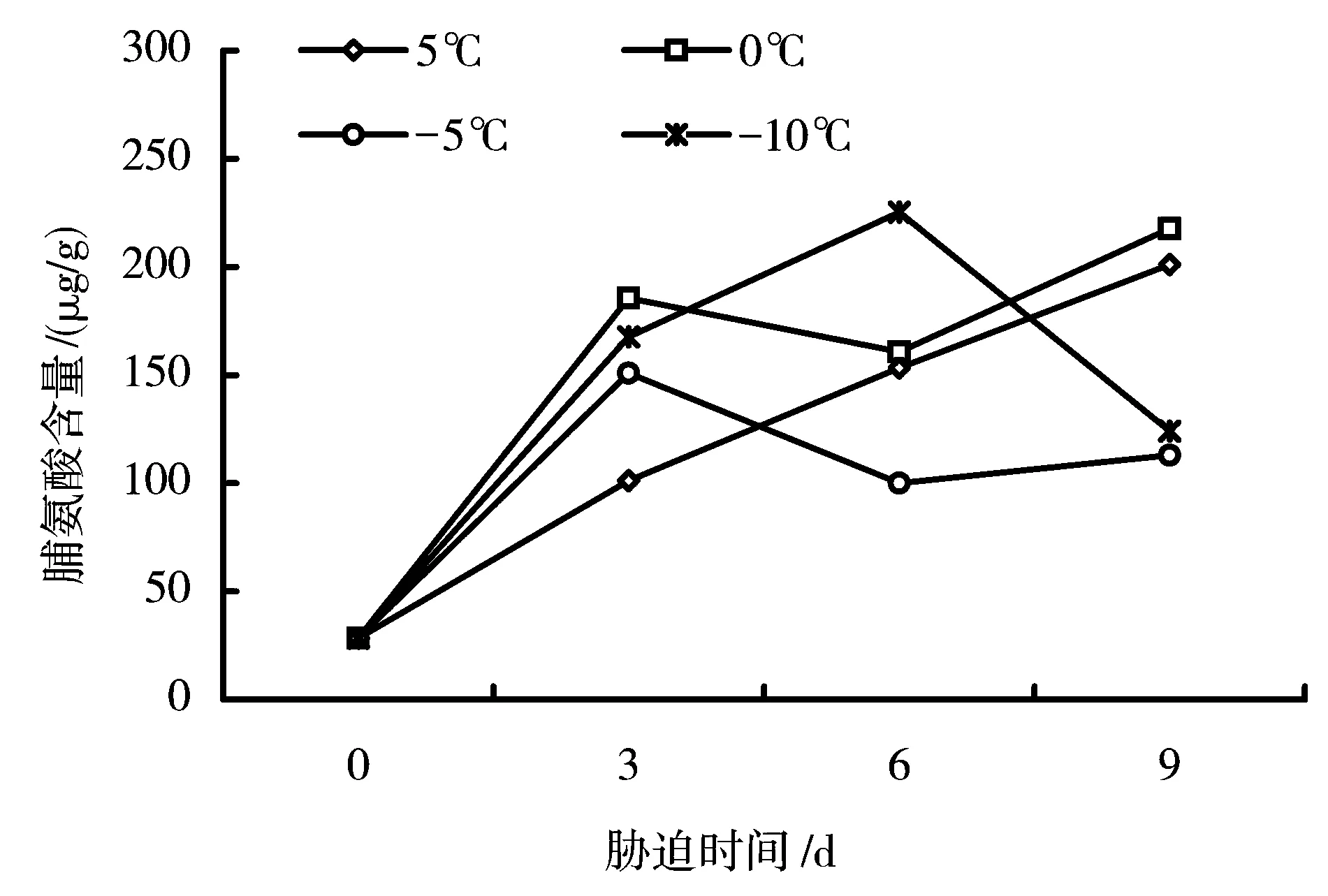
图1 持续低温胁迫下黑壳楠叶片脯氨酸含量的影响

图2 持续低温胁迫对黑壳楠叶片丙二醛含量的影响

图3 持续低温胁迫对黑壳楠叶片SOD活性的影响
(1)低温胁迫对黑壳楠叶片中Pro含量的变化 由图1可见,5℃处理下黑壳楠叶片中Pro含量随时间的延长持续增加。而在0、-5℃处理下Pro含量均出现波动,表现出先增后降然后又增加的趋势,但在-10℃的处理下,Pro含量在处理后第6d达到最高值后,开始持续下降。另一方面,在0、-5、-10℃处理3d时,Pro含量相对于对照都有50%以上的增加;但在处理后第9d,0℃胁迫下Pro含量趋近于对照,但-5、-10℃处理下Pro含量远低于对照。
(2)低温胁迫对黑壳楠叶片中MDA含量的变化 由图2可见,各温度胁迫下黑壳楠叶片中MDA含量随胁迫时间的延长总体均呈先增后减的趋势,但在不同温度胁迫下MDA含量的波动幅度和变化频率完全不同。5℃处理下,MDA的含量随胁迫时间的延长持续增加,在第6天达到最高值后持续下降;0℃处理时MDA的含量在处理后第3天达到最高值,然后下降,到第9天时MDA的含量趋近于对照;-5℃处理时MDA的含量随胁迫时间的延长持续增加,在第6天达到最高值后,开始持续下降;而-10℃处理时MDA含量在处理后第3天达到最高值,然后持续下降。从增幅来看,在低温胁迫后的第3天和第9天,MDA的含量随胁迫强度的增加而增加。
(3)低温胁迫下黑壳楠叶片中SOD活性的变化 由图3可见,除-10℃处理外,各温度胁迫下黑壳楠叶片中SOD活性随胁迫时间延长呈持续下降趋势;而-10℃处理下,SOD活性表现出先下降,后上升,直到处理后第6天升到最高,后又持续下降。从变化幅度来看,5℃处理下,SOD活性下降幅度最大,而0、-5℃下,SOD活性的下降幅度最接近。
3 讨论与结论
叶是植物对环境温度反应最灵敏的器官。对耐寒性差的植物而言,冷害(0℃以上低温)能加速植物叶片的衰老;冻害(0℃以下低温)则易造成植株死亡。从低温胁迫下黑壳楠叶片的形态来看,黑壳楠幼苗能忍受5℃低温,正常生长发育;但0℃以下低温易对幼苗造成伤害,使叶片枯老死亡[3]。
Pro是植物体内重要的渗透调节物质,当植物经受逆境胁迫时,细胞内就会迅速积累大量Pro,参与调节细胞渗透势和维持细胞膜结构的稳定性,使植物呈现抗逆性[7];而且Pro具有水溶性、水势高和在细胞内积累无毒性等特点,因而在植物的低温胁迫过程中,能作为防脱水剂从而保护植物[8]。本研究中,5℃处理下黑壳楠叶片中Pro含量随时间的延长持续增加,说明在5℃的温度胁迫下,黑壳楠能根据胁迫的程度作出积极的生理响应,产生抗寒性。而在0、-5、-10℃低温下,叶片中Pro含量总体表现先增后降的趋势,前期增加可能主要是植物对环境变温作出的本能应激反应,但随着低温胁迫时间的延长,细胞内代谢紊乱,Pro含量下降,这与形态学观察的结果基本一致。
MDA是一种膜脂过氧化的产物之一,能强烈地与细胞内部各种成分发生反应而引起酶和膜的严重损伤,导致结构和生理完整性的破坏,是膜系统受伤害的重要指标,其含量高低,可反映细胞膜脂过氧化程度[9-10]。本研究中,各温度胁迫下黑壳楠叶片中MDA含量随胁迫时间的延长总体呈先增后减的趋势,但在不同胁迫温度下叶片中MDA含量的波动幅度完全不同,而且叶片中MDA的含量随胁迫强度的增加而增加。说明温度越低,黑壳楠叶细胞中膜系统的损伤越严重,这与形态学观察的结果基本吻合。
在细胞中,SOD是一种活性氧清除剂,能清除细胞内过多的活性氧,起到保护膜系统的作用[11]。本研究中,低温胁迫下黑壳楠叶片中SOD活性随胁迫时间延长总体呈持续下降趋势,说明黑壳楠叶细胞对活性氧的清除能力下降,从而使膜氧化产物积累增多,导致MDA等积累,这与本研究叶片中MDA含量变化的结果基本吻合。而SOD经低温胁迫后活性总体下降可能与酶本身的最适反应温度相关。
[1]中国植物志编委会.中国植物志(第31卷)[M].北京:科学出版社,1982:384-386.
[2]郑万钧.中国树木志(第1卷)[M].北京:中国林业出版社,1983:689-691.
[3]滕开琼,杨秋生,戴 钢,等.低温胁迫对黑壳楠幼苗生理效应及脂质过氧化作用的影响[J].河南农业大学学报,2002,36(2):151-154.
[4]邹 琦.植物生理学实验指导[M].北京:中国农业出版社,1995:97-106.
[5]张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003.
[6]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[7]Ashraf M,Foolad M R.Roles of glycine betaine and proline in improving plant abiotic stress resistance [J].Environmental and Experimental Botany,2007,59:206-216.
[8]邓雪柯,李 良,于 昕,等.低温胁迫对紫花苜蓿生理特性影响的研究[J].四川大学学报,2005,2(1):190-194.
[9]郑小林,胡木林,罗晓莹,等.假俭草低温胁迫的伤害与适应[J].草业科学,2002,(7):55-57.
[10]张学昆,范其新,陈 洁,等.不同耐湿基因型甘蓝型油菜苗期对缺氧胁迫的生理差异响应[J].中国农业科学,2007,40(3):485-491.
[11]王建华,刘鸿先.超氧物歧化酶在植物逆境和衰老生理中的作用[J].植物生理学通讯,1989,25(1):1-7.
10.3969/j.issn.1673-1409(S).2012.02.007
Q945.78;Q949.747.5
A
1673-1409(2012)02-S018-03
2011-11-24
国务院三峡办资助项目(国三峡办规函字[2009]01号;鄂移[2009]176号);国家科技部资助项目(国科发农[2009]51号)
周 敏(1984-),女,湖北宜都人,硕士生,助教,主要从事园林植物种资源评价与利用研究。
费永俊,E-mail:fyj2010@163.com

