不同土层桃砧李丛枝菌根发育及其与3个土壤因子的关系
吴强盛(长江大学园艺园林学院,湖北 荆州 434025)
李国怀(华中农业大学园艺植物生物学教育部重点实验室,湖北 武汉 430070)
韦启安(长江大学园艺园林学院,湖北 荆州 434025)
不同土层桃砧李丛枝菌根发育及其与3个土壤因子的关系
吴强盛(长江大学园艺园林学院,湖北 荆州 434025)
李国怀(华中农业大学园艺植物生物学教育部重点实验室,湖北 武汉 430070)
韦启安(长江大学园艺园林学院,湖北 荆州 434025)
在田间条件下,研究了毛桃(Amygdaluspersica)砧秋凌李(Prunussalicina)不同土层(0~10、10~20、20~30cm)根系丛枝菌根的发育状况及其与土壤有效磷、土壤含水量和土壤pH的关系。结果表明,随着土层深度的增大,丛枝菌根的发育和土壤含水量逐渐下降,土壤有效磷逐渐升高,pH变化不一致。相关性分析结果表明,土壤有效磷与侵染程度、侵染强度、泡囊数、丛枝数、侵入点间呈现显著或极显著线性负相关关系;在同土层中土壤含水量与侵染程度关系密切,呈显著正相关关系。根际pH为中性,但与丛枝菌根发育之间没有存在显著的相关关系。以上说明,在同土层土壤有效磷是桃砧李菌根发育的主要限制因子。
李(Prunussalicina);丛枝菌根;土壤有效磷;土壤含水量;土壤pH
丛枝菌根(arbuscular mycorrhizas)是土壤中的习居菌丛枝菌根真菌与植物根系之间建立的一种互惠共生体,能帮助宿主对土壤水分和营养的吸收,反过来约20%的宿主光合碳转移到丛枝菌根真菌中供其生长[1]。丛枝菌根在园艺作物根系上普遍存在[2]。丛枝菌根真菌的活动能促进植物的生长,增强矿质营养元素的吸收,改善果实品质,提高树体的抗旱性、耐盐性和抵抗高温胁迫的能力,克服部分果树的重茬[3]。但丛枝菌根的发育受到土壤因子、宿主植物、环境条件等影响[4]。根系丛枝菌根的发育是植物菌根化的重要指标,研究不同土层的菌根发育状况对指导施肥有重要意义。丛枝菌根真菌是一种好气性真菌,在林木上随着土层深度的加深,菌根侵染率下降[5]。但对果树特别是李丛枝菌根在不同土层的侵染状况,尚缺少研究。
本研究的目的是以毛桃(Amygdaluspersica)砧秋凌李(PrunussalicinaLindl.)为试材,研究不同土层的菌根发育(侵染程度、侵染强度、侵染频度)和菌根结构(丛枝数、泡囊数、侵入点)状况,分析这些发育与3个土壤因子(土壤有效磷、土壤含水量、土壤pH)间的相关关系,从而了解李丛枝菌根的发育特性及其与土壤因子的关系,为今后丛枝菌根真菌应用于李的生产奠定基础。
1 材料与方法
1.1 材料
选用3年生的毛桃砧秋凌李,种植在长江大学园艺园林学院教学实习基地。
1.2 取样及处理
于2007年6月27日取样。由于3年生毛桃砧秋凌根系较浅,每株从土表开始分0~10、10~20、20~30cm共3个土层分别采集土样和根样。3株为1小区,重复3次,共9株。收集的土和当年生根系带回实验室,当年生根系剪成1~2cm长的根段,置于FAA固定液中固定保存(至少24h);根际土凉开,风干,过筛。
1.3 测定方法
菌根发育的测定依照Phillips等[6]的方法。菌根侵染通过根系侵染频度(F,%)、根系菌根侵染程度(M,%)和侵染根段的菌根侵染强度(m,%)表示,依据吴强盛等[7]提供的公式进行计算。菌根结构的发育程度则用单位根系中侵入点、泡囊数、丛枝数表示。土壤有效磷含量采用NaHCO3法[8]测定。土壤含水量采用烘干法[9]进行。土壤pH采用电位测定法[10]。
1.4 统计分析
运用SAS 8.1 软件的ANOVA过程对处理间作差异性的测验,采用LSD法进行多重比较分析,CORR过程作因子间的相关系数分析。由于菌根侵染频度、侵染程度和侵染强度大多在30%~70%之外,故进行方差分析之前先进行反正弦转换。
2 结果与分析
2.1 不同土层菌根侵染状况
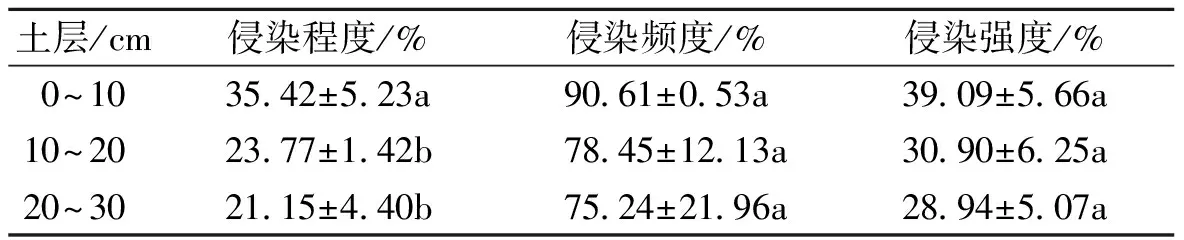
表1 不同土层丛枝菌根的侵染频度、侵染程度和侵染强度
注:同一列数字后的不同小写字母表示差异达0.05显著水平。表2~4同。
表1表明了不同土层毛桃砧秋凌李根系丛枝菌根的侵染状况。结果表明,随着土层深度的增大,侵染频度、侵染强度、侵染程度逐渐下降。在不同土层上,侵染频度与侵染强度没有表现显著差异,但在侵染程度上表现显著不同。在3个分段的土层中,以0~10cm的土层侵染程度最高,且显著高于其他他2个土层,而其他土层间没有显著差异。
2.2 不同土层菌根结构的发育状况
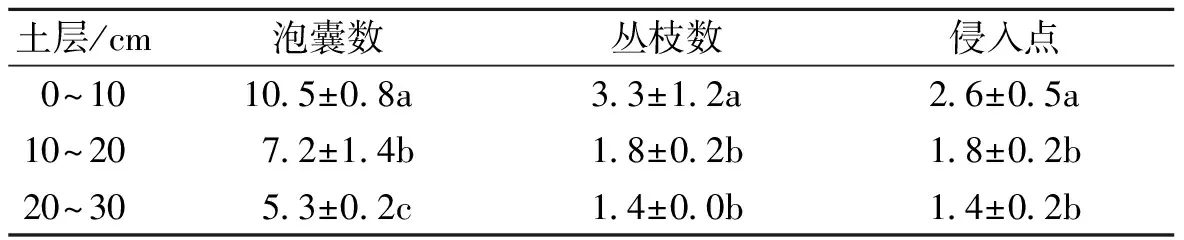
表2 不同土层丛枝菌根每厘米根长的侵入点、泡囊数和丛枝数
从表2可以看出,毛桃砧秋凌李根系的菌根每厘米根长的泡囊数为5.3~10.5个,丛枝数为1.4~3.3个,侵入点为1.4~2.6个。随着土层深度的增大,泡囊数、丛枝数、侵入点逐渐下降。在3个分段的土层中,以0~10cm的土层泡囊数最高,占了整个土层的45.65%,且显著高于其他2个土层,10~20cm土层的泡囊数也显著高于20~30cm土层的。10~20cm和20~30cm土层的丛枝数之间没有表现显著差异,但都显著低于0~10cm土层的,0~10cm土层的丛枝数占整个丛枝数的50.77%。侵入点在10~20cm与20~30cm土层间没有显著差异,但均显著低于0~10cm土层的,0~10cm土层的侵入点占整个侵入点的44.83%。
2.3 不同土层的3个土壤因子状况
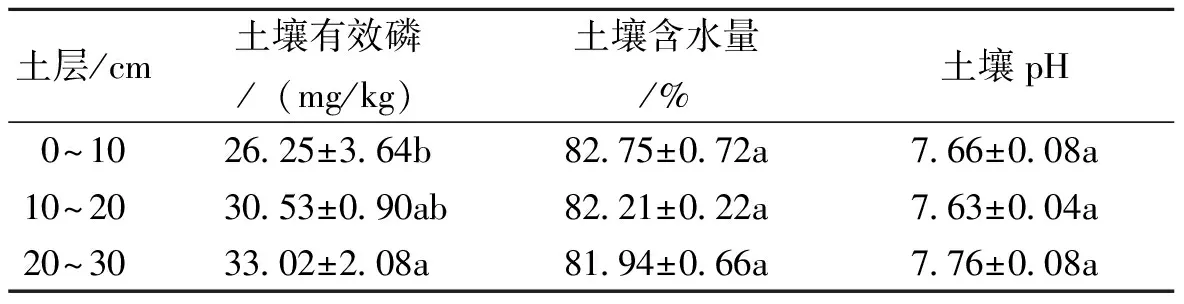
表3 不同土层的土壤有效磷、土壤含水量、土壤pH状况
表3表明不同土层土壤有效磷、含水量和pH的状况。从表3可以看出,李根际土壤有效磷含量为26.25~33.02mg/kg,土壤含水量为81.97%~82.75%,pH为7.63~7.76。随着土层深度的增大,土壤含水量逐渐下降,土壤有效磷逐渐身高,pH变化不一致。在不同土层上,土壤有效磷呈现显著不同,而土壤含水量和pH没有表现显著差异。在3个分段的土层中只有0~10cm土层的土壤有效磷显著低于20~30cm土层的。
2.4 李丛枝菌根发育状况与土壤有效磷、土壤含水量和pH的相关关系
表4表明在同土层李的菌根发育状况与土壤有效磷、土壤含水量、pH的相关关系。结果表明,在3个土壤因子中土壤有效磷与李丛枝菌根发育状况密切相关,因为同土层土壤有效磷分别与侵染程度、侵染强度、泡囊数、丛枝数、侵入点间呈显著或极显著的负相关关系。土壤含水量仅与侵染程度间有显著正相关关系,与菌根发育其他指标关系没有显著性。在同土层土壤pH与李丛枝菌根发育之间没有显著的相关关系,暗示在根际土壤pH没有影响同土层丛枝菌根的发育。
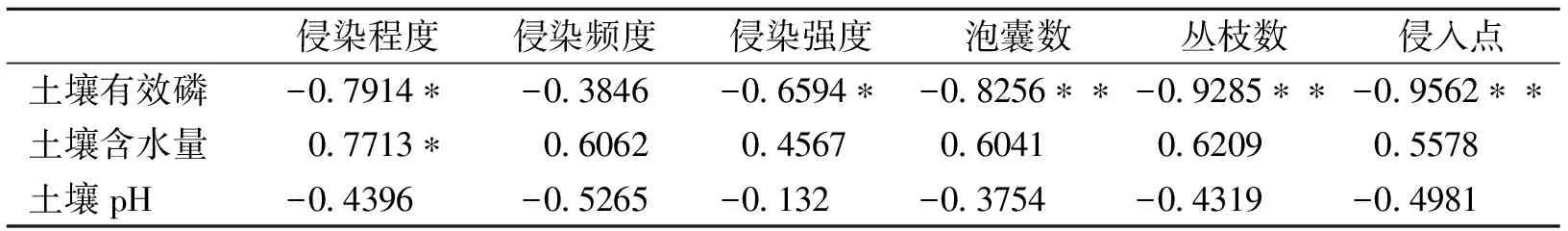
表4 李丛枝菌根发育状况与土壤有效磷、土壤含水量、pH的相关系数
注:*表示Plt;0.05,**表示Plt;0.01。
3 讨论
李丛枝菌根的发育在不同土层上明显不同。一般地,随着土层深度的加大,侵染程度、侵染频度、侵染强度、泡囊数、丛枝数、侵入点都随之下降。这与前人[11]的结果相一致。在不同土层上丛枝菌根的发育还受季节的影响。夏季梨表层土(0~20cm)菌根侵染程度为88.6%,深层土(20~60cm)为20.8%;在秋冬季两者的差别明显减少[11]。上层土壤的通透性明显优于下层土壤,这为好气性的丛枝菌根真菌生长、发育创造了良好的条件。因此,在李树果园土壤管理时,从促进菌根发育着眼,改善土壤透气性是十分重要的。
本研究结果表明,土壤含水量与侵染程度关系密切,呈显著正相关关系,说明土壤水分是菌根发育的一个因子,不可忽视。这与Allen等[13]对田间栽培的2种半干旱丛生草调查结果相符合。然而,也有报道认为,在阿根廷田间栽培的多年生草根系菌根侵染程度与土壤水分状况间没有显著关系[14]。这暗示在不同条件下菌根侵染程度对土壤水分具有较高的可塑性。
土壤有效磷的状况与丛枝菌根真菌的生长发育紧密相关,通常两者呈现负相关关系[15]。本研究也证实,在相同土层,土壤有效磷与侵染程度、侵染强度、泡囊数、丛枝数、侵入点间呈现显著或极显著线性负相关关系。Nemec等[16]观察到,柑橘根围菌根真菌孢子数量与土壤有效磷呈负相关关系。因此,可以推断,土壤有效磷越高,植物根际丛枝菌根真菌的孢子数量下降,导致植物根系受丛枝菌根真菌侵染的机会减少,最终导致植物根系丛枝菌根发育的降低。此外,土壤养分较高时,寄主植物自身根系吸收的营养就能满足植物生长的需求,不需要丛枝菌根的作用,而且丛枝菌根的发育还需消耗寄主植物的碳水化合物。Sena等[17]研究证实,在高磷(250mg/kg)土壤条件下,接种丛枝菌根真菌的红橘生长受到抑制。所以,发育良好的丛枝菌根只存在于贫瘠的特别是有效磷低的土壤,它的功能才能发挥作用。因此,李菌根发育的主要限制因子是土壤有效磷。
土壤pH是影响丛枝菌根真菌生长发育的重要因子之一,能直接影响孢子萌发和菌丝体生长[4]。本研究结果表明,李根际土壤pH为中性,但与丛枝菌根发育之间没有存在显著的相关关系,所以土壤pH不是李菌根发育的限制因子。这与Danianlson等[18]对牧草在pH 4.2~7.5土壤范围内pH对其侵染影响较小的结果相一致。也有研究表明,柑橘根际土著丛枝菌根真菌的厚垣孢子与土壤pH呈显著正相关关系[15]。导致不同结果的原因可能与研究条件、寄主植物种类不同有关。因此,未来需要进一步加强土壤pH与丛枝菌根发育关系的研究。
[1]Parniske M.Arbuscular mycorrhiza:the mother of plant root endosymbioses [J].Nature Reviews Microbiology,2008,6:763-775.
[2]Graham J M.Citrus mycorrhizae:potential benefits and interactions with pathogens [J].Hort Science,1986,21:1302-1306.
[3]吴强盛,夏仁学.果树VA菌根的研究与应用[J].植物生理学通讯,2003,39(5):536-540.
[4]吴强盛,邹英宁,王贵元.丛枝菌根真菌生态学研究进展[J].长江大学学报(自科版)农学卷,2007,4(2):76-80.
[5]Smith S E,Read D J.Mycorrhizal symbiosis [M].San Diego:Academic Press,1997.
[6]Phillips J M,Hayman D S.Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection [J].Transations of the British Mycological Society,1970,55:158-161.
[7]吴强盛,邹英宁,占 娟.葡萄丛枝菌根的发育及其与土壤有效磷的关系[J].果树学报,2009,26(3):311-314.
[8]严昶日.土壤肥力研究方法[M].北京:农业出版社,1988.
[9]黄 芳,徐红松,齐青青.土壤水分测试技术研究进展[J].安徽农学通报,2007,13(11):76-77.
[10]李 强,赵秀兰,胡彩荣.ISO10390:2005土壤质量pH的测定[J].污染防治技术,2006,19(1):53-55.
[11]周冲权,吴光林,黄寿波.果树VA菌根侵染率及其影响因素的研究[J].中国果树,1992,(1):22-24.
[13]Allen M F,Richards J H,Busso C A.Influence of clipping and soil water status on vesicular-arbuscular mycorrhizae of two semi-arid tussock grasses [J].Biology and Fertility of Soils,1989,8:285-289.
[14]Busso C A,Bolletta A,Flemmer A C,et al.Influence of soil water status on arbuscular mycorrhizas in three perennial grasses in central Argentina [J].Annales Botanici Fennici,2008,45:435-447.
[15]吴强盛.园艺植物丛枝菌根研究与应用[M].北京:科学出版社,2010.
[16]Nemec S,Menge J A,Platt R G,et al.Vesicular-arbuscular mycorrhizal fungi associated with citrus in Florida and California and notes on their distribution and ecology [J].Mycologia,1981,73:112-127.
[17]Sena J O A,Labate C A,Cardoso E J B N.Physiological characterization of growth depression in arbuscular mycorrhizal citrus seedlings under high P levels [J].Revista Brasileira de Ciencia do Solo,2004,28:827-832.
[18]Danielson R M,Visser S.Effect of forest soil acidication on ecto-mycorrhizal and vesicular-arbuscular mycorrhizal development [J].New Phytologist,1989,112:41-47.
Q948.113
A
1673-1409(2012)06-S025-03
2012-03-12
国家桃产业技术体系建设专项(CARS-31-2-4)。
吴强盛(1978-),男,江西临川人,博士,教授,研究方向为菌根生物技术。
李国怀,E-mailliguohuai@mail.hzau.edu.cn。
10.3969/j.issn.1673-1409(S).2012.06.007

