V型直链淀粉-正己醇复合物的制备及表征
刘延奇 肖欣欣 李 红 李学红 杨留枝
(郑州轻工业学院食品与生物工程学院,郑州 450002)
V型直链淀粉-正己醇复合物的制备及表征
刘延奇 肖欣欣 李 红 李学红 杨留枝
(郑州轻工业学院食品与生物工程学院,郑州 450002)
以B型微晶淀粉作为原料,分别在水和醇作溶剂的情况下,与正己醇络合制备得到V型复合物。应用扫描电镜(SEM)、X-射线衍射仪(XRD)、差式扫描量热仪(DSC)、傅里叶红外光谱仪等对两种条件下得到的V型直链淀粉-正己醇复合物的晶体结构进行了表征。应用红外光谱对水及醇溶剂法制备得到的V型直链淀粉-正己醇复合物进行测定,定性确定了V型复合物中正己醇配体的存在;进一步应用主成分分析方法(PCA)对红外吸收光谱进行分析。结果表明:水及醇溶剂法制备得到V型直链淀粉-正己醇复合物的水化物和无水形式晶体。水化物形式晶体颗粒间粘连较严重,无水形式晶体的颗粒直径均为0.5~1 μm,二者的结晶度均达到70%以上。V型直链淀粉-正己醇复合物的水化物与无水形式晶体的熔化温度几乎相同,且其复合物中醇类配体的含量分别为9.79%和4.3%。
V型直链淀粉-正己醇复合物 结晶结构 制备
短链葡聚糖结晶化得到双螺旋的B型微晶淀粉(短链直链淀粉),它可以与一些无机或有机基团进行络合,形成螺旋状内络合物(V型结晶结构)。有研究表明,短链直链淀粉易于与配体络合形成单螺旋的V型直链淀粉复合物[1]。由于分子内氢键作用,直链淀粉能与一些配合物如碘、脂类、醇、表面活性剂等发生络合,一般形成左旋的单螺旋结构。V型直链淀粉-正己醇复合物是容易稳定获得的六边形晶体,每螺旋中含有6个葡萄糖残基且单螺旋之间的间距较小。相对其他V型直链淀粉-醇类复合物,V型直链淀粉-正己醇复合物结构更稳定,更易对其晶体结构进行定量表征。而复合物的稳定性、配体在复合物其中所占的比例等,则依具体的制备条件而有很大的差异[1]。
目前制备V型复合物的方法主要包括两大类,一类是粗放的食品加工工艺方法,如蒸汽喷射蒸煮法[2],挤压蒸煮法[3],微波法[4],超声法[5];另一类是复合物的结晶化方法,包括溶剂法[6],马铃薯磷酸化酶催化合成法[7],冷冻法[8]等制备方法。本试验分别采用水和醇作溶剂的制备方法均属于复合物的结晶化制备方法。通过对水溶剂法与醇溶剂法进行比较,用以探索制备条件对复合物结构的影响且有助于进一步认识V型直链淀粉-复合物的结晶结构。
1 材料与方法
1.1 试验材料与仪器
马铃薯淀粉:甘肃超星淀粉有限公司;乙醇、正己醇、二甲基亚砜(DMSO)均为分析纯化学试剂。
SHC-II2型循环水式真空泵:郑州长城科工贸有限公司;ZD-85型气浴恒温振荡器:江苏金坛市医疗仪器厂;LG10-24A型高速离心机:北京医用离心机厂;NETISCH-449C型差式扫描量热分析仪:德国NETISCH公司;Philips XL-3型扫描电子显微镜:日本日立公司;BurkerD8型X-射线衍射仪:德国布鲁克公司;FTS3000型红外光谱扫描仪:美国BIORAO。
1.2 试验方法
1.2.1 B型微晶淀粉的制备
B型微晶淀粉参照文献[9]中的方法制备。
1.2.2 V型直链淀粉-醇类复合物的制备(溶剂法)
1.2.2.1 水溶剂法
取B型微晶淀粉10.0 g溶解在预热的25 mL DMSO中,随后注入到175 mL去离子水中配置成5%淀粉溶液,90℃水浴下恒温备用。取2.5 g正己醇配体溶解在预热的20 mL 95%乙醇中,随后逐滴加入到热的淀粉溶液中。混合后的溶液在90℃下静置4 h,每0.5 h缓慢摇晃一次。随后取出使其缓慢冷却到室温。静置48 h后离心,弃去上清液,收集沉淀并在室温下晾干即得V型复合物。
1.2.2.2 醇溶剂法
取B型微晶淀粉0.5 g溶解在10 mL DMSO中配制成5%淀粉溶液,90℃水浴恒温45 min,随后冷却至72℃。将100 mL的正己醇预热到72℃左后,逐滴加入到热的淀粉溶液中。混合后的溶液在72℃下静置4 h,随后取出使其缓慢冷却到室温。48 h后离心分离,弃去上清液,收集沉淀并在室温下晾干即得V型直链淀粉-正己醇复合物。
1.2.3 扫描电子显微镜分析(SEM)
观测样品之前,样品利用喷涂仪对其进行镀金处理,在操作电压为20 kV时,使用扫描电子显微镜(SEM)对样品观察拍照。
1.2.4 X-射线衍射法分析(X-RD)
取适量微晶淀粉粉末置于长方形铝片的孔中(孔大小为15 mm×20 mm,厚为115 mm),随后压紧,用BurkerD8型X射线衍射仪测定,所用波长为0.154 2 nm的单色Cu-Kα射线。
测试条件为:管压3 kV,管流20 mA,扫描速度4°/min,扫描区域5°~35°,采样步宽0.02°,扫描方式为连续,重复次数为1。
1.2.5 V型直链淀粉-醇类复合物的DSC分析
取约0.005 g干燥的V型复合物的样品放入已称好的样品盘中,将样品盘压紧密封,放入DSC仪器中进行测定。测试条件为:升温速率1℃/min,扫描范围35~130℃。
1.2.6 傅里叶红外光谱(FT-IR)测试
取约1 mg干燥V型复合物于玛瑙研钵中并加入约100 mg干燥的KBr,混合物在研钵中混合均匀,随后将其放置到压膜器进行压制,取出样品薄片进行红外扫描。
1.2.7 红外光谱定量分析数据处理
利用主成分分析方法(PCA)结合SPSS13.0统计软件对样品的红外光谱进行因子分析,确定主成分的个数并对其建立数学模型。利用主成分与红外吸收曲线中振动峰的相关性,结合DPS7.05统计软件中主成分分析得出主成分的得分并将其转换成配体含量。
2 结果与讨论
2.1 V型直链淀粉-正己醇复合物的表观分析
水及醇溶剂法均可以得到V型直链淀粉-正己醇复合物,其晶体的扫描电镜照片如图1所示。水溶剂法制备得到晶体的表面淀粉颗粒粘连比较严重,醇溶剂法制备得到的复合物也有轻微粘连,但粘连的颗粒形状比较明显且大多呈现椭圆形状,颗粒直径约为0.5 ~1 μm。
由此可知,水分的存在对V型复合物结晶结构有明显的影响。V型晶体淀粉颗粒的大小远远小于B型微晶淀粉的颗粒直径(5 μm),这可能是由于短淀粉链的双螺旋解离出直链淀粉且受到醇类的络合和侵蚀造成的。

图1 水及醇溶剂制备法得到的V型复合物的SEM照片(×4000倍)
2.2 V型直链淀粉-正己醇复合物的X-射线衍射图谱分析
图2是水及醇溶剂法所制备得到的V型直链淀粉-正己醇复合物的X-射线衍射图谱。水溶剂法制备得到产物的 XRD 图谱中在 2θ =7.68°、13.2°、20.12°处有较明显的特征衍射峰。醇溶剂法制备得到产物的 XRD 图谱中在 2θ =7.72°、13.4°、20.6°处有较明显的特征衍射峰。无论是水溶剂法还是醇溶剂法制备得到固体粉末的XRD图谱中的特征衍射峰均与J.A.Putseys等[1]研究表明的V型复合物XRD 图谱中的特征衍射峰位置相接近。水及醇溶剂法制备得到的V型复合物分别与P.Le Bail等[10]研究表明Vh(水化物形式的六边形晶体)和Va(无水形式的六边形晶体)型晶体特征衍射峰的位置更为接近。水溶剂法制备得到V型复合物的XRD图谱在2θ=15.32°处出现了较弱的A型微晶淀粉特征衍射峰。
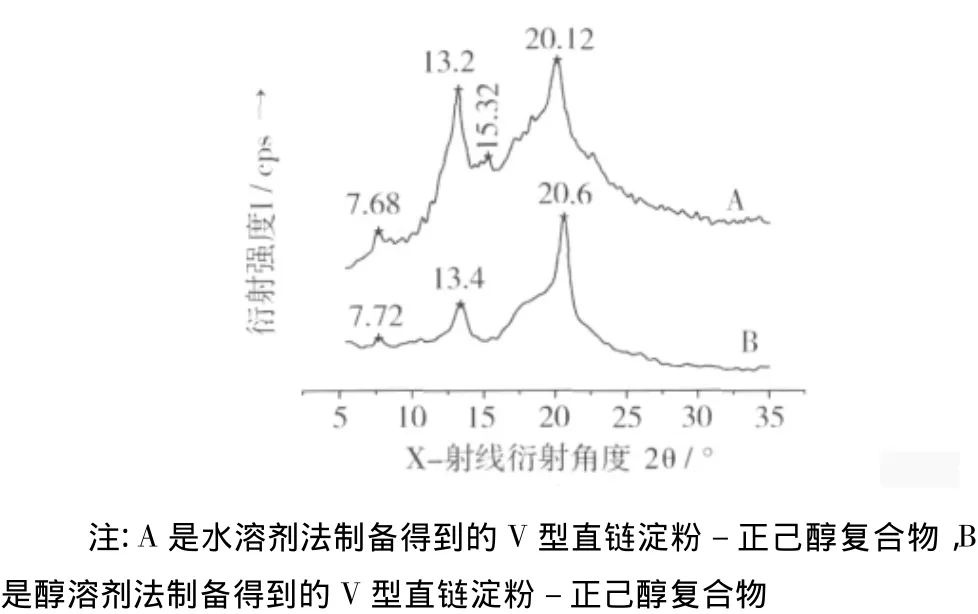
图2 V型直链淀粉-正己醇复合物的X-射线衍射图谱
通过水和醇溶剂法制备得到V型直链淀粉-正己醇复合物分别是水化物和无水形式晶体,其XRD图谱分析见表1。无水形式较水化物形式晶体的特征衍射峰的角度偏大一些。除了第一个特征衍射峰外,无水形式与水化物形式晶体相比,前者的衍射峰强度、相对总面积和衍射峰面积均小于后者,但其相对结晶度却呈现相反趋势,二者的结晶度均达到了70%以上。
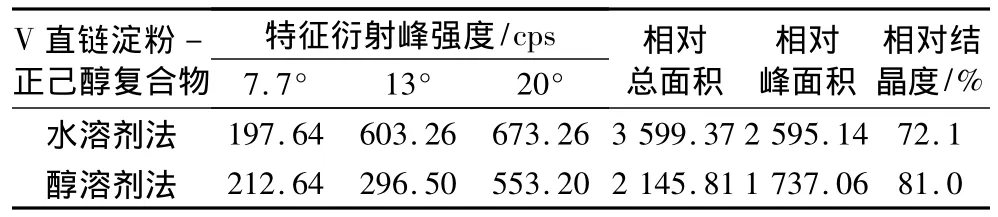
表1 不同制备方法对V型复合物中各特征衍射峰的强度和相对结晶度的影响
2.3 V型直链淀粉-正己醇类复合物的DSC图谱分析
利用水及醇溶剂法得到V型直链淀粉-正己醇复合物的差式扫描热分析图谱如图3所示。在DSC图谱中,醇溶剂法与水溶剂法制备得到晶体的吸热峰宽度相比更为宽广。通过水和醇溶剂法制备得到V型直链淀粉-正己醇复合物分别是水化物和无水形式晶体。无水形式的晶胞体积较水化物形式晶体明显小很多,这主要是醇溶剂法制备过程中没有添加蒸馏水,室温晒干得到晶体中只含有极少量的水分。同时,无水形式晶体螺旋中络合配体的量与水化物形式晶体相比有所减少。因此,与水溶剂法制备相比醇溶剂法得到的晶体,其晶体结构的流动性、迁移性偏差、螺旋结构的伸展性不好,引起DSC图谱中的吸热峰更加宽广。
水及醇溶剂法制备得到晶体的熔化温度几乎相同,其晶体的熔化温度分别为70.7℃和69.36℃,变化的幅度仅为1.9%。引起醇溶剂法制备得到晶体熔化温度偏低一点的原因,可能是由于其含有的水分很少,而水分子也是吸热物质。本试验条件下制备得到的V型复合物中,配体可能没有真正的络合进入直链淀粉单螺旋腔内,而是存在于单螺旋之间,从而导致制备得到的V型直链淀粉-正己醇复合物的熔化温度低于100℃。
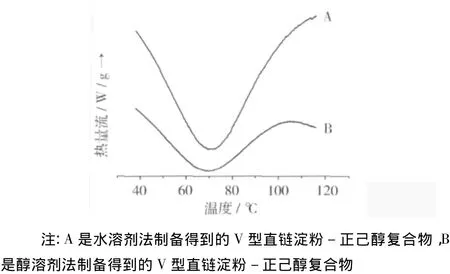
图3 水及醇溶剂法制备得到V型直链淀粉-正己醇复合物的差式扫描热分析图谱
2.4 配体含量的定性定量分析
2.4.1 定性分析
B型、V型直链淀粉-正己醇复合物的水化物形式(水溶剂法)和无水形式(醇溶剂法)晶体的红外吸收光谱如图 4 所示,在 340 7、292 9、164 5、101 8、136 9、136 1 和1 000 ~1 300 cm-1处存在吸收峰,且对应的官能团分别为—OH基团的伸缩振动峰、—CH2—基团的伸缩振动峰、—CHO基团的伸缩振动峰、C—O基团的伸缩振动峰、—CH3基团的伸缩振动峰、C—O—C的伸缩振动峰。V型复合物水化物形式和无水形式晶体的红外吸收曲线中各个振动峰强度和尖锐程度均强于B型微晶淀粉。V型直链淀粉-正己醇复合物的水化物形式较无水形式晶体的各个振动峰强度和尖锐程度均有所增强。
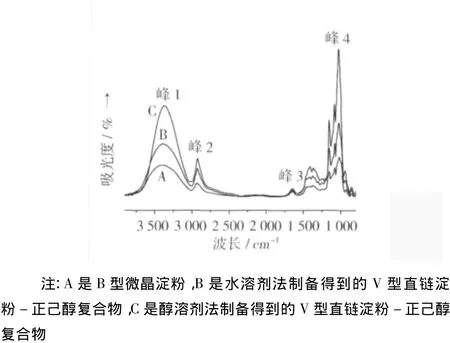
图4 B型微晶淀粉和V型直链淀粉-正己醇复合物的红外光谱
2.4.2 定量分析
利用主成分分析方法(PCA)对红外吸收曲线进行定量分析,分别对B型微晶淀粉、V型直链淀粉-正己醇复合物的水化物形式和无水形式晶体的红外光谱中峰1、峰2、峰3和峰4(如图4)这4个特征峰进行主成分分析。经Bartlett球形检验,P值均为0.000 1<0.05,达到显著性差异,因此适合于因子分子。通过SPSS13.0统计软件进行因子分析,结果列于表2和表3中。
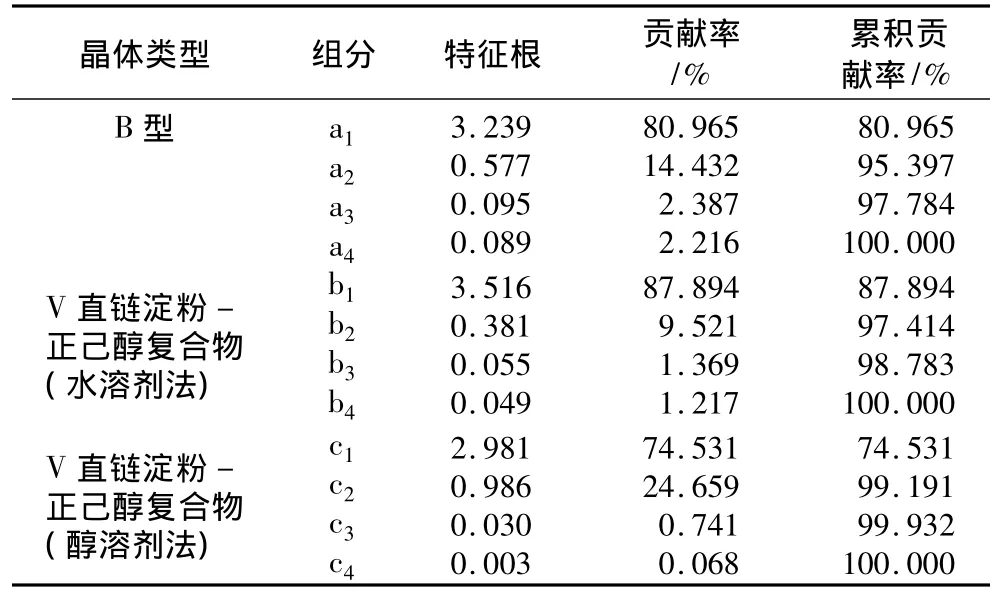
表2 B型微晶淀粉和V型直链淀粉-正己醇复合物主成分分析的特征根和贡献率
由表2中B型微晶淀粉、V型直链淀粉-正己醇复合物水化物形式和无水形式晶体的红外吸收图谱主成分分析看出,前两个主成分的累积贡献率分别为 95.397%、97.414%和 99.191%,表明前两个主成分已经把B型微晶淀粉、V型直链淀粉-正己醇复合物水化物形式和无水形式晶体红外吸收曲线95%以上的信息反映出来。己醇配体的存在引起。因此,将V型复合物主成分b2或c2的得分分别减去B型微晶淀粉主成分a2的得分,即得到晶体中正己醇配体含量。
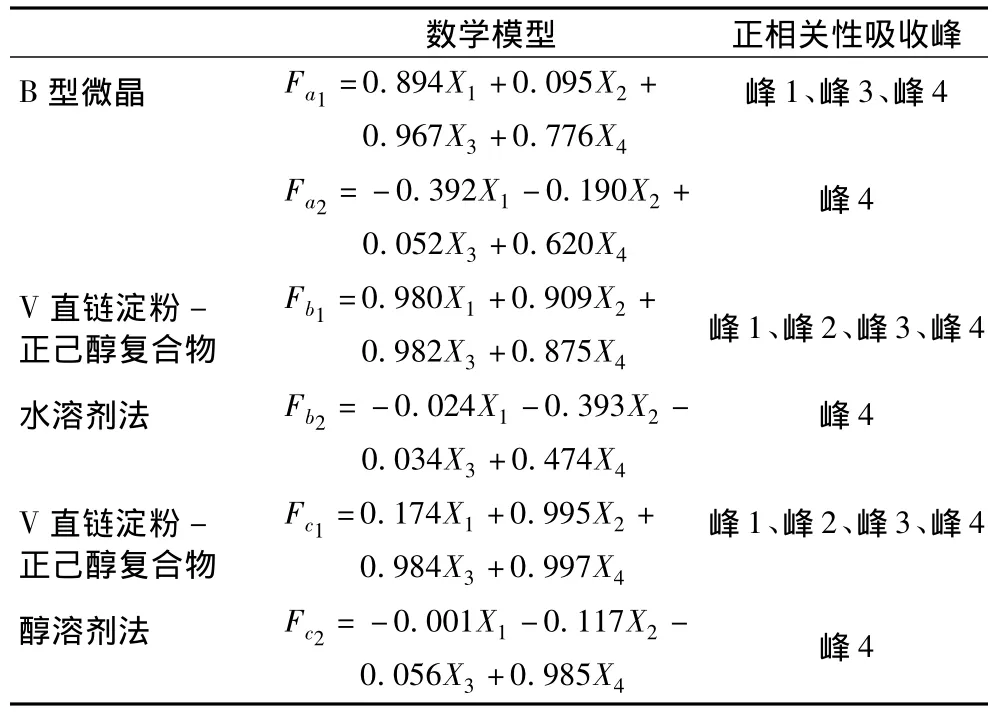
表4 红外吸收曲线特征峰与主成分因子载荷关系的数学模型
为了简化操作,利用DSP7.05多元分析中主成分分析计算得出B型微晶淀粉、V直链淀粉-正己醇复合物水化物形式和无水形式晶体的红外吸收光谱中峰4的因子得分列于表5,可以看出无水形式晶体螺旋中络合配体的量与水化物形式晶体相比有所减少。

表5 3种形式晶体的红外曲线中主成分a2、b2和c2的因子得分和配体含量
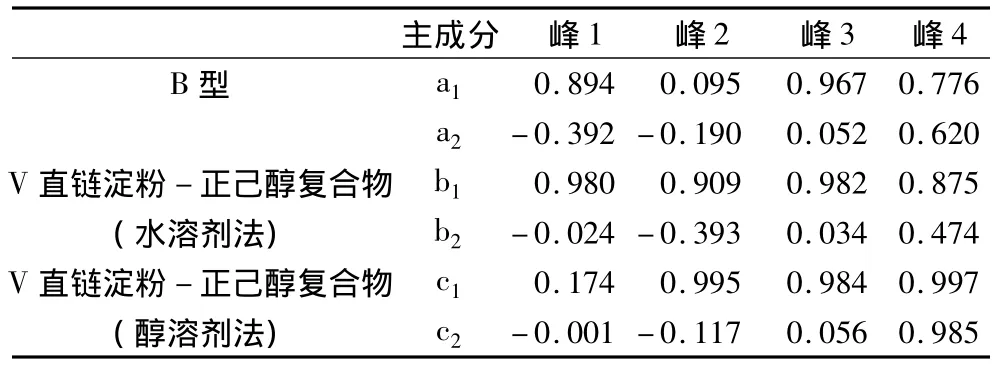
表3 三种晶体红外吸收曲线的因子载荷矩阵
由表3中各红外曲线的因子载荷矩阵,建立红外吸收曲线特征峰与主成分子因载荷关系的数学模型,结果如表4所示。
B型微晶淀粉、V直链淀粉-正己醇复合物水化物形式和无水形式晶体的红外曲线中峰4代表的是C—O伸缩振动峰(醇类的特征峰),同时根据主成分分析方法(PCA)得出的主成分a2、b2和c2均代表红外曲线中峰4。V型复合物晶体红外吸收曲线比B型微晶淀粉晶体红外曲线中超出的吸收强度即是正
3 结论
采用水及醇溶剂法均可制备得到V型直链淀粉-正己醇复合物。水化物形式晶体颗粒间粘连较严重,无水复合物的颗粒直径约为0.5~1 μm,二者的结晶度均达到70%以上。V直链淀粉-正己醇复合物的水化物与无水形式晶体的熔化温度几乎相同,且其复合物中醇类配体的含量分别为9.79%和4.3%。
[1]Putseys J A,Lamberts L,Delcour J A.Amylose - inclusion complexes:Formation,identity and physico-chemical properties[J].Journal of Cereal Science,2010,51:238 -247
[2]Fanta G F ,Shogren R L ,Salch J H.Steam jet cooking of high-amylose starch-fatty acid mixtures:An investigation of complex formation[J].Carbohydrate Polymers,1999,38:1-6
[3]Bhatnagar S,Hanna M A.Extrusion processing conditions for amylose - lipid complexing[J].Cereal Chem,1994 ,71(6):587-593
[4]Bienkiewicz G,Kolakowska A.Effects of thermal treatment on fish lipids- amylose interaction[J].Eur J Lipid Sci Technol,2004,106:376 -381
[5]Yamada T,Kato T,Tamaki S,et al.Introduction of fatty acids to starch granules by ultra - high - pressure treatment[J].Starch/Starke ,1998,50(11/12):484 -486
[6]Greta G Gelders,Jeroen P Duyck,Hans Goesaert,et al.Enzyme and acid resistance of amylose-lipid complexes differing in amylose chain length,lipid and complexation temperature[J].Carbohydrate Polymers,2005,60:379 - 389
[7]Gelders G G,Goesaert H,Delcour J A.Potato phosphorylase catalyzed synthesis of amylose - lipid complexes[J].Biomacromolecules,2005,6(5):2622 -2629
[8]Navarro A S,Martino M N,Zaritzky N E.Viscoelastic properties of frozen systems starch - triglycerides[J].Journal of Food Engineering,1997,34:411 -427
[9]刘延奇,于九皋,孙秀萍.B型淀粉球晶的制备及表征[J].精细化工,2004,21(2):137 -140
[10]Bail P Le,Bizot H,Pontoire B,et al.Polymorphic Transitions of Amylose-Ethanol Crystalline Complexe Induced by Moisture Exchanges[J].Starch/Starke,1995,47:229 -232.
Preparation and Characterization of V-type Amylose-Hexanol Complex
Liu Yanqi Xiao Xinxin Li Hong Li Xuehong Yang Liuzhi
(School of Food and Biological Engineering,Zhengzhou University of Light Industry,Zhengzhou,Henan 450002)
In this paper,B - type microcrystalline starch made a combination with hexanol in the case of water and alcohol as solvent respectively;V-type amylose-hexanol complexes were prepared.Obtained V -type amylosehexanol complexes were characterized with scanning electron microscopy,X - ray diffraction,differential scanning calorimeter,Fourier transform infrared spectrophotometer.Infrared spectrum of obtained V - type amylose - hexanol complexes were measured qualitatively to determine the certain alcohol in V-type complexes;further application of principal component analysis(PCA)for analysis of infrared absorption spectra.The results showed that using the preparation of water and alcohol solvents,obtained V -type amylose-hexanol complexes were hydrates and anhydrous crystal.Hydrate crystal's particles adhesion were serious,the particle diameter of anhydrous crystalline was 0.5 ~1 μm,and the crystallinity of both were above 70%.Hydrates and anhydrous crystal's melting temperature of V-type amylose - hexanol complexes were almost the same,obtained the ligand content of hydrates and anhydrous crystal of Vhexanol were 9.79%and 4.3%.
V -type amylose-hexanol complex,crystalline structure,preparation
TS236.9
A
1003-0174(2012)03-0024-05
国家自然科学基金项目(21076201),河南省重点科技攻关项目(102102110103)
2011-07-04
刘延奇,男,1964年出生,博士,教授,天然聚合物改性及应用

