再生丝素纤维的湿法纺丝及其交联改性研究
高艳菲,明津法,邓春闽,陈 梅,左保齐
(现代丝绸国家工程实验室,江苏 苏州 215123;苏州大学 纺织与服装工程学院,江苏 苏州 215021)
再生丝素纤维的湿法纺丝及其交联改性研究
高艳菲,明津法,邓春闽,陈 梅,左保齐
(现代丝绸国家工程实验室,江苏 苏州 215123;苏州大学 纺织与服装工程学院,江苏 苏州 215021)
以六氟异丙醇(HFIP)溶解再生丝素膜,通过湿法纺丝获得再生丝素纤维。再生丝素纤维经1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺(EDC)和N-羟基丁二酰亚胺(NHS)作为交联剂进行后处理,利用扫描电镜(SEM)、红外光谱(FTIR)、X-射线衍射(XRD)、DSC热分析法、力学性能等表征方法研究和分析了牵伸和交联前后纤维聚集态结构和力学性能的变化。研究结果表明:再生丝素纤维经牵伸和EDC/NHS交联改性后,纤维直径变细为87 μm,纤维内部结构以silk II结构为主;纤维的热稳定性提高,热分解峰峰值由281 ℃提高至288 ℃;纤维的断裂强度和断裂伸长率明显增大,分别达到1.41 cN/dtex和11.38%,表现出良好的柔韧性。
再生丝素纤维;湿法纺丝;交联改性
蚕丝纤维是一种天然蛋白纤维,由丝素蛋白和丝胶蛋白两部分组成,丝素蛋白有良好的生物相容性、生物可降解性、易加工性等,近年来桑蚕丝用于生物医学领域的研究非常活跃[1],通过人工纺丝的方法制备具有优异性能的再生丝素蛋白纤维是研究热点之一。
再生丝素蛋白纤维力学性能较差,易脆断,改善的方法之一是采用化学交联处理。在当前的实际应用中,较为常用的交联剂有甲醛、戊二醛、二醛基淀粉和环氧化合物等。这些化学合成的交联剂在处理生物组织方面各有所长,但它们的一些缺点也是有目共睹的:由于这些交联剂都是化学合成,具有很高或相对较高的细胞毒性,导致使用它们进行交联处理的生物组织植入人体以后,在一定程度上影响了受体正常组织的生长,进而影响了创口的愈合和功能的恢复[2-3]。
与一些传统的化学交联剂如戊二醛或环氧化合物不同,碳化二亚胺(EDC)不作为联结的一部分滞留在交联物分子中,而是转变为具有极低细胞毒性的水溶性脲衍生物,所以这种方法可以避免解聚作用和残留有毒物质的释放[4]。因此人们开始使用EDC和羟基琥珀酰亚胺(NHS)作为交联剂。Wissink等[5]先将I型胶原制成厚为50 μm的胶原膜,然后用吗啉-乙磺酸(MES)进行处理,再与EDC/NHS进行交联。体内试验表明,交联后的胶原膜对血液有良好的生物相容性。Damink等[6]把羊皮胶原浸入EDC/NHS的混合液后,交联率增大,收缩温度大幅度提高,胶原断裂强度降低,断裂伸长大幅增加。
本研究采用湿法纺丝法获得再生丝素纤维,通过EDC/NHS交联剂的交联改性制备出具有一定力学性能的再生丝素纤维;并以扫描电子显微镜(SEM)研究纤维的形貌特征、红外光谱(FTIR)和X-射线衍射(XRD)等表征纤维聚集态结构和力学性能的变化,为再生丝素纤维用于生物医用材料提供实验依据。
1 试 验
1.1 材 料
桑蚕丝(浙江湖州浙丝二厂),碳酸钠(AR,上海试剂总厂),溴化锂(AR,Sigma公司),无水乙醇(AR,上海化学试剂二厂),六氟异丙醇(HFIP)(Technical grade,美国杜邦公司),1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺(EDC)(BR,Sigma公司),N-羟基丁二酰亚胺(NHS)(BR,Sigma公司)。
1.2 方 法
1.2.1 再生桑蚕丝素膜的制备
称取一定量桑蚕丝,用0.05 %的Na2CO3溶液煮沸脱胶,浴比1︰20,煮3次,每次30 min煮沸后获得纯桑蚕丝素,在60 ℃下烘干,备用。
配置LiBr/C2H5OH/H2O(质量比44︰45︰11)混合溶液,将纯桑蚕丝素溶于混合溶液中,在75~80 ℃的恒温水浴条件下搅拌5 h左右,获得再生桑蚕丝素溶液,经去离子水透析后,在室温条件下成膜。
1.2.2 纺丝液的配置及纺丝
将丝素膜与HFIP按一定比例混合,得到质量分数为15 %和18 %的混合液,在通风橱中将混合液用密封袋密封,置于震荡水浴槽中于25 ℃条件下震荡7 d左右,得到纺丝液。
将纺丝液倒入挤出头进行挤出,在乙醇凝固浴中凝固,牵引、卷曲,得到初生纤维。将初生丝素纤维浸泡在无水乙醇中,密封,置于室温下24 h,将初生纤维牵伸一倍,接着在120 ℃下热定形30 min。
1.2.3 交联再生丝素纤维
室温下,将EDC/NHS(质量比为2︰1)按一定比例加入到乙醇/水(VC2H5OH/VH2O=90︰10)中,配制成质量分数为4.5 %的交联液。将牵伸后的丝素纤维浸泡于交联液中,室温下放置24 h,得到交联后的纤维,然后置于120 ℃下热定形30 min,得到EDC/NHS交联后的再生丝素纤维。
1.3 主要测试方法
1.3.1 扫描电镜
将初生丝素纤维、牵伸后丝素纤维及交联改性丝素纤维经喷金处理,用S4800扫描电镜(日本日立公司)观察纤维的横纵截面形态。此外,采用Image J软件测量纤维直径,每个样品测量100次,求其平均值。
1.3.2 红外光谱测试
将初生丝素纤维、牵伸后丝素纤维及交联改性丝素纤维剪碎制成粉末,KBr压片制样,用美国Nicolet 5700型红外光谱仪进行测试,得到纤维的红外吸收光谱,分析丝素二级结构的变化。
1.3.3 X衍射分析
利用全自动X射线衍射仪分析初生丝素纤维、牵伸后丝素纤维及交联改性丝素纤维中丝素结晶结构的变化。测试参数:CuK α射线,管电压40 kV,管电流40 mA,扫描速度2(°)/min,衍射角度2θ为5°~45°。
1.3.4 DSC测试
将初生丝素纤维、牵伸后丝素纤维及交联改性丝素纤维剪碎制成粉末,用SDT Q600热分析仪测定样品的热性能变化。测试时,氮气氛,氮气流量100.0 mL/min,温度范围50~600 ℃,升温速率10 ℃/min。1.3.5 力学性能测试
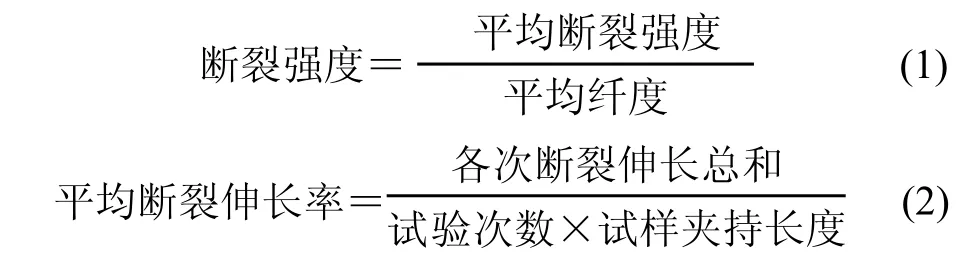
将再生丝素纤维样品在标准大气条件(温度20 ℃,相对湿度65 %)下平衡24 h,然后利用Instron 3365型万能材料试验仪测试交联前后丝素纤维的断裂强力等力学性能指标。测试时,试样夹持长度100 mm,拉伸速度10 mm/min,预张力(0.1±0.01) cN/dtex,每个样品测试10次,取其平均值,计算样品的断裂强度、断裂伸长率:
2 结果与讨论
2.1 再生丝素纤维的SEM分析
图1为丝素溶液质量分数为15 %和18 %条件下湿法纺丝获得的再生丝素纤维的外观形貌图。从图1可知,在质量分数为15 %和18 %的条件下获得的初生纤维表面光滑,纤维直径分别为(192±15)μm、(192±25)μm(图1a,d),可见在本试验条件下纺丝液浓度不会对再生丝素纤维的外观结构产生明显影响。当初生纤维经1倍牵伸,未经EDC/NHS交联剂交联改性时,纤维直径明显变细,分别从(192±15)μm、(192±25)μm下降到(81±15)μm、(81±9)μm(图1b,e)。而牵伸纤维经EDC/NHS交联改性后,可能由于交联过程中纤维发生溶胀,纤维直径则分别从(81±15)μm、(81±9)μm增加到87±5 μm、(87±12)μm(图1c,f )。
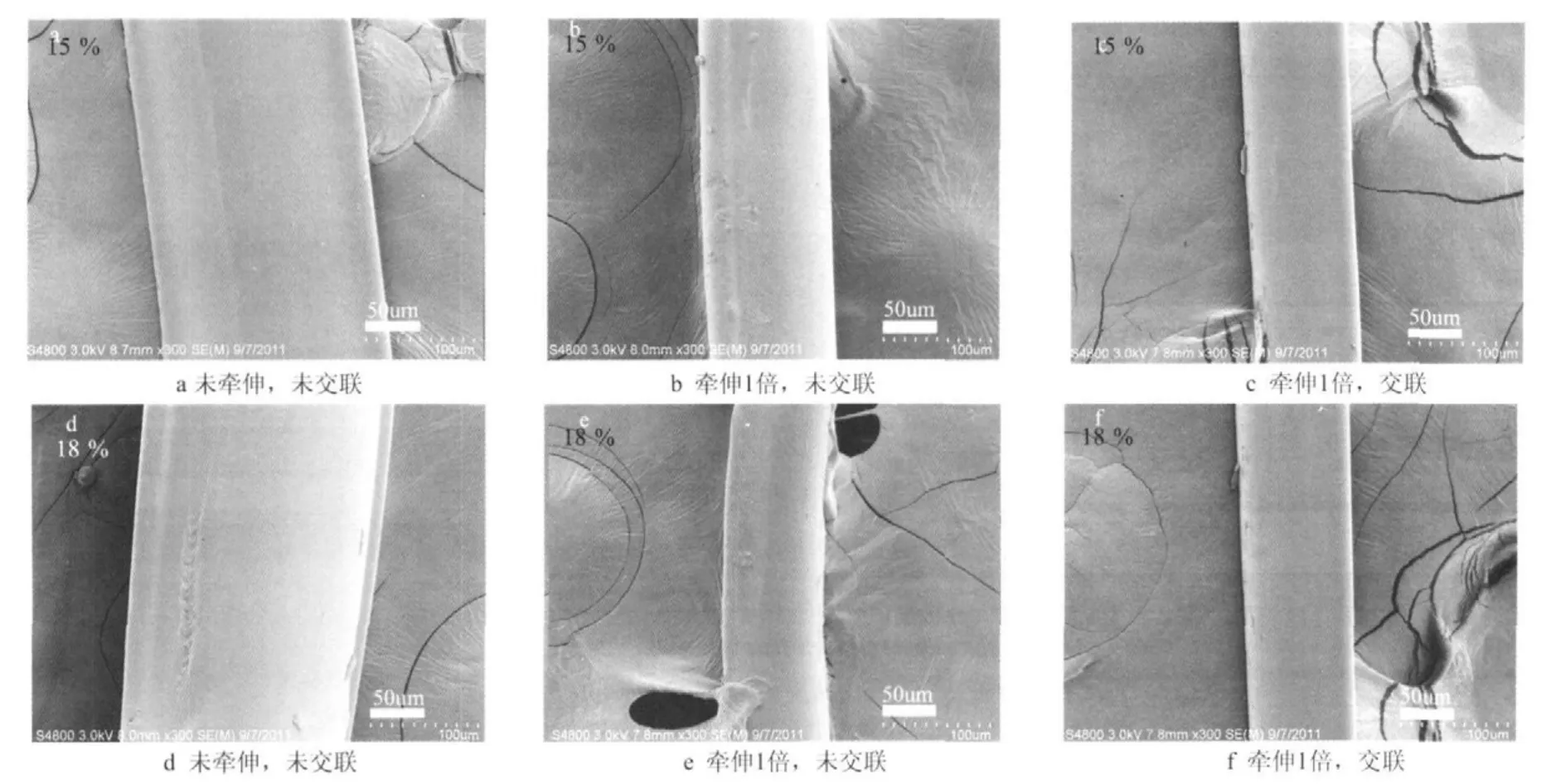
图1 再生丝素纤维的外观形貌Fig.1 The morphology structure of regenerated silk fi broin fi bers
2.2 再生丝素纤维的FTIR分析
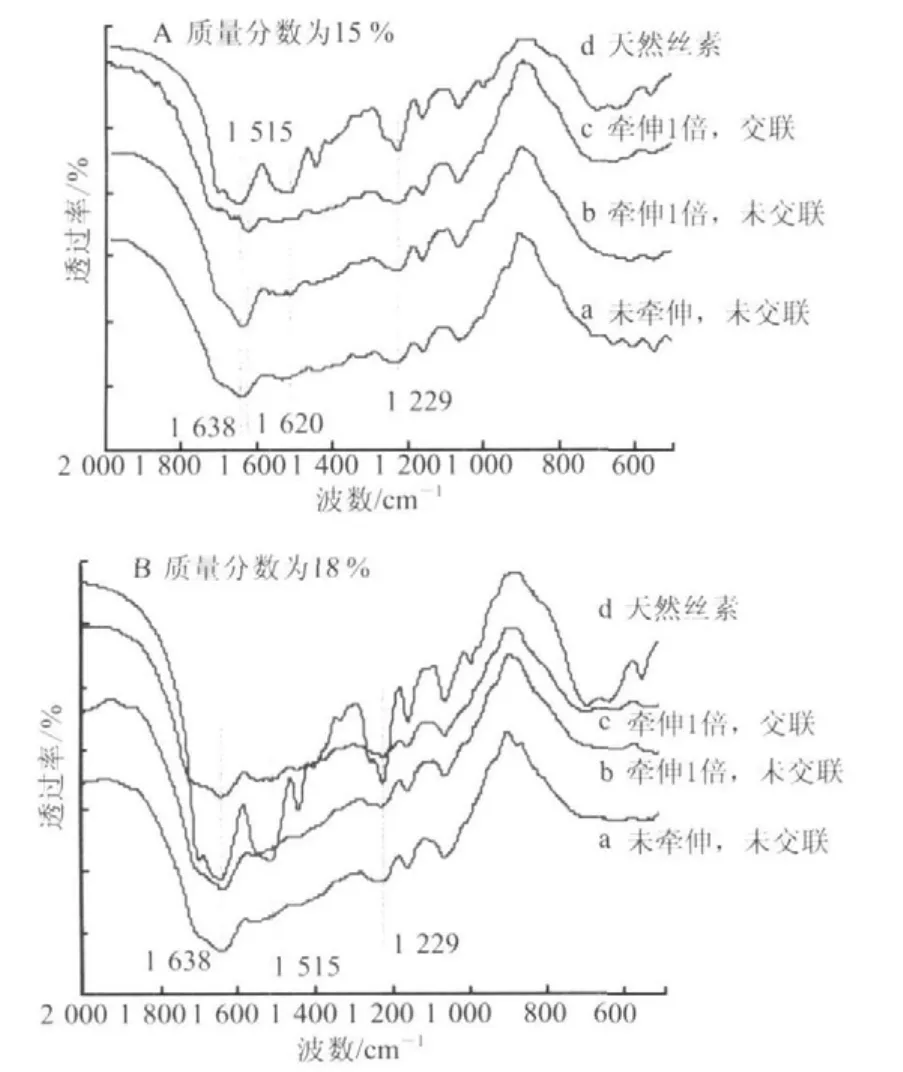
图2 丝素蛋白纤维的FTIR图Fig.2 FTIR spectra of silk fi broin fi bers
图2为不同质量分数条件下湿法纺丝制得的再生丝素纤维的FTIR图。从图2可以看出,天然丝素蛋白的酰胺I、酰胺II和酰胺III在1 638 cm-1、1515 cm-1、1 229 cm-1,分别属于silk II构象、silk II 构象和无规线团/silk I,可见天然丝素蛋白主要以silk II 为主,并含有部分无规线团或silk I 构象。从图2A可知,由质量分数为15 %的纺丝液湿法纺丝获得的初生丝素纤维的酰胺I位于1 638 cm-1,属silk II 构象。初生丝素纤维经1倍牵伸,EDC/NHS交联改性后,酰胺I红外光谱特征峰从1 638 cm-1偏移至1 620 cm-1,其他红外特征峰未发生变化,但初生纤维经牵伸和交联改性后,纤维内部构象未发生变化,为silk II 构象。而由质量分数为18 %的纺丝液湿法纺丝获得的初生纤维的酰胺I位于1 638 cm-1,属silk II 构象(图2B)。初生纤维经牵伸和EDC/NHS交联改性后,丝素蛋白特定构象的酰胺I、酰胺II等红外光谱特征峰未发生明显变化,表明纤维内部构象未受到牵伸和交联剂交联改性的影响。此外,由图2A和B对比可知,不同质量分数的纺丝液湿法纺丝获得的初生纤维内部构象受丝素蛋白纺丝液质量分数的影响较小。
2.3 再生丝素纤维的XRD表征
图3为丝素纺丝液质量分数分别为15 %和18 %条件下,湿法纺丝制得的再生丝素纤维的XRD图。一般认为丝素的二级结构分为:无规线团、silk I 和silk II结构。其中silk I的主要衍射峰为12.2°、19.7°、24.7°和28.2°,而silk II的主要衍射峰为9.1°、18.9°、20.7°和24.0°。
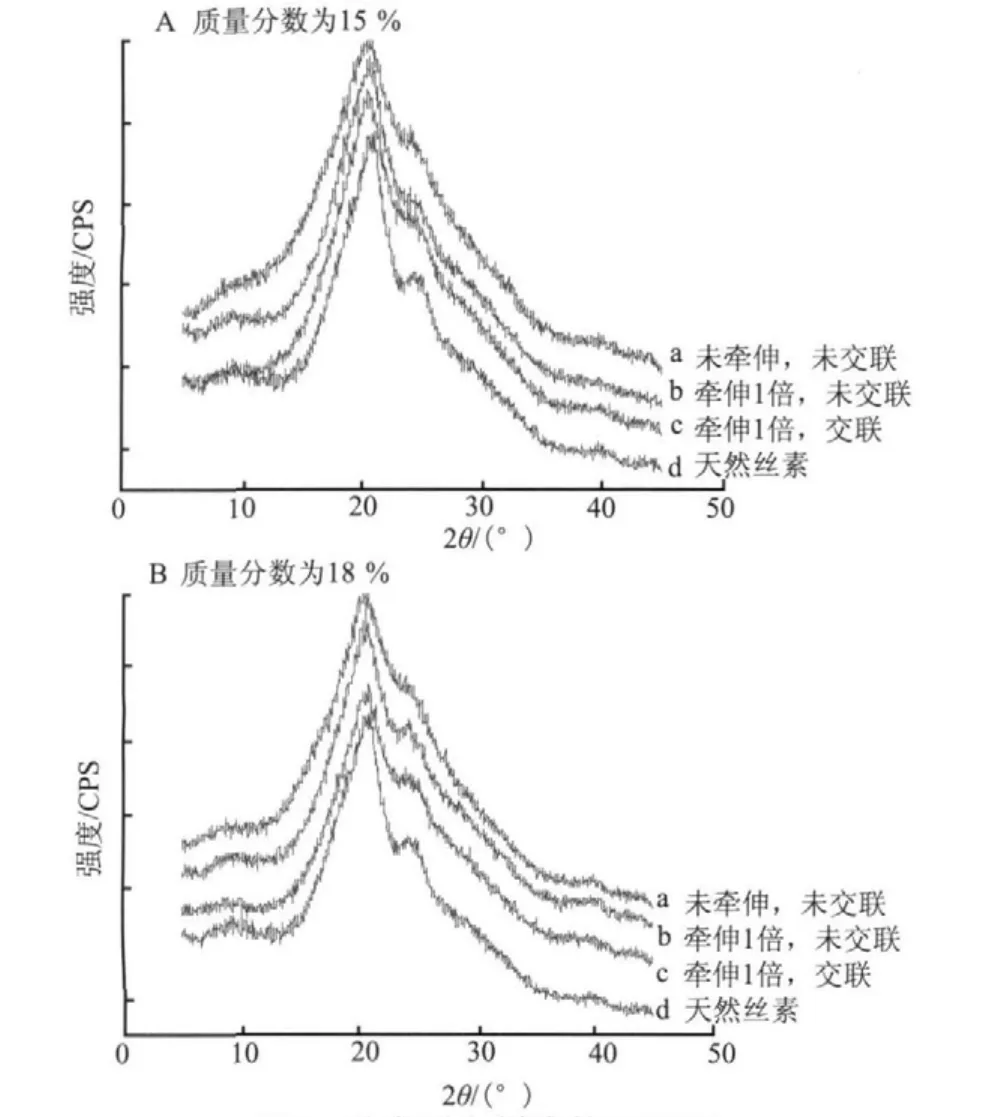
图3 丝素蛋白纤维的XRD图Fig.3 XRD spectra of silk fi broin fi bers
由图3中曲线d可知,天然丝素20.7°和24.0°处有明显的X衍射峰,且均属于silk II结构。由图3A中曲线a可知,丝素纺丝液质量分数为15 %条件下湿法纺丝获得的初生纤维的主要衍射峰位于20.3°,属silk II结构[7]。初生纤维经1倍牵伸和EDC/NHS交联剂交联改性后,20.3°处的衍射峰强度增强,且在23.2°处出现一小肩峰。由此可见,经牵伸和交联改性后,丝素的二级结构以silk II为主,含部分无规结构。而在纺丝液质量分数为18 %的条件下湿法纺丝获得的初生纤维的XRD图(图3B-a)与质量分数为15 %纺丝液条件下获得的初生纤维的结构相同。可见,纺丝液质量分数对湿法纺丝获得的再生丝素纤维内部结构影响较小。
2.4 再生丝素纤维的DSC分析
图4为丝素纺丝液质量分数分别为15 %和18 %条件下,湿法纺丝制得的再生丝素纤维的DSC曲线。由图4中曲线d可知,天然丝素在90 ℃左右有一微小的吸热峰,这主要归因于丝素内部结构吸附水的释放。同时,天然丝素的热分解峰在315 ℃,这是由丝素内部silk II结构含量决定的。
从图4A中曲线a可知,初生纤维在87 ℃附近有一明显的吸热峰,且其热分解峰在281 ℃。初生纤维经牵伸和EDC/NHS交联改性后,热分解峰峰值由281 ℃偏移至288 ℃,这主要是由于初生纤维经牵伸和交联改性后,丝素纤维内部无规线团/silk I结构向silk II结构转变的结果造成的。同时丝素内部silk II结构含量的增加已经由FTIR和XRD证实。此外,质量分数为15 %和18 %条件下获得的再生丝素纤维的DSC曲线的变化趋势一致。主要是由在纺丝液质量分数为18 %的条件下获得的再生丝素纤维的结构与15 %质量分数条件下获得的纤维的结构相近(FTIR和XRD证实)造成的。
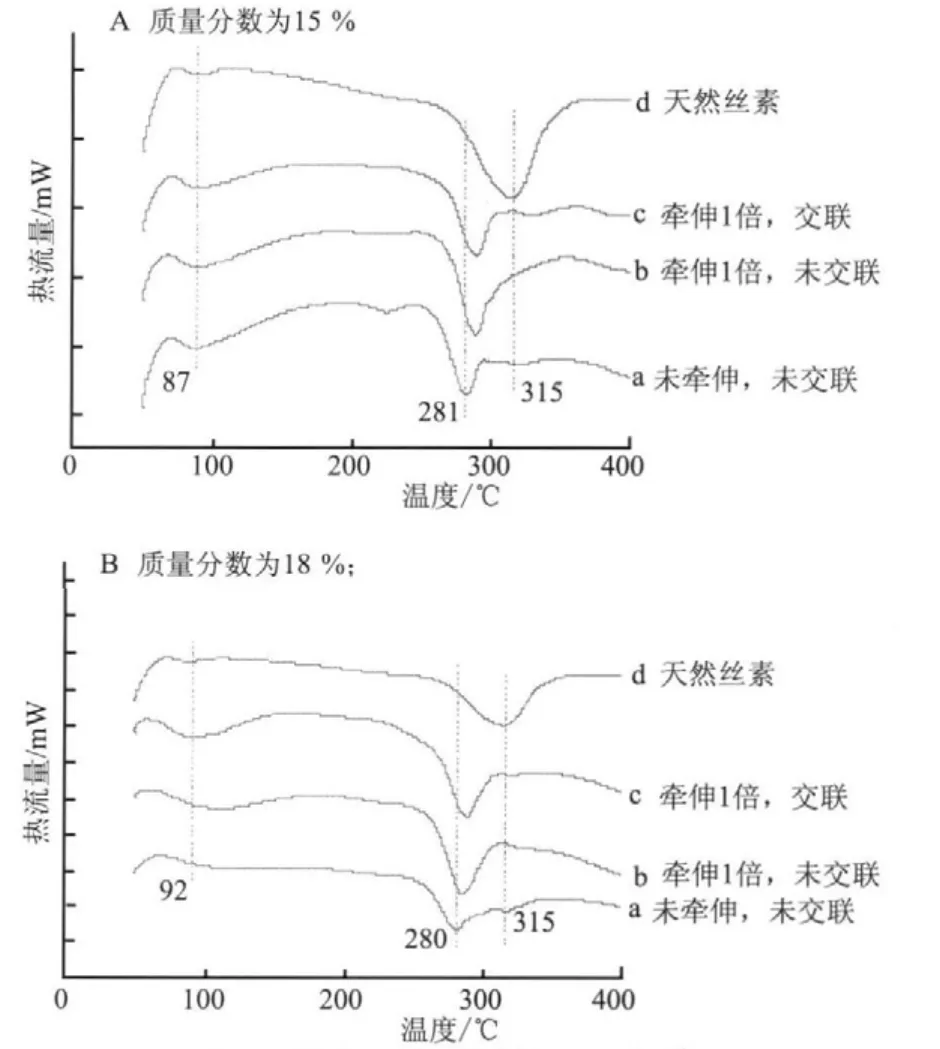
图4 丝素蛋白纤维的DSC曲线Fig.4 DSC curves of silk fi broin fi bers
2.5 力学性能表征
表1为丝素纺丝液质量分数为15 %和18 %的条件下湿法纺丝获得的再生丝素纤维与天然丝素纤维的力学性能对比。从表1中可知,天然丝素的断裂强度为2.56 cN/dtex,断裂伸长率为10.47 %,表现出良好的强度和柔韧性。

表1 丝素纤维的力学性能Tab.1 The mechanical properties of silk fi broin fi bers
在纺丝液质量分数为15 %的条件下,获得的初生纤维的断裂强度仅为0.52 cN/dtex,断裂伸长率为4.95 %,这主要是初生纤维内部结构以无规线团/silk I为主。初生纤维经牵伸和EDC/NHS交联改性后,断裂强度和断裂伸长率明显增大,分别为1.41 cN/dtex和11.38 %。可见,初生纤维经牵伸和交联改性后,丝素内部结构转变为以silk II结构为主,加之交联剂的交联作用(图5),交联后丝素纤维的断裂伸长率明显增加,且与天然丝素的断裂伸长率相当。可见,再生丝素纤维经EDC/NHS交联改性后,可明显提高其力学性能,增强其生物医药性能。
此外,由于丝素溶液质量分数为15 %和18 %的条件下获得的再生丝素纤维内部结构相近(经FTIR和XRD证实),从表1中可见,2种质量分数条件下获得的再生丝素纤维的力学性能相当。
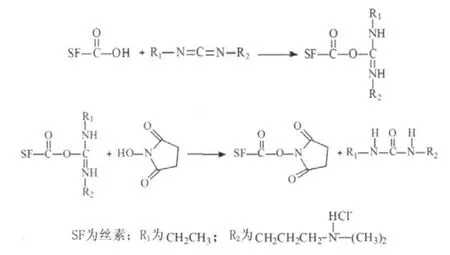
图5 丝素与EDC/NHS交联剂的交联机理Fig.5 The crosslinked mechanism of silk fi broin and EDC/NHS
3 结 论
1)采用湿法纺丝技术成功制备了再生丝素纤维,利用SEM观察纤维微观形貌可知,初生纤维的直径约为192 μm,且纤维表面光滑。经1倍牵伸,纤维直径明显变细,直径下降到81 μm。而EDC/NHS交联改性后,纤维发生溶胀,直径增加到87 μm。
2)由XRD、FTIR及DSC测试结果可知,初生纤维内部结构以silk II结构为主,经牵伸和交联改性后,纤维内部构象无明显变化,为Silk II构象,且纤维的热分解峰峰值增加。
3)力学性能结果表明,纤维经EDC/NHS交联改性后,其断裂伸长率明显增加,纤维表现出良好的柔韧性,有望用于生物医用修复材料。
[1] 姚穆,周锦芳,黄淑珍,等. 纺织材料学[M]. 北京:中国纺织出版社,1980.
[2] SPEER D P, CHVAPIL M, ESKELSON C D, et al. Biological effects of residual glutaraldehyde in glutaraldehydetanned collagen biomaterials[J]. J Biomed Mater Res, 1980, 14(4):753-764.
[3] NISHI C, NAKAJIMA N, IKADA Y. In vitro evaluation of cytotoxicity of diepoxy compounds used for biomaterial modi fi cation[J]. J Biomed Mater Res, 1995, 29(2): 829-834.
[4] 张雪燕,顾其胜. 透明质酸与胶原蛋自复合材料的制备及其应用[J]. 上海生物医学工程杂志,2003, 24 (1): 26-28.
[5] WISSINK M J B, BEERNINK R, PIEPER J S, et al. Immobilization of heparin to EDC/NHS crosslinked collagen. Characterization and in vitro evaluation[J]. Biomaterials, 2001,22(2): 151-163.
[6] OIDE DAMINK L H H, DIJKSTRA P J, VAN LUYN M J A, et al. Cross-linking of dermal sheep collagen using a water-soluble carbodiimide[J].Biomaterials, 1996, 17(8): 765-773.
[7] JIN H J, PARK J, KARAGEORGIOU V, et al. Water stable silk films with reduced beta sheet content[J]. Adv Funct Mater, 2005, 15(8): 1241-1247.
Wet spinning of the regenerated silk fibroin fibers and its cross-linking modification research
GAO Yan-fei, MING Jin-fa, DENG Chun-min, CHEN Mei, ZUO Bao-qi
(National Engineering Laboratory for Modern Silk, Suzhou 215123, China; College of Textile and Clothing Engineering, Soochow University,Suzhou 215021, China)
Regenerated silk fibroin fibers were prepared by the wet-spinning method with Hexafluoroisopropanol(HFIP) as the solvent. Then, the regenerated silk fibroin fibers were processed by 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide(EDC) and N-Hydroxy succinimide(NHS) as the cross-linking agents. The fiber aggregative state structure and the changes of the mechanical properties before and after drafting and cross-linking were studied by scanning electron microscopy (SEM), X-ray diffraction (XRD), FTIR, DSC, the mechanical property and other indicative methods. The results showed that after drafting and EDC/NHS cross-linking, the average diameter of the regenerated silk fibroin fibers became fine and its average value equaled 87μm. The crystal structure was mainly in silk II structure. The thermal stability of the fiber was improved, and the thermal decomposition peaks shifted from 281 ℃ to 288 ℃. In addition, the mechanical properties of the fibers obviously increased. Its tensile strength and elongation at break reached 1.41 cN/dtex and 11.38%, respectively,exhibiting good flexibility.
Silk fibroin; Wet spinning; Crosslinked modification
TS102.33;TQ340.142
A
1001-7003(2012)04-0010-05
2011-10-26 ;
2011-11-15
高艳菲(1988- ),女,硕士研究生,研究方向为丝素蛋白生物医用。 通讯作者:左保齐,教授,bqzuo@suda.edu.cn。

