模拟胃环境中丝素蛋白复合材料的溶蚀机制
陈忠敏,张艳冬,罗 琴,胡仁建
(重庆理工大学 药学与生物工程学院,重庆 400054)
模拟胃环境中丝素蛋白复合材料的溶蚀机制
陈忠敏,张艳冬,罗 琴,胡仁建
(重庆理工大学 药学与生物工程学院,重庆 400054)
以聚乙二醇为增塑剂,通过水相共混法制备了不同比例的丝素蛋白/聚乙烯醇/聚乙二醇复合材料。利用红外光谱对复合材料进行了结构表征,并通过失重试验、红外光谱(FTIR)、X-射线衍射(XRD)、扫描电镜(SEM)对复合材料在模拟胃环境中的溶蚀机制进行了研究。结果表明,丝素蛋白/聚乙烯醇/聚乙二醇复合材料的溶蚀降解首先从丝素蛋白的溶出、分解,并形成细微孔道开始,然后胃液通过细微孔道逐步深入并溶蚀聚乙二醇和聚乙烯醇。该丝素蛋白/聚乙烯醇/聚乙二醇复合材料具有潜在的药物缓释应用前景。
丝素蛋白;聚乙烯醇;聚乙二醇;药物缓释材料;溶蚀机制
药物缓释给药与传统给药相比,可以减少给药次数、维持血液中药物的浓度,以解决药物浓度不稳定的问题,提高药物疗效,降低药物毒副作用,减轻病人多次用药的痛苦,提高病人的用药依从性,对于提高临床用药水平具有重大意义,成为近年来国内外新药物制剂领域的研发热点之一[1]。药物缓释系统中的药物载体通常有两类,即合成高分子载体和天然高分子载体。合成高分子载体存在着生物相容性差、不易降解的缺点,其应用范围受限。天然高分子载体因具有优良的生物降解溶蚀性、生物相容性等而成为药物缓释载体研究领域的热点之一。
再生蚕丝素蛋白(SF)是一种纤维状蛋白质材料,对人体无毒副作用、免疫原性,具有良好的生物相容性和生物降解性[2],可加工成各种形状,具有成为理想的药用缓释载体材料的应用潜力。研究发现,SF在一般水中几乎无溶解性,但在存在着各种活性蛋白酶的胃液等中时却能快速溶解并水解,存在着降解性能和速率、降解产物不可控的缺点。国内外研究中有筛选合适的固化工艺来提高丝素的结晶区比例法,以及通过复合材料性能互补的原理,将丝素与其他高分子接枝或混合法来改造其溶蚀降解性能。其中,分别利用聚乙烯醇(PVA)、聚乙二醇(PEG)对丝素蛋白修饰改造的研究有不少报道[3-7]。PVA具有无毒、亲水性高、成膜性好、生物相容性好及力学性能良好等特性,且可生物降解。PEG具有中性、无毒、良好的生物相容性和血液相容性,且是迄今为止已知的蛋白质聚合物中蛋白和细胞吸收水平最低的聚合物。但这些化合物的修饰也只是让丝素蛋白减缓了溶蚀降解的速度,却不能达到逐步递次溶蚀降解从而缓释药物的目的。在对SF、PVA、PEG结构进行研究的基础上,本研究选用SF与PVA、PEG依次共混制备法,制备出了不同配比的SF/PVA/PEG复合材料,重点考察了材料在模拟胃液中的溶蚀现象、溶蚀过程变化,从而为缓释药物提供条件。
1 试 验
1.1 材 料
废弃茧壳(西南大学生物技术学院);碳酸钠、乙醚、无水氯化钙、乙醇(市售,分析纯);聚乙烯醇1799、聚乙二醇400(进口分装);胃蛋白酶(Sigma公司分装);中性蛋白酶(国药集团南宁化学试剂有限公司);透析袋(进口分装),标定截留相对分子质量为14 000,使用前按使用说明在2 %碳酸氢钠和l mmol/L EDTA(pH8.0)中煮沸10 min,并用蒸馏水洗净。
1.2 SF粉末的制备
将茧壳用乙醚浸泡48 h除去蜡质,用蒸馏水洗净,干燥后用无水乙醇在室温下浸泡24 h除去部分有机物和杂质,洗净、干燥。用0.5 %的Na2CO3将干净茧壳煮沸30 min,3次,用蒸馏水洗涤干燥得到纤维状丝素蛋白。用苦味酸胭脂红溶液检验丝胶脱除情况。
将丝素纤维溶解在CaC12/C2H5OH/H2O(摩尔比1︰2︰8)的有机无机混合溶剂中,将溶解液装入标定截留相对分子质量为14 000的透析袋内透析3 d,取出,使用中性蛋白酶进行酶解,酶解条件为:pH6.0~7.0,温度50~55 ℃。酶解完成后放入-40 ℃超低温5~10 min使酶失活。用超滤膜过滤并用双蒸水多次冲洗后,以冷冻干燥法得到SF粉末。
1.3 SF/PVA/PEG复合材料的制备
称取PVA 2 g,在95 ℃水浴加热至完全溶解,按照文献[8]中得到的SF/PVA最佳配比(质量比30/70)加入SF粉末,搅拌20 min。取混合溶液按照(SF+PVA)/PEG质量比分别为90︰10、80︰20、70︰30加入PEG,继续搅拌5 h,浓缩使其总质量分数达到约10 %,得到SF/PVA/PEG共混液。
取5 mL共混液放入自制成膜装置中,室温放置6 h后再放入烘箱,在50 ℃条件下干燥4 h,之后再放置在室温条件下平衡10 h,得到膜片状材料样品。将制得的样品放入干净样品袋密封保存、待用。
1.4 SF/PVA/PEG材料溶蚀试验
将上述制备的不同配比的SF/PVA/PEG材料裁剪成长×宽×厚=10 mm×10 mm×30 μm的薄片,干燥12 h后取出称重w,再将膜片放入温度恒定在(37±1)℃、200 mL的模拟胃液中[模拟胃液按照2010药典(附录)配制],20 r/min下搅拌。分别在1、2、3、4 h取出膜片,冲洗干净后干燥称重为w1。根据下式计算失重率:

同时分别将在人工胃液中溶蚀了1、2、3、4 h的各薄膜片样品取出进行仪器表征。
1.5 表 征
分析天平(SL202N上海明桥精密科学仪器有限公司)用于失重分析测试。傅立叶变换红外光谱仪(Perkin Elmer Sectrum 100)用于复合材料结构表征及对在人工胃液中溶蚀前后取出的膜材料结构构象变化进行表征,采用KBr压片法进行。扫描电子显微镜(LEO-supra35 德国ZEISS公司生产)用于在人工胃液中溶蚀前后取出的膜材料进行表面结构观察。X-射线衍射(D/max 2500X射线衍射仪,日本理学公司)用于在人工胃液中溶蚀前后取出的膜材料进行结晶变化考察。
2 结果与讨论
2.1 SF/PVA/PEG复合材料红外表征
图1所示为SF、PVA、SF/PVA及SF/PVA/PEG材料的红外光谱特征峰值。从图1可以看出,SF/PVA 材料中出现了2种高分子的特征吸收峰,为3 264 cm-1(ν,O-H,吸收峰宽而钝),1 662 cm-1(νC=O,酰胺Ⅰ),1 538 cm-1(δN-H,酰胺Ⅱ),1 406 cm-1(δC-H2)等,说明两者已混合。而在添加了PEG成为SF/PVA/PEG材料后,除了属于(ν, C-H)的吸收峰2 917 cm-1往低波数方向移动以外,其余各吸收峰与SF/PVA材料吸收峰相比较,均向高波数方向发生了移动。红外光谱图确认了SF/PVA/PEG复合材料,同时显示了SF和PVA的结合可能是通过基团分子间作用力,如氢键等的相互作用而结合,SF的分子构象发生了变化,在添加了较为微量的PEG后,材料中SF的分子构象进一步发生了改变,其羟基的吸收峰幅变宽。

图1 SF/PVA/PEG不同比例复合材料红外光谱Fig.1 FTIR spectra of composite materials consisting of different ratios of SF, PVA and PEG
2.2 模拟胃液中的溶蚀研究
2.2.1 溶蚀失重试验结果
SF/PVA/PEG材料是以其作为缓控释药用载体材料应用目标而设计的,所以对该材料进行了体外溶蚀性能测试,测试采用了模拟胃液。图2为SF/PVA/PEG复合材料在模拟胃液中的溶蚀失重曲线。试验中纯SF不能成膜,其粉末状物质在放入人工胃液后大约2 min就完全溶解,确认了SF在有蛋白酶存在的胃液环境中的快速溶解性。图2显示了纯PVA膜、SF/PVA和不同配比的SF/PVA/PEG膜材料随时间溶蚀的失重曲线。
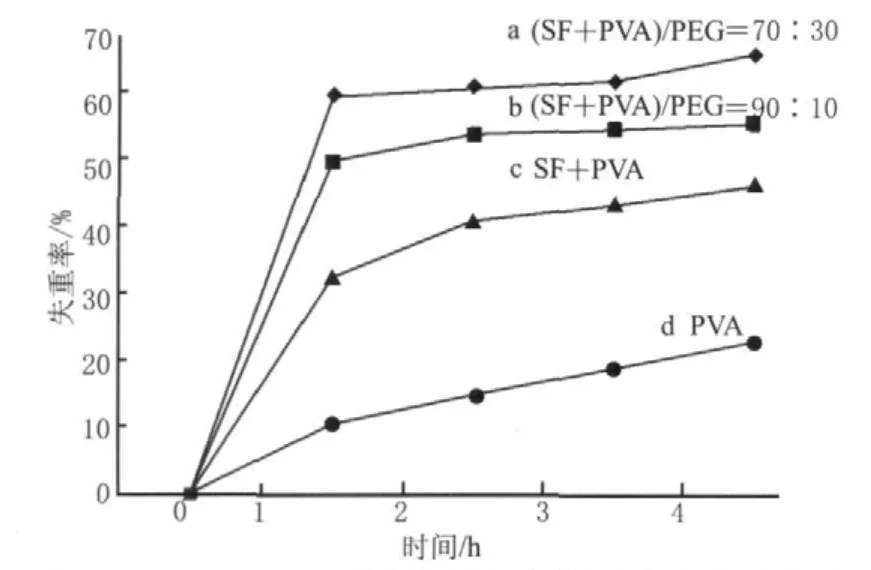
图2 SF/PVA/PEG不同比例复合材料溶蚀失重曲线Fig.2 Weight loss curves of composite materials consisting of different ratios of SF, PVA and PEG
由图2可知,各种材料在1 h内发生了较大幅度的溶蚀,到4 h时失重的增幅不大,这可能是其中的PVA和PEG具有较大的溶蚀抵抗所致。图2d显示纯PVA膜在模拟胃液中的溶蚀4 h失重率为22.7 %,但SF/PVA(30︰70)复合材料4 h失重率增大到了46.2 %(图2c),由于SF的添加量占30 %,如果30 %的SF完全溶失,PVA部分的失重也仅为16.2 %,这可能是由于SF和PVA之间是通过氢键而结合,使得PVA的一些亲水性基团被卷入分子线团内部,减少了和人工胃液中的强酸性液体及蛋白酶接触所致。在SF/PVA比例仍为30︰70,再加入10 %的PEG,即(SF+PVA)/PEG配比为90︰10的复合材料中,4 h失重率为55.2 %(图2b);(SF+PVA)/PEG配比为70︰30的复合材料4 h失重率达到了65.5 %(图2a),说明在加入PEG后,PEG介入了SF与PVA间的结合中,PEG自身带有很多羟基,使整个复合材料的羟基数量增大较多,在一定程度上提高了复合材料与胃液的接触,增大了溶蚀速度。PEG含量越高则材料的溶蚀速度越快。这与红外光谱结果一致,说明通过调节SF、PEG在整个复合材料系统中的含量,可以调节材料的溶蚀释药性。
2.2.2 溶蚀机理研究
考察SF/PVA/PEG复合材料溶蚀前后材料表面、基团构象、结晶性等的变化,对该复合材料在模拟胃液中的溶蚀机理进行了研究。
图3所示(SF+PVA)/PEG各组分比例为90︰10(其中SF/PVA为30︰70)的共混材料的人工胃液溶蚀前后的SEM图片。图3a为溶蚀前形貌,可见表面光滑的膜片上均匀镶嵌着很多颗粒或线段,认为是SF片段;溶蚀1 h后,片段的数量有了明显减少(图3b);溶蚀4 h后,SF片段基本消失,膜片呈现出平整光滑状态,膜片变薄(图3c)。这可能是SF/PVA/PEG复合材料的溶蚀首先通过SF片段的溶出、分解而进行的。对照失重曲线结论,4 h后PVA和PEG也应有部分溶蚀,即表面溶蚀导致了膜片变得薄且光滑。
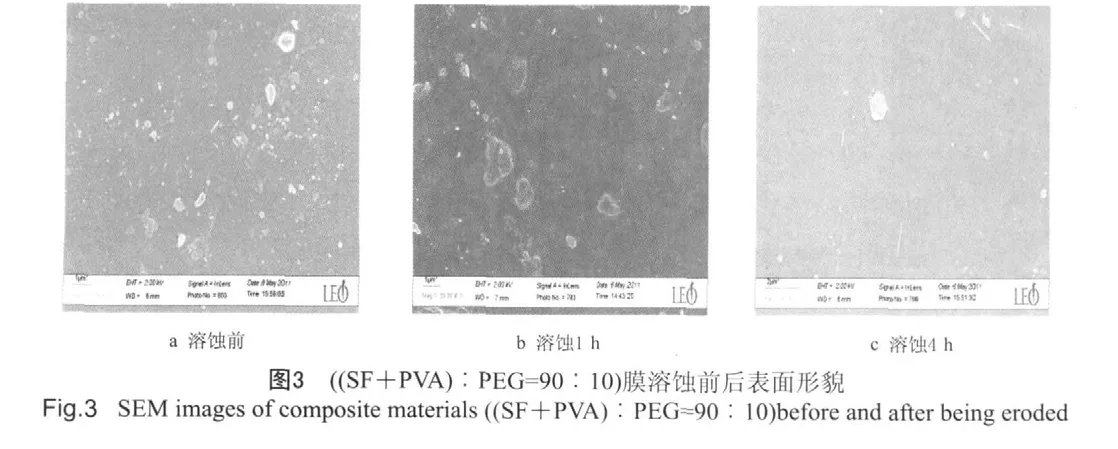
图4所示为(SF+PVA)/PEG配比为90︰10的膜材料溶蚀前后红外光谱图。图4a中观察到1 651 cm-1(νC=O,酰胺Ⅰ),1 543 cm-1(δN-H,酰胺Ⅱ), 1 243 cm-1(δ, 酰胺Ⅲ)处SF的特征吸收峰和3 279cm-1(ν,O-H),2 917 cm-1(ν,C-H),1 419 cm-1(δC-H2),1 142 cm-1(δC-H)处PVA、PEG的特征吸收峰。图4b中SF的特征吸收峰1 651 cm-1(νC=O,酰胺Ⅰ),1 543 cm-1(δN-H,酰胺Ⅱ),1 238 cm-1(δ,酰胺Ⅲ)较a减弱,而PVA、PEG的特征吸收峰变化不明显,图4c、d、e中SF的特征吸收峰逐渐减弱,而属于PVA、PEG的特征吸收峰中位于3 500~3 200 cm-1处的-OH吸收峰略有变宽,可能是分子间结合所致。这表明复合材料是通过SF首先溶出溶蚀,然后PVA、PEG间相互有分子间结合,与此同时还在逐步缓慢溶出。这和SEM观察结果一致。
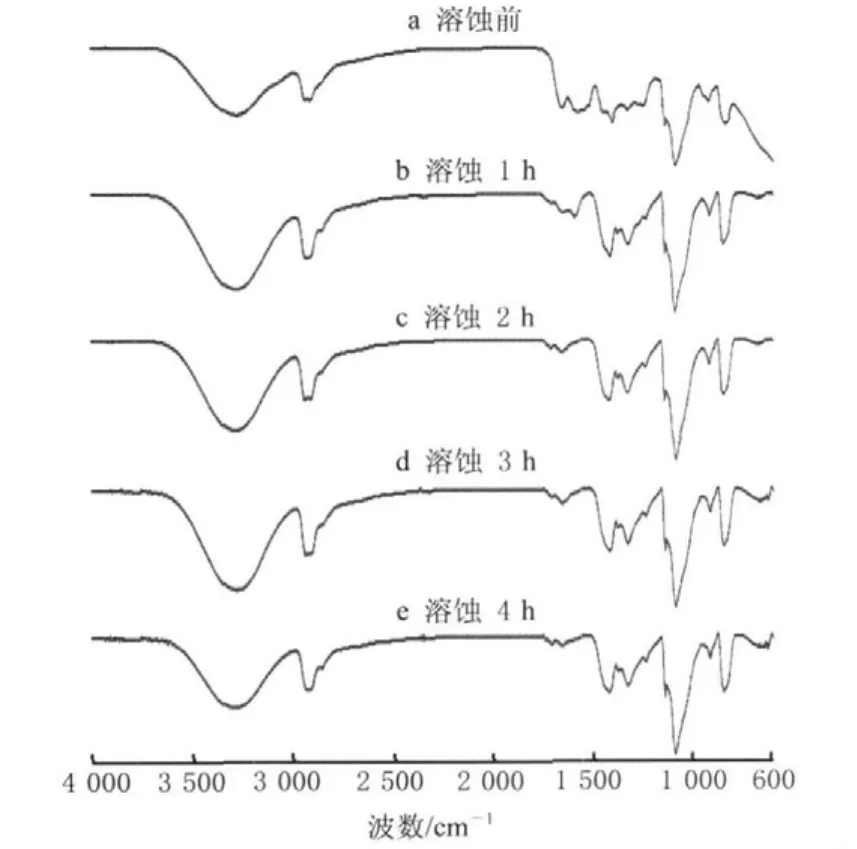
图4 ((SF+PVA)︰PEG=90︰10)膜溶蚀前后红外光谱图Fig.4 FTIR spectra of composite materials ((SF+PVA)︰PEG=90︰10)before and after being erode
图5所示为(SF+PVA)/PEG(90︰10)膜材料溶蚀前后X-射线衍射图谱。从图5可以看出,未溶蚀的SF/PVA/PEG复合材料是一个SF和PVA重叠的宽衍射峰,溶蚀后的复合材料的衍射峰逐渐尖锐化,到溶蚀4 h后衍射峰更加尖锐、清楚。这可能是复合材料的非晶区在溶蚀过程中首先被降解,使得溶蚀后的材料晶区比例增加,推测膜材料成分中首先被溶蚀的是SF和PVA的非晶区域。随着溶蚀的进行,材料呈现出结晶部分增强的趋势,将逐渐变得易碎。
作为一种药物缓释载体材料,其溶蚀过程直接控制了药物的释放。通过对材料溶蚀机制的分析可以初步推测出材料负载药物时的释药机制,从SEM观察的材料表面形貌变化、红外光谱分析的基团构象变化和X-射线图谱结晶变化分析结果可看出,SP/PVA/PEG材料的释药机制是通过SP首先溶出降解,形成细微孔道,此时可释药;而后随着PVA非晶区降解,以及PEG羟基结合外界水分、酶等形成溶蚀降解,使材料释药孔隙再次增大,此时药物可继续释放;随着材料结晶区区域缓慢溶蚀降解,药物释放也随之缓慢进行至全部溶出。

图5 ((SF+PVA)︰PEG=90︰10)膜溶蚀前后X-射线衍射图谱Fig.5 XRD curves of composite materials ((SF+PVA)︰PEG=90︰10)before and after being eroded
3 结 语
采用水相共混的方法制备的SF/PVA/PEG复合材料,IR表征分析认为PEG的加入增强了SF和PVA分子间相互结合。采用模拟胃液降解的方法探讨SF/PVA/PEG复合材料的溶蚀现象和过程,结果表明,材料的溶蚀是通过SF溶出,形成细微孔道,而后随着溶蚀时间延长PEG再缓慢溶出,同时逐步溶蚀PVA完成。以其溶蚀机制可推测释药机制,SF/PVA/PEG复合材料具备应用于缓释药物载体的前景。
[1] 杨立群,杨丹,孟舒,等.丝素蛋白作为药物缓释载体的研究进展[J].中国医药生物技术,2009,4(6):449-451.
[2] 卢神州.丝素蛋白材料的生物学性能[J].丝绸,2007(12):58-62.
[3] 顾卓,冯惠,王建军,等.丝素-聚乙烯醇共混溶液静电纺丝及其含银纳米纤维形态研究[J].合成技术及应用,2008,23(1):11-13.
[4] 薛华育,顾卓,戴礼兴,等.再生丝素/聚乙烯醇共混纳米纤维的制备及表征[J].高分子材料科学与工程,2007,23(6):240-243.
[5] 宁丽,薛淼,黄海宁,等.皮肤再生膜的生物相容性系列研究[J].中国修复重建外科杂志,2000,14(1):44-48.
[6] 张兴,堵国成,陈坚.聚乙烯醇降解酶研究进展[J].中国生物工程杂志,2003,23(2):69-73.
[7] LI M Z, NORIHIKO M, DAI L X, et al. Preparation of porous poly (vinyl alcohol )-silk fi broin (PVA/SF) blend membranes[J].Macromolecular Materials and Engineering,2001,286(9): 529-533.
[8] 陈忠敏,郝雪菲,范开.镶嵌纳米级再生丝素蛋白聚乙烯醇膜的制备及促细胞生长性能[J].生物医学工程学杂志,2010,27(6):1292-1297.
Dissolution mechanism of composite materials consisting of SF, PVA and PEG in the simulated gastric juice
CHEN Zhong-min, ZHANG Yan-dong, LUO qin, HU Ren-jian
(College of Pharmacy and Bioengineering, Chongqing University of Technology, Chongqing 400054, China)
The composite materials consist of different ratios of silk fibroin (SF), polyvinyl alcohol (PVA) and polyethylene glycol (PEG) which were prepared through the water phase blending method with polyethylene glycol as the plasticizer. The transformation of the composite materials before and after dissolution were investigated by the weight loss test, FTIR spectroscopy, scanning electron microscopy (SEM), and X-ray diffraction (XRD).The results reveal that the composite materials dissolve beginning with the digestion,decomposition of SF and formulation of micro-pores, and then the gastric juice dissolves PEG and PVA step by step through micro-pores. The composite materials are looked forward to using in the drug control-release system.
Silk fibroin; Polyvinyl alcohol; Polyethylene glycol; Drug control-release materials; Degradation mechanism
TS149
A
1001-7003(2012)04-0001-04
2011-12-15;
2012-01-30
重庆市高等学校优秀人才支持计划(2011CQ04);国家教育部留学回国人员科研启动基金资助(2006CR01)
陈忠敏(1968- ),女,教授,主要从事医用药用材料研究。

