植物耐热性的分子机制研究进展
鞠冠华,崔丽洁,张书,钱忠英,潘静娴,开国银
(上海师范大学植物种质资源研发中心/生命与环境科学学院,200234)
植物在生长发育过程中会受到各种非生物因子的胁迫,其中温度对植物生长发育的影响尤其严重。近年来,随着全球“温室效应”的加剧,气温上升,植物面临着高温的胁迫。一般认为,当温度高于环境温度10~15℃时,植物就会产生热激反应(heat shock response),在数小时内迅速获得耐热性,以抵御致死高温[1]。但是高温会影响植物的各种生理生化过程,如抑制光合作用、改变细胞膜稳定性、改变激素和次级代谢物的合成,甚至导致植物死亡[1],因此,探究植物耐热性机理和分子机制对于提高植物耐热性及植物的引种选育都具有指导意义。
1 植物耐热性的分子机理
植物在长期的进化过程中形成了各种机制使其在温度升高的情况下得以生存,包括遗传机制、形态适应、短期的逃避机制(改变叶片方向和蒸腾作用等)、细胞生理反应等。
1.1 热激蛋白(Heat shock proteins,Hsps)
陆地上的植物通常一年四季都暴露在外界大范围的温度波动当中,和许多动物不同的是,植物固定在一个地方生长,且不能逃脱它所不适宜的温度环境。为了生存,植物必须能够预期到即将面临的为害,然后在细胞中表达和积累所谓的热休克蛋白(Hsps)基因,从而来对抗热损伤。
植物在热胁迫下会瞬时合成新的或功能增强的Hsps,Hsps的积累可以增强植物的耐热性[2],从而维持细胞正常的生理行为。在真核细胞中由热激基因所编码的热激蛋白在结构上可分为6个家族:Hsp100、Hsp90、Hsp70、Hsp60(Chaperonins)、 小 分子量热激蛋白(small Hsps,sHsps)以及泛素蛋白(8.5 kDa)[3],其中发挥最主要作用的就是 sHsps[4]。
①sHsps 存在于高级植物的叶肉组织中,sHsps是最丰富的一个组分,为17~30 kDa。sHsps含量的丰富和它的遗传特性说明其可能具有独特的生理功能[5]。植物中一般会产生20种以上的sHsp,它们含量丰富并呈不均匀分布,是植物体中最主要的压力应激Hsp。植物sHsp都是由细胞核编码的,分为6个级别:CⅠ、CⅡ、CⅢ位于细胞质和细胞核中,其他3个组分CⅣ、CⅤ、CⅥ位于原质体、内质网和线粒体中。所有的sHsps都有90个保守氨基酸碳端区域,就是所谓的热休克区域。这个区域使得sHsps能够被热诱导而且可能在伴侣活性方面有很重要的作用。在植物中,sHsps的积累量和耐热性呈正相关。Korotaeva等[6]研究发现,当玉米、小麦和黑麦在42℃的环境中时,玉米中有5种线粒体 sHsps(28,23,22,20,19 kDa)表达,而在小麦和黑麦中只有一种sHsp(20 kDa)表达,这说明玉米相对小麦和黑麦具有更强的耐热性。
②Hsp70 Hsp70家族成员具有很大的保守性,在氨基酸序列上至少50%是相同的。Hsp70家族蛋白包括:大肠杆菌dnaK蛋白,酵母细胞质基质蛋白Ssalp和Ssa2p。它们存在于真核细胞的线粒体、细胞质、细胞核、内质网和叶绿体中。Hsp70家族蛋白在高温、寒冷和化学品刺激等环境压力下都会表达,同样,过表达Hsp70会诱导植物的耐热性和对环境压力的抵抗性[7]。
③Hsp100和Hsp90 组成型表达的Hsp100家族蛋白,在环境压力下可以上调,它们的主要功能是保护蛋白质,防止其变性和聚集。研究表明,Hsp101对于拟南芥和酵母的耐热性都是必需的,同时对于其他植物的耐热性也是非常关键的[8]。在拟南芥中过表达Hsp101对于其生长过程中的恢复期有积极影响[9]。最近也发现,Hsp101同源蛋白在拟南芥中也涉及细胞质体分化过程中调节内部类囊体膜的形成和在热激压力下赋予叶绿体耐热性的作用[10,11]。
Hsp90家族蛋白的大小在80~94 kDa,是一种ATP依赖的分子伴侣,主要功能是协助蛋白折叠,并在各种胁迫反应中表达量增加[2]。Hsp90也是高度保守,通过全基因组测序鉴定到葡萄中的7个Hsp90基因和拟南芥的相应基因具有高度相似性,而且在提高温度时,Hsp90表达量会增加,这也说明Hsp90在热激反应时起保护作用[12,13]。
④Hsp60和泛素蛋白 Hsp60家族是一类高度保守的大小约为60 kDa的分子伴侣,它们在原核和真核中的成员是二聚体而且是被磷酸化的亚型。这个家族的成员通常是具有14个亚基的低聚物,位于细菌的细胞质当中,主要在胞液、线粒体与叶绿体的内部,不存在于内质网和细胞质中。主要帮助蛋白的折叠和其亚基的装配,并且需要一个更小的大约10 kDa的伴侣蛋白与之一起作用[14]。
泛素蛋白是一类广泛存在于真核细胞中的高度保守的蛋白,是由75~76个氨基酸残基组成的低分子量蛋白,存在于每一个真核细胞中。泛素蛋白对于热激诱导合成中的耐热性和恢复性有着至关重要的作用,主要介导蛋白的降解。在牧豆树和大豆遭受热胁迫时,作为一种重要的耐热机制,泛素蛋白在热胁迫开始的30 min内会大量合成[15]。
1.2 抗氧化系统
高温胁迫会使植物发生氧化应激反应,产生一系列活性氧中间体(reactive oxygen species,ROS),如 O2-·、H2O2、·OH 及丙二醛(MDA)等,它们会催化细胞膜脂质和色素类的过氧化反应,从而导致细胞膜渗透性增加,破坏其功能。这时,植物便会产生一些酶和抗氧化剂,如超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、抗坏血酸(AsA)、脱氢抗坏血酸还原酶(DHAR),h 型硫氧还蛋白(Trxh)、谷胱甘肽还原酶(GR)及谷胱甘肽(GSH)等,来清除ROS对细胞膜的伤害,提高植物的耐热性[16,17]。Khanna 等[18]研究发现,在藜(Chenopodium album)的叶片和花序的叶绿体和线粒体中含有多种耐热性的SOD和APX,而且SOD的热稳定性优于APX。
1.3 植物激素
在植物的耐热等环境应激反应中,包括脱落酸(ABA)和水杨酸(SA)等多种植物激素也都参与其中。比如,有研究证实ABA在翦股颖(Agrostispalustris)遭受热胁迫后的植株恢复期中有所积累并发挥作用[19],ABA转录因子ABF3的过表达可以使植物获得对高温、冷冻等胁迫的抗性[20]。SA是植物系统获得耐热性(SAR)和过敏反应(HR)信号通路中的重要组分,SA通过稳定热休克转录因子促使Hsps产生[21]。此外,SA的衍生物磺基水杨酸(SSA)能够有效地清除黄瓜在热胁迫时产生的H2O2[22]。
1.4 渗透调节物质
在压力环境下,植物会积累很多渗透调节物质如糖类、糖醇、脯氨酸、叔铵和季铵化合物及叔硫化合物等来增强植物的抗逆性。Amooaghaie等[23]研究发现,多胺类可以使热处理后的大豆幼苗恢复生长,而用多胺类的抑制剂CHA和DMFO处理会导致幼苗的热敏性增强。甜菜碱(GB,一种两性的季铵化合物)在植物遭受高盐或高温胁迫时会作为主要的渗透调节物质发挥作用,如玉米和甘蔗在遭受干旱或高温时就会大量积累GB来保持水分[24]。同样,脯氨酸和可溶性糖类在植物遭受高温胁迫时也会大量积累来提高耐热性,它们也是植物抵御高温胁迫的最受关注的渗透类物质[25]。但是最近也有研究指出,高温下拟南芥幼苗中脯氨酸的积累可能会诱导ROS的产生从而降低其耐热性,而ABA和乙烯会抑制这一过程[26]。
1.5 光合作用与蒸腾作用
光合作用是植物最重要的生理过程之一,对高温胁迫也最为敏感。高温可以破坏光系统Ⅱ、阻止CO2的扩散、降低 Rubisco(1,5-二磷酸核酮糖羧化酶/加氧酶)对CO2的亲和力及使PEP(磷酸烯醇式丙酮酸)羧化酶和丙酮酸羧激酶活性下降等,从而导致光合速率降低[27]。与不耐热品种相比,耐热品种在高温解除后净光合速率回升较快,能维持较高的同化速率[28]。此外,叶绿素的含量也是判断耐热性的一个标准,被作为覆盆子耐热性指标[29]。有研究指出,通过喷洒外源Ca2+可以有效地提高应激反应中烟草的光合作用,从而增强其耐热性[30]。
水分对植物耐热性的影响主要与蒸腾作用的强度有关,在一定的温度范围内,随着温度的升高,植物的叶导度增加,蒸腾作用增强,可以起到降温作用,但随着蒸腾作用的加强,植物会因为缺水而枯萎,这时要降低蒸腾速率来维持体内的水分,而耐热品种的这种保护能力更强[31]。
1.6 细胞膜热稳定性(cell membrane thermostability,CMT)
高温会破坏细胞膜的脂质双分子层,使质膜的电解质通透性增加,降低细胞膜的稳定性,因此,CMT也成为众多植物品种中衡量其耐热性的主要指标之一,如小麦、棉花、高粱和大麦等。陈希勇等[32]测定了春小麦多种基因型幼苗的CMT,结果发现CMT与产量性状表现出较高的正相关。
1.7 其他耐热机制
植物叶片会向大气层中不断挥发大量的挥发性有机化合物(volatile organic compounds,VOCs),其中异戊二烯和单萜占了80%以上,最近众多研究表明VOCs的挥发是植物耐热性的一项重要机制[33]。Kadman等[34]分别将过表达异戊二烯和野生型的拟南芥品种在60℃下处理2.5 h,结果发现前者明显具有更好的耐热性。
自然生态系统中的所有植物都是与真菌共生的,这些真菌在获取营养时会不同程度地影响宿主的适应性。Regina等[35]通过研究指出,这种植物和真菌的共生系统会使植物获得耐热性,他们从美国两个火山地收集了200种植物,研究表明,这些植物不论在试验条件下还是田间种植条件下,与真菌Curvulariasp.(弯孢霉属)共生的植物都具有更好的耐热性。Baynes等[36]指出,广泛生长在亚欧大陆和北美的旱雀草(Bromustectorum)的耐热性也与其共生的羊肚菌(Morchella)有关。
1.8 植物耐热机制的信号途径
植物在高温胁迫下的耐热性反应由一系列的信号途径参加完成,复杂而有序,这些信号机制中包括离子运输者、渗透保护剂、自由基清除剂、信号级联反应和转录控制中的一系列蛋白和元素,这些物质的协同运作对抵制压力效应都是必需的。其中,有些组分是此信号通路中的关键因素,如细胞膜和第二信使(Ca2+、NO、H2O2等)及各种下游调节组分(钙调蛋白、MAPK、Hsp90、Hsfs、ATP、PLC9 等)[37~40]。植物耐热性的一系列改变和机制,从感知高温到信号传导,再到产生一系列相关代谢物来应付各种热激胁迫,其基本原理和过程都已被提出[1](图1)。
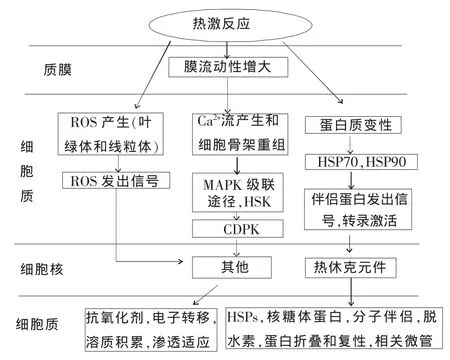
图1 植物耐热反应的机制
2 植物耐热性的分子生物学研究
2.1 植物耐热性相关转录因子的研究
在植物耐热的信号传导过程中,转录因子是一个关键因素,在胁迫反应中它们不断合成并将信号传递和放大,调控下游基因的表达,从而引起植物的一系列抗逆反应。目前在植物的耐热机制中,已发现了多种转录因子。Hsfs(heat shock transcription factors)是植物耐热机制中最重要的一类转录因子,它诱导Hsps的产生[41]。在植物中有20多种Hsfs,番茄HsfA1a和拟南芥HsfA2是诱导产生耐热性的主要转录因子[42],而且通过对眼子菜属不同种耐热性的对比研究发现,由HsfA2诱导获得的耐热性具有种的特异性[43]。Suzuki等[44,45]发现,转录因子 MBF1c(multiprotein bridging factor 1c)是拟南芥耐热过程中必需的,它可以在热激反应中控制36种不同转录本的表达来介导植物对高温的耐性。APX1(cytosolic ascorbateperoxidase1) 和 Zats(zincfinger proteins)在植物耐热反应ROS信号传导中发挥着必不可少的作用[46,47]。DREB2A/DREB2C(dehydrationresponsive element-binding proteins)通过激活HsfA3 来正调控植物的耐热性[48,49]。Li等[50]利用 WRKY家族中的WRKY25/26/33的拟南芥缺失突变体作为研究材料,通过试验发现它们与野生型相比热敏感度增加,发芽率和成熟率明显下降,可见WRKY也是植物耐热反应中必不可少的转录因子。此外,MYB类、bZIP类、NAC类和AP2/EREBP类转录因子在植物防卫反应和逆境胁迫应答过程中具有重要功能[51]。
2.2 植物耐热性的遗传规律研究
植物的耐热性并不是由某一种耐热基因所决定,而是在不同生命周期和不同部位由不同基因控制。下面介绍几种常用的分析方法及研究结果。
①数量性状位点(QTL,Quantitative trait loci)分析 开始运用QTL的方法来分析植物的耐热性是在1991年,Ottaviano等[52]发现在玉米的44个重组自交系(RILs,recombinant inbred line)的遗传性CMT中,有6个QTLs占了全部遗传变异的53%。盘毅等[53]以耐热水稻品系996和热敏感品系4628为亲本构建的RILs为材料,采用复合区间作图法检测到2个花粉育性耐热性QTL,命名为qPF4和qPF6,对高温胁迫下花粉育性的表型解释率分别为15.1%和7.15%。
②共分离(Co-segregation)分析 在春小麦的RIL群体里,小麦幼苗耐热性的获得是依据CMT与以色列炎夏中小麦产量的RILs的对应关系而确定的[54],此外,关于Hsps参与耐热性的遗传效应也是通过对冬小麦RILs的共分离分析揭示的[55]。陈飞雪等[56]利用耐高温和不耐高温黄瓜品系为材料,利用SSR(Simple Sequence Repeats)和 SRAP(Sequencerelated amplified polymorphism)引物进行多态性和选择基因型分析,发现了1个SSR和9个SRAP标记与黄瓜耐高温QTL连锁,对表型贡献率为6%~17%。
③遗传繁殖群(Genetic stock)分析 通过分析小麦、大麦、燕麦或其他谷类的遗传繁殖系,包括末端缺失、重组和移位品系以及杂交系,可以说明这些谷类耐热性的遗传基础。例如,缺失染色体1B长臂的小麦品种可以在更低的温度下获得耐热性,而缺失7D长臂的小麦品种变为热敏性并且Hsp的表达合成下降,可见,染色体1B长臂携带有在低温和耐热反应中抑制热激反应的基因,而7D长臂携带有诱导Hsps合成和获得耐热性的必需基因[57]。
最近利用转基因、反向遗传学和突变的方法分析一些非谷类植物品种所获得的实验数据有力地证明了Hsp在植物耐热性中的作用。利用热敏感突变体证实了4个基因位点在拟南芥中决定了获得耐热性的能力,其中包括编码Hsp101的基因[58]。
3 展望
详细介绍了目前在植物耐热性分子机理和遗传规律等方面获得的研究成果,为耐热性品种的培育提供了理论基础。在众多参与植物热激反应的成分中,Hsps是最为重要的一类物质,利用转基因技术获得Hsps高表达的品种不失为一种有效的培育方法。此外,选育耐热品种,进行热锻炼及在幼苗上喷洒ABA、SA、Ca2+等植物生长调节剂也是提高耐热性的有效方法[23]。
尽管前人对植物的耐热性进行了较多的研究,但目前植物对抗热胁迫方面还存在一些问题:①对耐热性的遗传机理研究不够深入,多集中于对植物耐热性相关的农艺性状和生理特性的分析;②很多研究仅仅停留在实验中,许多实验结果并未能真正用到生产实践中;③对于植物的耐热性研究现阶段主要集中在农作物上等,对木本植物的耐热性研究比较少,而且对于木本植物的抗热性的研究还没有形成一个完整的系统。
高温胁迫是影响植物生长、降低农作物产量的主要非生物胁迫之一,因此,获得耐热性在内的各种抗逆性是人们最为希望得到的作物品质。我们只有通过在热胁迫环境下,对植物体内的一系列参数变化进行进一步的探究,才可以从变化中找到与抗热性密切相关的各种因素,为今后植物抗热性研究奠定重要的基础。
[1]Wahid A,Gelani S,Ashraf M,et al.Heat tolerance in plants:an overview [J].Environmental and Experimental Botany,2007(61):199-223.
[2]Miller G,Mittler R.Could heat shock transcription factors function as hydrogen peroxide sensors in plants[J].Annals of Botany,2006(98):279-288.
[3]Banu E.Heat shock proteins and heat shock response in plants[J].Gazi University Journal of Science,2009,22(2):67-75.
[4]Gulli M,Rampino P,Lupotto E,et al.The effect of heat stress and cadmium ions on the expression of a smallhspgene in barley and maize[J].Journal of Cereal Science,2005,42:25-31.
[5]Vierling R A,Nguyen H T.Heat-shock protein gene ex-pression in diploid wheat genotypes differing in thermal tolerance[J].Crop Sci,1992,32:370-377.
[6]Korotaeva N E,Antipina A I,Grabelynch O I,et al.Mitochondrial low-molecular-weight heat shock proteins and tolerance of crop plant's mitochondria to hyperthermia[J].Fiziol Biokhim Kul'turn Rasten,2001,29:271-276.
[7]Maestri E,Klueva N,Perrotta C,et al.Molecular genetics of heat tolerance and heat shock proteins in cereals[J].Plant Molecular Biology,2002,48:667-681.
[8]William B G.HSP101:a key component for the acquisition of thermo tolerance in plants[J].The Plant Cell,2000,12:457-460.
[9]Vinocur B,Altman A.Recent advances in engineering plant tolerance to abiotic stress:achievements and limitations[J].Current Opinion in Biotechnology,2005,16:123-132.
[10]Lee U,Ripflorido I,Hong S,et al.The Arabidopsis ClpB/Hsp100 family of proteins:chaperones for stress and chloroplast development[J].The Plant Journal,2007,49:115-127.
[11]Myouga F,Motohashi R,Kuromori T,et al.An Arabidopsis chloroplast-targeted Hsp101 homologue,APG6,has an essential role in chloroplast development as well as heat stress response[J].The Plant Journal,2006,48:249-260.
[12]Krishna P.Plant responses to heat stress[J].Topics in Current Genetics,2004,4:73-102.
[13]Banilas G,Korkas E,Englezos V,et al.Genome-wide analysis of the heat shock protein 90 gene family in grapevine(VitisviniferaL.)[J].Australian Journal of Grape and Wine Research,2012,18:29-38.
[14]Xu Y,Zhan C Y,Huang B R.Heat shock proteins in association with heat tolerance in grasses[J].International Journal of Proteomics,2011:1-10.
[15]Ortiz C,Cardemil L.Heat-shock responses in two leguminous plants:a comparative study[J].J Exp Bot,2001,52:1 711-1 719.
[16]Xu S,Li J,Zhang X,et al.Effects of heat acclimation pretreatment on changes of membrane lipid peroxidation,antioxidant metabolites,and ultrastructure of chloroplasts in two cool-season turfgrass species under heat stress[J].Environ Exp Bot,2006,56:274-285.
[17]Zou J,Liu C F,Chen X B.Proteomics of rice in response to heat stress and advances in genetic engineering for heat tolerance in rice[J].Plant Cell Rep,2011,30:2 155-2 165.
[18]Khanna-Chopra R,Jajoo A,Semwal V K.Chloroplasts and mitochondria have multiple heat tolerant isozymes of SOD and APX in leaf and inflorescence inChenopodium album[J].Biochemical and Biophysical Research Communications,2011,412:522-525.
[19]Larkindale J,Huang B R.Effects of abscisic acid,salicylic acid,ethylene and hydrogen peroxide in the rmotolerance and recovery for creeping bentgrass[J].Plant Growth Regul,2005,47:17-28.
[20]Kim J B,Kang J Y,Kim S Y.Over-expression of a transcription factor regulating ABA-responsive gene expression confers multiple stress tolerance[J].Plant Biotechnology Journal,2004,2:459-466.
[21]Kawano T,Sahashi N,Takahashi K,et al.Salicylic acid induces extracellular superoxide generation followed by an increase in cytosolic calcium ion in tobacco suspension culture:the earliest events in salicylic acid signal transduction[J].Plant Cell Physiol,1998,39:721-730.
[22]Shi Q,Bao Z,Zhu Z,et al.Effects of different treatments of salicylic acid on heat tolerance,chlorophyll fluorescence,and antioxidant enzyme activity in seedlings ofCucumis sativaL.[J].Plant Growth Regul,2006,48:127-135.
[23]Amooaghaie R,Moghym S.Effect of polyamines on thermotolerance and membrane stability of soybean seedling[J].African Journal of Biotechnology,2011,10(47):9 673-9679.
[24]Wahid A,Close T J.Expression of dehydrins under heat stress and their relationship with water relations of sugarcane leaves[J].Biol Plant,2007,51:104-109.
[25]张显强,罗在柒,唐金刚,等.高温和干旱胁迫对鳞叶藓游离脯氨酸和可溶性糖含量的影响 [J].广西植物,2004,24(6):570-573.
[26]Lv W T,Lin B,Zhang M,et al.Proline accumulation is inhibitory to Arabidopsis seedlings during heat stress[J].Plant Physiology,2011,156:1 921-1 933.
[27]欧祖兰,曹福亮.植物耐热性研究进展[J].林业科技开发,2008,22(1):1-5.
[28]付振书,赵世杰,孟庆伟,等.高温强光下耐热性不同的两个甘蓝品种幼苗光合作用差异的研究[J].园艺学报,2005,32(1):25-29.
[29]Molina-Bravoa R,Arellanob C R,Sosinskia B,et al.A protocol to assess heat tolerance in a segregating population of raspberry using chlorophyll fluorescence[J].Scientia Horticulturae,2011,130:524-530.
[30]Tan W,Meng Q W,Brestic M,et al.Photosynthesis is improved by exogenous calcium in heat-stressed tobacco plants[J].JournalofPlantPhysiology,2011,168:2063-2071.
[31]潘宝贵,王述彬,刘金兵,等.高温胁迫对不同辣椒品种苗期光合作用的影响[J].江苏农业学报,2006(2):137-140.
[32]陈希勇,孙其信,孙长征.春小麦耐热性表现及其评价[J].中国农业大学学报,2000,5(1):43-49.
[33]Chen J W,Cao K F.Plant VOCs emission:a new strategy of thermotolerance[J].Journal of Forestry Research,2005,16(4):323-326.
[34]Kanako S,Takuya S,Mari L,et al.Plants utilize isoprene emission as a thermotolerance mechanism[J].Plant Cell Physiol,2007,48(9):1 254-1 262.
[35]Redman S R,Sheehan K B,Stout R S,et al.Thermotolerance generated by plant/fungal symbiosis[J].Science,2002,298(22):1 581.
[36]Baynes M,Newcombe G,Dixon L,et al.A novel plantefungal mutualism associated with fire[J].Fungal biology,2012,116:133-144.
[37]Saidi Y,Finka A,Goloubinoff P.Heat perception and signalling in plants:a tortuous path to thermotolerance[J].New Phytologist,2011,190:556-565.
[38]Xuan Y,Zhou S,Wang L,et al.Nitric oxide functions as a signal and acts upstream of AtCaM3 in thermotolerance in Arabidopsis seedlings[J].Plant Physiology,2010,153:1 895-1 906.
[39]Snider J L,Oosterhuis D M,Kawakami E M.Mechanisms of reproductive thermotolerance inGossypium hirsutum:the effect of genotype and exogenous calcium application[J].J Agronomy Crop Science,2011,19:228-236.
[40]Zheng S Z,Liu Y L,Li B,et al.Phosphoinositide-specific phospholipase C9 is involved in the thermotolerance of Arabidopsis[J].The Plant Journal,2012,69:689-700.
[41]Kotak S,Larkindale J,Lee U,et al.Complexity of the heat stress response in plants[J].Curr Opin Plant Biol,2007,10:310-316.
[42]Koskull-Doring P V,Scharf K D,Nover L.The diversity of plant heat stress transcription factors[J].Trends in Plant Science,2007,12(10):452-457.
[43]Amano M,Iida S,Kosuge K.Comparative studies of thermotolerance:different modes of heat acclimation between tolerant and intolerant aquatic plants of the genusPotamogeton[J].Annals of Botany,2012,109:443-452.
[44]Suzuki N,Bajad S,Shuman J,et al.The transcriptional co-activator MBF1c is a key regulator of thermotolerance inArabidopsis thaliana[J].J Biol Chem,2008,283:9 269-9 275.
[45]Suzuki N,Sejima H,Tam R,etal.Identification of the MBF1 heat-response regulon ofArabidopsis thaliana[J].The Plant Journal,2011,66:844-851.
[46]Miller G,Suzuki N,Rizhsky L,et al.Double mutants deficient in cytosolic and thylakoid ascorbate peroxidase reveal a complex mode of interaction between reactive oxygen species,plant development,and response to abiotic stresses[J].Plant Physiol,2007,144:1 777-1 785.
[47]Miller G,Shulaev V,Mittler R.Reactive oxygen signaling and abiotic stress[J].Physiol Plant,2008,133:481-489.
[48]Yoshida T,Sakuma Y,Todaka D,et al.Functional analysis of anArabidopsisheat-shock transcription factorHsfA3in the transcriptional cascade downstream of the DREB2A stress-regulatory system[J].Biochem Biophys Res Commun,2008,368:515-521.
[49]Chen H,Hwang J E,Lim C J,t al.ArabidopsisDREB2C functions as a transcriptional activator ofHsfA3during the heat stress response[J].Biochem Biophys Res Commun,2010,401:238-244.
[50]Li S J,Fu Q T,Chen L G,et al.Arabidopsis thalianaWRKY25,WRKY26,and WRKY33 coordinate induction of plant thermotolerance[J].Planta,2011,233:1 237-1 252.
[51]李绪友,郑进,李万德.与植物抗逆性有关的转录因子研究概况[J].中国西部科技,2006(36):62.
[52]Ottaviano E,Sari-Gorla M,Pé E and Frova C.Molecular markers (RFLPs and HSPs)for the genetic dissection of thermotolerance in maize[J].Theor Appl Genet,1991,81:713-719.
[53]盘毅,罗丽华,邓化冰,等.水稻开花期高温胁迫下的花粉育性 QTL 定位[J].中国水稻科学,2011,25(1):99-102.
[54]Blum A,Klueva N,Nguyen H T.Wheat cellular thermotolerance is related to yield under heat stress[J].Euphytica,2001,117:117-123.
[55]Joshi C P,Klueva N Y,Morrow K J,et al.Expression of a unique plastid-localized heat-shock protein is genetically linked to acquired thermotolerance in wheat[J].Theoretical and Applied Genetics,1997,95:834-841.
[56]陈飞雪,张桂华,钱文成,等.与黄瓜耐高温QTL连锁的分子标记分析[J].南开大学学报:自然科学版,2008,41(4):49-54.
[57]O'Mahony P,Burke J J,Oliver M J.Identification of acquired thermotolerance deficiency within the ditelosomic series of' Chinese Spring'wheat[J].PlantPhysiol,Biochem.2000,38:243-252.
[58]Hong S W,Vierling E.Mutants ofArabidopsis thalianadefective in the acquisition of tolerance to high temperature stress[J].Proc Natl Acad Sci USA,2000,97:4 392-4 397.

