长期尼可地尔治疗对冠状动脉慢血流患者血管内皮功能和血清超敏C反应蛋白水平的影响
邹 祎 肖秀金 余泽洪 陈小林 汤立军 冼伟进 王晓霞
冠状动脉慢血流(Coronary Slow Flow,CSF)是指除外严重冠脉狭窄,痉挛、气体栓塞、溶栓治疗后、冠状动脉成形术后等,在冠状动脉造影中未发现冠状动脉存在明显病变,而远端血流灌注延迟的现象[1]。患者可以出现心绞痛甚至急性冠脉综合症的症状[2],由于该病的发病机制尚未完全阐明,目前临床上仍无有效的治疗方法。本文报道长期尼可地尔治疗对CSF患者血管内皮功能和血清超敏C反应蛋白(hs-CRP)水平的影响。
1 资料与方法
1.1 对象及分组治疗
2007年4月~2011年8月在本院心内科住院行冠脉造影时发现CSF患者66例,诊断依据矫正的心肌梗死溶栓试验(TIMI)血流计帧法,三支冠状动脉血管平均TIMI帧数>27定义为CSF[1]。将66例CSF患者随机分为常规治疗组和尼可地尔组。常规治疗组(n=33,男20例,女13例,年龄63.1±10.7岁)予以阿司匹林、他汀、血管紧张素转化酶抑制剂等常规治疗,尼可地尔组(n=33,男19例,女14例,年龄62.8±10.2岁)在常规治疗基础上加用尼可地尔(片剂,商品名喜格迈,默克雪兰诺制药公司,日本中外制药株式会社)5mg/次,3次/日,连续6个月。两组均排除未控制的高血压、糖尿病、心功能不全或其它器质性全身性疾病患者。另选取18例年龄和性别匹配的正常老年人为对照组(n=18,男11例,女7例,年龄63.5±11.4岁)。所有入选者均征得本人同意并签署知情同意书。
1.2 检查方法
1.2.1 常规检查:患者入院时按临床常规检查各组血糖、血脂、血压、心率等基本指标。
1.2.2 血管内皮功能检测:对照组和两病例组治疗起始时进行彩色多普勒超声测定血管内皮功能有关指标,两病例组治疗6个月后复查以上指标。(1)仪器:HPSONOS-5500型彩色超声仪(美国)。(2)检查前准备:检查前停用β受体阻滞剂、钙拮抗剂、血管紧张素转化酶抑制剂、血管紧张素受体拮抗剂至少48h,停用茶碱类药物和双嘧达莫至少24h,12h内避免进食含咖啡因的饮料和食物,空腹4h。(3)检测方法:参照Celermajer等[3]的方法,采用7.5MHz线性探头,探测深度为4cm。患者取仰卧位,右上肢外展15度,掌心向上,以肘上2~15cm范围内的肱动脉为靶动脉,取其纵切面,当动脉前后壁内膜显示最清楚时,调节增益将图像放大至屏幕每线宽度为0.065mm,在血管舒张末期(同步记录心电图,以心电图R波判断心动周期的舒张末期)测量肱动脉前后壁内膜之间的距离。每次测定取同一部位分别测3个心动周期,取其平均值。每个受试者采集基础像(D0)和反应性充血像(D1)。受试者测试前休息10min,在测定D0后进行反应性充血试验:将血压计袖带置于靶动脉远端,充气加压至300mmHg,4min后放气,放气后60~90s之内测D1。休息15min,待血管内径恢复试验前状态后,舌下含服硝酸甘油400μg,4min后再测定肱动脉内径(D2)和血流速度。(4)指标计算:内皮依赖性血管舒张功能(FMD)=(D1-D0)/D0×100%,非内皮依赖性血管舒张功能(NID)=(D2-D0)/D0×100%,血流量(ml/min)由仪器自动计算并显示。所有操作由一位有经验的B超医师进行盲法检测。
1.2.3 hs-CRP测定:对照组及两病例组治疗起始时测定非特异性炎症指标hs-CRP,治疗半年后两病例组复查。即采集空腹血3ml,离心后取血清,保存于-70℃冰箱,采用免疫透射比浊法进行测定(美国德灵公司BNP全自动特种蛋白分析仪及试剂盒)。
1.3 统计学处理
2 结 果
2.1 各组临床基本资料比较
两病例组年龄、性别、体重指数、高脂血症、心力衰竭、糖尿病、吸烟史、高血压病等临床基本资料差异均无统计学意义(P>0.05),对照组与两病例组年龄、性别、体重指数、吸烟等差异无统计学意义(P>0.05),见表1。
2.2 各组血管内皮功能比较
三组间基础肱动脉内径和基础血流量均无明显差异(P>0.05)。尼可地尔组和常规治疗组治疗前FMD均明显低于对照组(P<0.01),治疗6个月后尼可地尔组FMD明显高于常规治疗组(P<0.01),亦较治疗前明显升高(P<0.01),而三组间NID无明显差异(P>0.05)。常规治疗组治疗前后无明显差异(P>0.05)。见表2。
2.3 各组血清hs-CRP水平比较
治疗前尼可地尔组和常规治疗组血清hs-CRP水平无明显差异(P>0.05),均明显高于对照组(P<0.01)。治疗6个月后尼可地尔组血清hs-CRP低于治疗前水平(P<0.01);但常规治疗组治疗前后无显著变化。见表2。
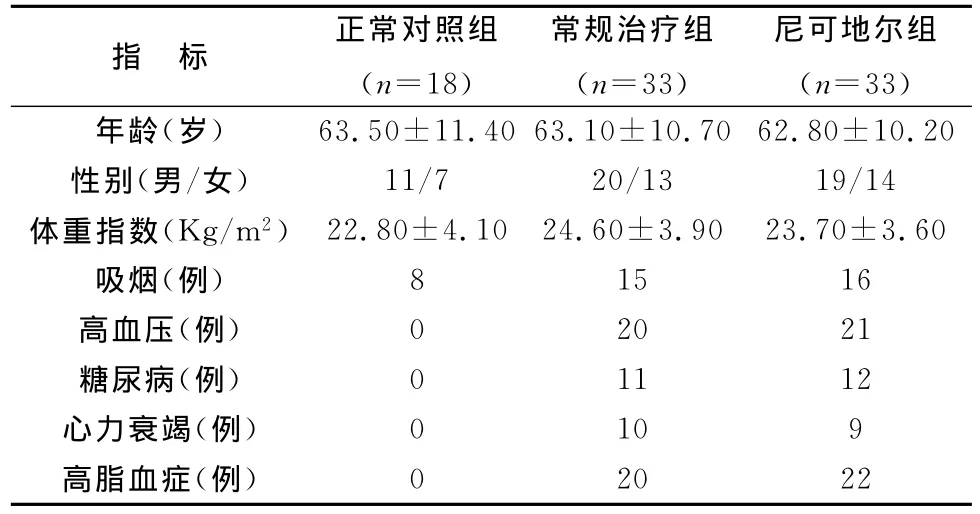
表1 各组临床基本资料比较
表2 CSF治疗前后血管内皮功能指标和血清hs-CRP水平比较(s)
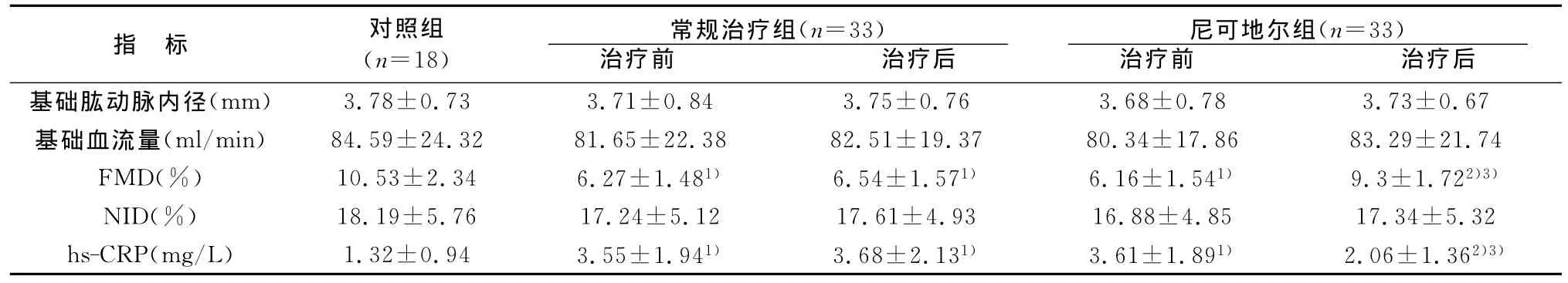
表2 CSF治疗前后血管内皮功能指标和血清hs-CRP水平比较(s)
注:与对照组比较,1)P<0.01;与同组治疗前比较,2)P<0.01;与常规治疗组治疗后比较,3)P<0.01
指 标 对照组(n=18)常规治疗组(n=33)治疗前 治疗后尼可地尔组(n=33)治疗前 治疗后基础肱动脉内径(mm)3.78±0.73 3.71±0.84 3.75±0.76 3.68±0.78 3.73±0.67基础血流量(ml/min)84.59±24.32 81.65±22.38 82.51±19.37 80.34±17.86 83.29±21.74 FMD(%)10.53±2.34 6.27±1.481) 6.54±1.571) 6.16±1.541) 9.3±1.722)3)NID(%)18.19±5.76 17.24±5.12 17.61±4.93 16.88±4.85 17.34±5.32 hs-CRP(mg/L)1.32±0.94 3.55±1.941) 3.68±2.131) 3.61±1.891) 2.06±1.362)3)
2.4 不良反应
尼可地尔组有1例出现轻度头痛,三天后缓解,未影响服药;未发现低血压、肝肾功能损害和消化系统症状等不良反应。
3 讨 论
CSF现象的病理生理机制目前尚未阐明,传统观念认为微血管功能异常是导致CSF现象的主要原因,而血管内皮功能失调又是微血管功能异常的重要因素。其在动脉硬化[3]、高血压[4]、冠心病[5]等的进展中发挥重要作用。近来有学者发现CSF现象与血管内皮功能失调有关[6,7]。
1992年,Celermajor等[3]在世界上首次建立了无创肱动脉评价内皮功能的方法,即通过测量肱动脉血流介导的血管扩张功能指标FMD来评价血管内皮功能。Anderson等[8]应用高分辨率超声技术对肱动脉血流介导的血管舒张功能进行评价,结果发现该方法可以在动脉硬化、功能改变的极早期检测出患者肱动脉内皮依赖性舒张功能受损,该方法不仅无创,而且具有良好的精确性和可重复性。与超声技术测定的肱动脉血流介导的肱动脉内皮依赖性舒张功能和向冠脉内滴注乙酰检测冠状动脉内皮功能状态的方法比较呈高度相关[9],可以间接反映冠状动脉内皮依赖性舒张功能。所以本研究采用FMD来评价CSF患者的内皮功能及观察尼可地尔治疗对其影响。
Ari等[7]和 Gunes等[10]已经证实 CSF患者存在血管内皮功能受损。本研究结果表明,治疗前CSF患者FMD明显低于对照组,说明SCF患者的内皮依赖性舒张功能下降,与前述的研究结果相符。经6个月治疗后,尼可地尔组FMD高于常规治疗组,而常规治疗组FMD与治疗前无明显差异,提示尼可地尔可改善CSF患者的血管内皮功能。尼可地尔是一种具有双重作用机制的ATP敏感钾通道开放剂,兼有类硝酸酯作用和ATP敏感钾通道开放作用。Sekiya等[11]的研究表明,尼可地尔治疗3个月可以明显改善冠心病患者的血管内皮功能,而具有类硝酸酯作用的硝酸异山梨酯却对血管内皮功能有损害作用,提示尼可地尔可能是通过激活ATP敏感钾通道来改善血管内皮功能。有动物实验表明[12]尼可地尔可开放钾离子通道、增加内皮细胞Ca2+内流,从而上调血管内皮对NO合酶的表达,使内皮源性NO合成增加,抑制内皮细胞凋亡,抑制炎症反应和抗氧化反应。这可能是尼可地尔改善血管内皮功能的重要机制之一。
Barutcu等[13]发现CSF患者的CRP水平明显升高。本研究中CSF患者的血清hs-CRP水平明显高于对照组,与之相符。另外,本文还观察到尼可地尔治疗后,CSF患者hs-CRP水平明显下降,提示尼可地尔可抑制CSF患者的炎症反应。CRP是机体非特异性炎症反应的敏感指标,可直接反映血管及其内皮细胞的炎症状态。Li等[14]认为CSF现象是一种新型的冠状动脉炎性病变,可能是冠心病的一种新的发病机制。尼可地尔可能通过多种途径减少斑块中的炎症细胞,抑制炎症反应表达,降低炎症介质水平[15,16]。多项研究[15,17]证实,尼可地尔可抑制行冠脉血管成形术和搭桥术的稳定型心绞痛患者的炎症反应;Ishibashi等[18]发现尼可地尔还可抑制非冠心病患者的炎症反应。本文结果也表明尼可地尔对CSF患者具有类似效应。这些效应的确切机制尚不清楚,有的实验研究者提出此效应可能因为尼可地尔具有提供NO等特性所致[16],另一些研究者认为是因为尼可地尔使ATP敏感钾离子通道开放所致[15,19],或两者兼而有之[20]。近来越来越多证据[11,21]表明尼可地尔抑制炎症因子、改善血管内皮功能主要是因为ATP敏感钾通道的开放所致。
传统的抗缺血治疗对CSF患者的作用是有限的,本研究证实长期尼可地尔治疗可抑制CSF患者的炎症反应,改善其血管内皮功能。
1 Mangieri E,Macchiarelli G,Ciavolella M,et al.Slow coronary flow:clinical and histopathological features in patients with othwise normal epicardial coronary arteries[J].Cathet Cardiovasc Diagn,1996,37(2):375~381.
2 Beltrame JF,Tumer SP,Leslie SL,et al.The angiographic and clinical benefits of mibefradil in the coronary slow phenomenon[J].J Am Coll Cardiol,2004,44(2):57~62.
3 Celermajer DS,Sorensen KE,Gooth VM,et al.Non invasive detction of endothelial dysfunction in children and adults at risk of atherosclerosis[J].Lancet,1992,340(8 828):1 111~1 115.
4 林 荣,骆秉铨,冯小平.高血压患者血管内皮依赖性舒张功能失调的研究[J].微循环学杂志,2000,10(4):36~38.
5 Araujo JA.Circulating microparticles from patients with coronary artery disease cause endothelial dysfunction response[J].Rev Esp Cardiol.2012,65(4):389~390.
6 韩雅君,卢 微,王 玲,等,慢血流现象与内皮功能的相关分析[J],中国介入心脏病学杂志,2009,17(6):332~334.
7 Ari H,Ari S,Erdoˇgan E,et al.The effects of endothelial dysfunction and inflammation on slow coronary flow[J].Turk Kardiyol Dern Ars,2010,38(5):327~333.
8 Anderson TJ,Ueheta A,Cerhard MD,et al.Close relation of endothelial function in the humen coronary and periphera circulations[J].J Am Coll Cardiol,1995,26(4):1 235~1 241.
9 Takase B,Ueheta A,Akima T,et al.Endothelium-dependent flow-mediated vasodilation of coronary and brachial arteries in suspected coronary artery disease[J].Am J Cardiol,1998,82(4):1535~1539.
10 Gunes Y,Gumrukcuoglu HA,Akdag S,et al.,Vascular endothelial function in patients with coronary slow flow and the effects of nebivolol[J].Arq Bras Cardiol,2011,97(4):275~280.
11 Sekiya M,Sato M,Funada J,et al.Effects of the long-term administration of nicorandil on vascular endothelial function and the progression of arteriosclerosis[J].J Cardiovasc Pharmacol,2005,46(1):63~67.
12 Hashimoto M,Shinozuka K,Sasaki T,et al.Nicorandil-induced ATP release in endothelial cells of rat caudal artery is associated with increase in intracellular Ca(2+)[J].Eur J Pharmacol,2001,416(3):179~183.
13 Barutcu I,Sezgin AT,Sezgin N,et al.Increased high sensitive CRP level and its significance in pathogenesis of slow coronary flow.Angiology[J].2007,58(4):401~407.
14 Li JJ,Wu YJ,Qin XW,et al.Should slow coronary flow be considered as a coronary syndrome[J].Med Hypotheses,2006,66(5):953~956.
15 Lee TM,Lin MS,Tsai CH,et al.Effect of ischaemic preconditioning on regional release of inflammatory markers[J].Clin Sci,2005,109(3):267~276.
16 Wei XM,Heywood GJ,Di Girolamo N,et al.Nicorandil inhibits the release of TNF-a from a lymphocyte cell line and peripheral blood lymphocytes[J].Int Immunopharmacol,2003,3(12):1 581~1 588.
17 Kawamura T,Kadosaki M,Nara N,et al.Nicorandil attenuates NF-kappaB activation,adhesion molecule expression,and cytokine production in patients with coronary artery bypass surgery[J].Shock,2005,24(2):103~108.
18 Ishibashi Y,Takahashi N,Tokumaru A,et al.Effects of longterm nicorandil administration on endothelial function,inflammation,and oxidative stress in patients without coronary artery disease[J].J Cardiovasc Pharmacol,2008,51(3):311~316.
19 HongoM,Mawatari E,Sakai A,et al.Effects of nicorandil onmonocrotalineinduced pulmonary arterial hypertension in rats[J].J Cardiovasc Pharmacol,2005,46(4):452~458.
20 Heywood GJ,Thomas PS.Nicorandil inhibits degranulation and TNF-a release from RBL-2H3cells[J].Inflamm Res,2002,51(4):176~181.
21 Thomas GR,DiFabio JM,Gori T,et al.Once daily therapy with isosorbide-5-mononitrate causes endothelial dysfunction in humans evidence of a free-radical-mediated mechanism[J].J Am Coll Cardiol,2007,49(12):1 289~1 295.

