冷水泳浴对高尿酸血症模型大鼠诱发痛风性关节炎的影响
时 乐,徐 立,尹 莲,曾凡伟,梅 琦
(南京中医药大学1.药学院临床药学系,2.药物安全性评价中心,江苏南京 210046)
痛风是由于嘌呤代谢紊乱和(或)尿酸排泄障碍所致的疾病。由于结缔组织特别是软骨和滑膜尿酸盐结晶沉积而引起痛风性急性关节炎反复发作,导致关节畸形,并且常累及肾和心脏,并引起多脏器损伤。随着生活水平的不断提高,痛风性关节炎发病率增加,防治痛风性关节炎已经成为备受关注的研究课题。本实验室曾对啮齿类动物高尿酸血症模型进行系统的研究,成功地建立了小鼠和大鼠急性高尿酸血症模型及大鼠持续性高尿酸模型[1-4]。但是由于临床上并非所有高尿酸血症患者均发生痛风性关节炎,且对诱发关节炎的因素尚不清楚,所以对痛风性关节炎动物模型的研究一直在摸索中。临床上痛风性关节炎的发生有多种因素,如过量摄取高脂高蛋白饮食、食用豆制品或海鲜、喝啤酒及受寒冷潮湿等。饮食和饮酒等因素均为引发高尿酸血症的直接因素,而根据痛风性关节炎发作特点来看,患者多在夜间发作,可见低温对高尿酸血症诱发痛风性关节炎有一定的影响。本研究通过对持续性高尿酸血症模型大鼠附加冷水泳浴条件,观察冷水泳浴对高尿酸血症大鼠诱发痛风性关节炎的影响,为啮齿类动物痛风性关节炎模型的制备提供实验依据。
1 材料与方法
1.1 动物、试剂和仪器
清洁级SD大鼠,雄性,体质量250~290 g,由上海斯莱克实验动物有限责任公司提供,动物许可证号:SCXK(沪)2007-0005。氧嗪酸钾,购自 Sigma-Aldrich公司,用羊毛脂与液体石蜡按质量比3∶2在70℃下混合而成的溶剂配制;次黄嘌呤(hypoxanthine,HX),购自南京鼎润生物技术有限公司;尿酸测定试剂盒,购自上海复星长征医学科学有限公司;液体石蜡,购自上海凌锋化学试剂有限公司;羊毛脂,购自国药集团化学试剂有限公司;甲醛溶液,购自汕头市西陇化工厂有限公司;水合氯醛,购自国药集团化学试剂有限公司。7020全自动生化分析仪(日本日立公司);多普勒激光微循环测定仪,美国Biopac公司。
1.2 动物分组与处理
将大鼠随机分为正常对照组(n=8)、冷水泳浴组(n=8)、高尿酸血症模型组(n=8)、高尿酸血症+冷水泳浴组(n=30)。参照文献[4]复制持续性高尿酸血症大鼠模型。禁食24 h后,正常对照组和冷水泳浴组喂饲普通饲料,高尿酸血症模型组和高尿酸血症+冷水泳浴组喂饲含HX 100 g·kg-1饲料。次日早晨,sc给予氧嗪酸钾1 ml·kg-1,每隔 48 h 注射1次,连续6次。从造模的第1天开始,每天9:00时,将冷水泳浴的大鼠放入10~12℃的水中10 min,每天1次,共12 d。
1.3 大鼠后肢肿胀率及肿胀发生率的测定
造模前,用足容积测定仪测量各组大鼠左、右后肢容积。造模期间,从大鼠后肢关节出现肿胀次日起至实验结束,每天使用足容积测定仪测量各组大鼠双侧后肢容积,计算足容积均数作为造模后该大鼠后肢平均容积。关节肿胀率(%)=(造模后双后肢容积-造模前双后肢容积)/造模前双后肢容积×100%。
1.4 微循环测定仪测定足面单位面积红细胞矢量和血灌流单位(blood perfusion unit,BPU)
造模12 d后,将大鼠以10%水合氯醛麻醉后,仰位固定于鼠板上,稳定1 min后,用多普勒微循环测定仪测大鼠右后肢足面单位面积红细胞矢量和BPU,测定时间为2 min。
1.5 大鼠血清尿酸浓度的测定
分别于造模前和造模6和12 d后,各组大鼠于眼眶静脉丛取血,每只0.5 ml,离心,取血清,全自动生化分析仪测定尿酸浓度。
1.6 大鼠踝关节尿酸浓度的测定
处死所有大鼠,剔除右侧踝关节周围肌肉,打开关节腔,用0.2 ml生理盐水反复冲洗关节腔5次,测定踝关节液中尿酸浓度。
1.7 大鼠踝关节组织病理学观察
取左侧踝关节,10%甲醛溶液固定,经15%EDTA脱钙后,常规取材,脱水,石蜡包埋,切片厚4μm,HE染色,光学显微镜下观察组织病理变化。
1.8 统计学分析
2 结果
2.1 冷水泳浴对高尿酸血症大鼠肿胀发生率及后肢关节肿胀率的影响
12 d实验结束时,高尿酸血症+冷水泳浴组大鼠死亡12只,其中有5只已经出现关节肿胀,且肿胀部位有红肿、破溃和感染的症状,具体死亡原因有待进一步探讨。该组大鼠关节肿胀发生率为76.7%(23/30);其余各组均未见关节肿胀及死亡。
高尿酸血症+冷水泳浴组大鼠造模后第4天,肉眼即可观察到后肢关节开始出现红肿;第5天起,该组大鼠出现关节肿胀的例数增加并出现肿胀高峰,且一直维持至第8天,肿胀部位有红肿、破溃的症状;第10天起,约半数肿胀大鼠红肿自行缓解或消失。至实验结束时,各组大鼠后肢平均关节肿胀率见表1,提示高尿酸血症和冷水泳浴共同作用可引起大鼠后肢关节肿胀。
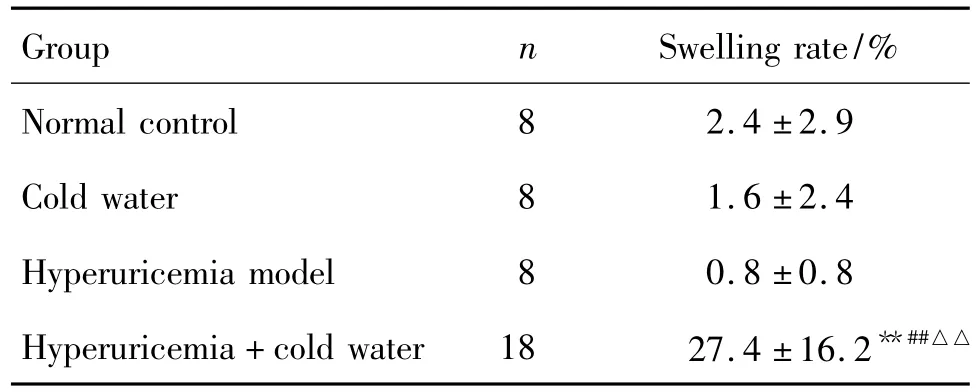
Tab.1 Effect of swimming in cold water on swelling in hind limbs of hyperuricemia rats
2.2 冷水泳浴对高尿酸血症大鼠后肢足面微循环的影响
造模12 d后,与正常对照组比较,其余各组大鼠后肢微循环均表现为不畅(P<0.01);其中高尿酸血症+冷水泳浴组与冷水泳浴组和高尿酸血症模型组比较,微循环阻滞更加明显(P<0.01)(表2);提示高尿酸血症和冷水泳浴均可降低大鼠末梢微循环,两种因素共同作用可导致更加严重的微循环障碍。
2.3 冷水泳浴对高尿酸血症大鼠血清尿酸浓度的影响
造模6和12 d后,各组大鼠血清尿酸水平的变化见表3。与正常对照组比较,冷水泳浴组无明显变化,高尿酸血症模型组和高尿酸血症+冷水泳浴组明显升高(P<0.01)。高尿酸血症+冷水泳浴组与高尿酸血症模型组比较无明显变化,与冷水泳浴组比较显著升高(P<0.01),提示冷水泳浴对大鼠血清尿酸水平无直接影响。
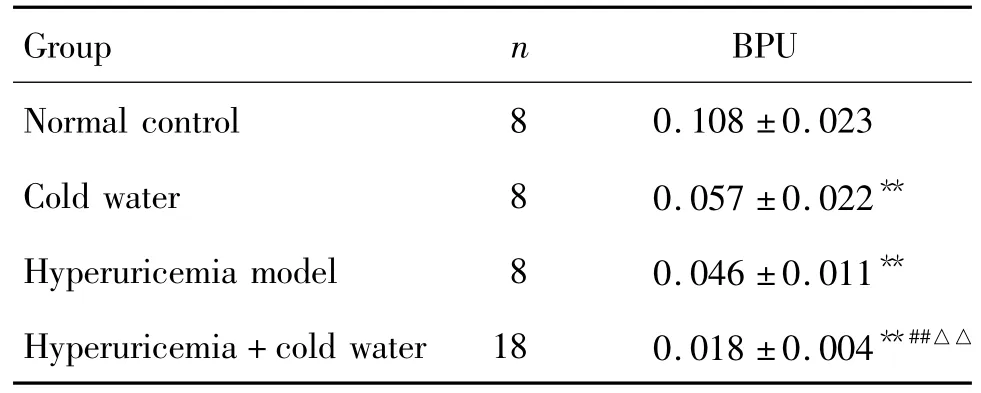
Tab.2 Effect of swimming in cold water on blood perfusion unit(BPU)in foot microcirculation of hyperuricemia rats
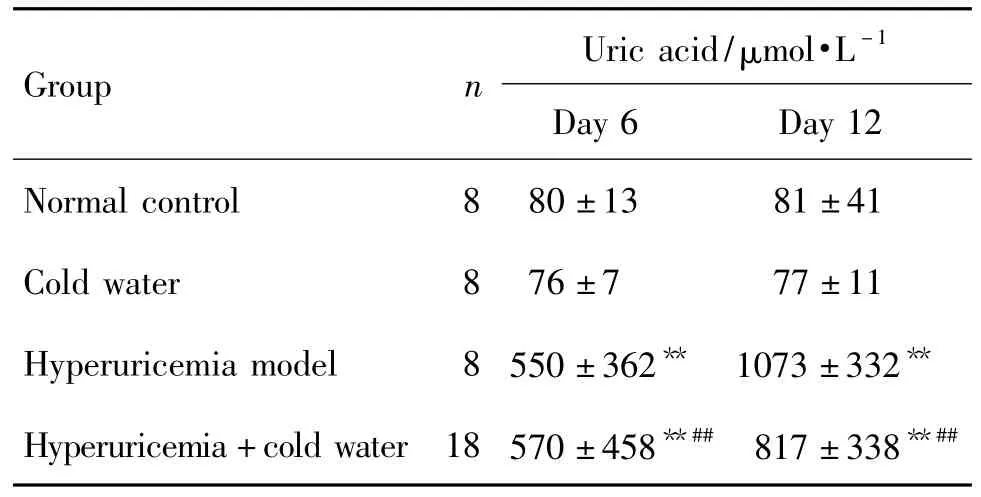
Tab.3 Effect of swimming in cold water on serum uric acid concentration in hyperuricemia rats
2.4 冷水泳浴条件对高尿酸血症大鼠右踝关节腔尿酸浓度的影响
表4结果显示,造模12 d后,与正常对照组比较,其余各组大鼠踝关节腔中尿酸浓度均明显升高(P<0.01);高尿酸血症+冷水泳浴组明显高于冷水泳浴组和高尿酸血症模型组(P<0.01);提示高尿酸血症和冷水泳浴均可增加大鼠踝关节腔尿酸浓度;当两种因素同时存在时,其交互作用可增加大鼠踝关节腔尿酸盐的沉积。
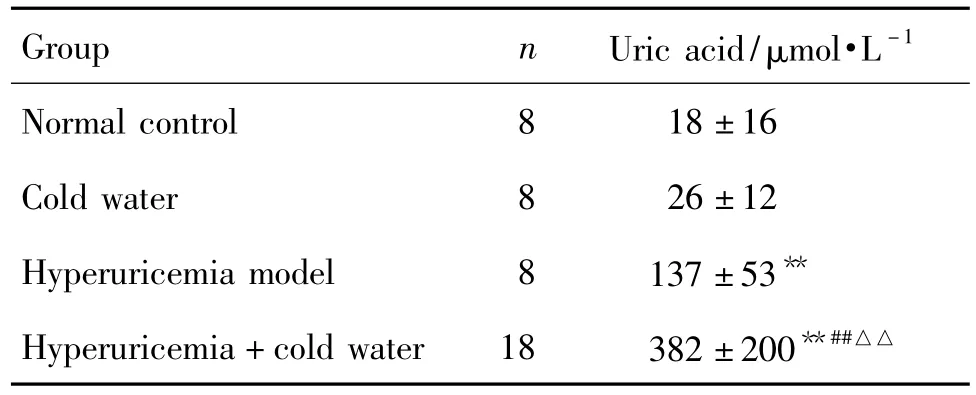
Tab.4 Effect of swimming in cold water on uric acid concentration in joint cavity of hyperuricemia rats
2.5 冷水泳浴对高尿酸血症大鼠左侧踝关节组织病理变化的影响
由图1结果表明,正常对照组踝关节无明显肿胀,滑膜完整、无增生,细胞排列整齐,无充血水肿,无炎症细胞浸润,关节腔内无积液,关节软骨完整,无破坏(图1A)。冷水泳浴组踝关节无异常改变(图1B)。高尿酸血症模型组有1例滑膜内血管扩张充血,少许淋巴细胞和中性粒细胞浸润,周围软组织血管扩张充血(图1C)。高尿酸血症+冷水泳浴组约76.7%的踝关节肿胀,镜下可见滑膜内血管扩张充血明显,个别滑膜细胞轻度增生,伴有少量的炎症细胞(有淋巴细胞、浆细胞、中性粒细胞和巨噬细胞)浸润,周围软组织血管扩张充血,间质水肿,伴有类似的炎症细胞浸润(图1D)。
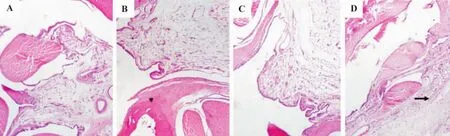
Fig.1 Effect of swimming in cold water on histopathological changes in ankle joints of hyperuricemia rats(HE ×40).A:normal control group;B:cold water group;C:hyperuricemia model group;D:hyperuricemia+cold water group.Arrows showed inflammatory cells invasion.
3 讨论
目前国内外制备痛风性关节炎动物模型主要采用将尿酸盐直接注入动物关节腔的方法[5-6],但上述方法所致肿胀仅为一种非特异性炎症反应,不同于临床因代谢障碍而形成的痛风性关节炎,对于痛风的病理生化基础——高尿酸血症并未涉及,所以不能准确评价抗痛风药物的作用和作用机制。为此许多学者试图通过不同的方法建立一种符合临床的、由嘌呤代谢紊乱所致的大鼠高尿酸血症痛风性关节炎动物模型,但目前均未见有成功的报道。
高尿酸血症是发生痛风性关节炎的基础,但是临床上并非所有高尿酸血症患者均发生痛风性关节炎,可能存在其他诱发痛风性关节炎的因素。为了进一步探讨这个问题,本实验室曾经考察了温度对尿酸盐结晶沉积的影响,结果显示低温有利于尿酸盐结晶的形成[7-8]。
本研究曾选取0℃水浴研究,结果大鼠死亡数较多,且冻伤严重。通过预实验,本研究最终选择在高尿酸血症大鼠模型基础上附加大鼠可以耐受的适宜水温10~12℃冷水泳浴。实验结束时,仅高尿酸血症+冷水泳浴组大鼠发生了后肢关节肿胀,肿胀发生率约76.7%,组织病理学检查主要表现为轻度的滑膜炎和周围软组织炎症,关节腔中尿酸浓度明显升高,并且受试大鼠后肢关节肿胀的过程与临床痛风性关节炎发病过程相似。上述结果表明,对高尿酸血症模型大鼠附加冷水泳浴条件可诱发痛风性关节炎的发生。后期还将考察不同水温对造模成功率的影响。
此外,本研究结果表明,冷水泳浴可使大鼠后肢微循环受阻,其受阻程度以合并高尿酸血症大鼠尤为显著,高尿酸血症和冷水泳浴因素的加和是增加大鼠后肢关节肿胀发生率的主要因素。这可能是因为寒冷刺激使局部微血管收缩使局部血流减慢,从而使高尿酸血症患者的关节局部出现尿酸大量的聚集,关节局部pH降低刺激微血管,毛细血管和关节囊外层纤维结缔组织通透性增加,致使尿酸得以向关节腔转移和聚集,最终引发痛风性关节炎。由此提示,高尿酸血症大鼠肢体微循环障碍可能是导致尿酸盐聚集于关节并引起关节炎症的重要原因之一。
[1]Xu L,Shi L.A preliminary study on the establishment of a mouse model of hyperuricemia[J].Chin J Comp Med(中国比较医学杂志),2006,16(1):1-4.
[2]Xu L,Shi L,Zhong WX.Exploratory development of uricase inhibitor for replicating acute animal model of hyperuricemia on rat[J].Chin J Comp Med(中国比较医学杂志),2007,17(3):142-146.
[3]Xu L,Shi L,Zhao F,Tan QW,Yao JL.A preliminary study on the establishment of rat model with acute hyperuricemia[J].Chin Pharmacol Bull(中国药理学通报),2007,23(7):976-978.
[4]Xu L,Shi L.A preliminary study on the replication of continuity hyperuricemia rat model by administration and fed with hypoxanthine[J].Chin Pharmacol Bull(中国药理学通报),2008,24(12):1671-1673.
[5]Chen WZ,Jiang H,Liu YL,Lin J,Jin C,Gu RS.The experimental study of anti-inflammation and analgesia effect of TFN on acute gout[J].Chin J Tradit Med Traumatol Orthop(中国中医骨伤科杂志),1999,7(4):1-3.
[6]Ishimaru JI,Ogi N,Mizuno S,Goss AN.Quantitation of chondroitin-sulfates,disaccharides and hyaluronan in normal,early and advanced osteoarthritic sheep temporomandibular joints[J]. Osteoarthritis Cartilage,2001,9(4):365-370.
[7]Pan Y,Xu L,Shi L,Yin L,Duan JA,Zeng FW.Effect of different PH and different temperature on the formation of urate crystals[J].J Liaoning Univ Tradit Chin Med(辽宁中医药大学学报),2010,12(4):67-69.
[8]Xu L,Liu RN,Shi L,Pan Y,Yin L,Zeng FW,et al.Effects of temperature on the deposition of urate crystal in vitro[J].Pharmacol Clin Chin Mater Med(中药药理与临床),2011,27(2):123-124.

