硅对稻瘟病菌侵染下水稻叶片超微结构的影响
刘俊渤,高 臣,高 杰,马景勇,常海波
(1 吉林农业大学资源与环境学院,吉林长春 130118;2 吉林农业大学农学院,吉林长春 130118)
水稻Oryza sativa L.在自然界生长过程中经常要遭受一些生物危害,主要是病原物(包括真菌、细菌和病毒)和杂草等.诸多研究[1-3]已表明,硅能提高水稻的抗病性,但其机理仍不清楚.许多研究者认为,沉积在表皮细胞壁、乳突体或染病部位的硅起到了机械或物理屏障作用,Kim等[4]研究发现,加硅后水稻对稻瘟病抗、感品种的病害严重度均显著降低,并认为硅诱导水稻叶片细胞壁中防御区的形成可能与水稻抗稻瘟病能力的提高有关,他们还观测到抗病品种的硅层与表皮细胞壁厚度的比率比感病品种的高得多.前人[5-7]研究发现经硅处理的黄瓜叶片内被白粉病菌侵染的细胞细胞壁、细胞壁与质膜间的乳突及病菌吸器颈周围的寄生细胞质内都有硅的积累.Yoshida等[8]认为硅对真菌抗性方面也可能主要是机械性防护作用阻止了菌丝侵入,另一方面硅影响真菌对细胞壁的酶降解,再者硅本身对细菌也有一定毒性.水茂兴等[9]研究了硅在水稻新嫩组织中的含量、分布、形态变化与稻瘟病抗性的关系,并阐明硅使水稻组织硅质化,可显著提高水稻对稻瘟病的抗性.曾玉悟[10]也证实了一部分硅在水稻叶片中沉积,与表皮细胞形成硅化细胞构成一道机械屏障,不仅防止真菌菌丝与害虫的入侵,而且还影响真菌对细胞壁的酶降解.王思哲等[11]研究表明,硅形成稳定的、溶解度低的硅酸复合物,沉积在木质化细胞壁上,与木质素一同增强组织的机械强度和稳固性,增强了水稻抵御病虫入侵的能力.为了揭示硅对水稻稻瘟病的抗性机制,本研究采用水培水稻和接种稻瘟病菌等手段,借助扫描电镜和透射电镜观察分析了稻瘟病菌入侵后水稻叶片细胞的超微结构,阐述矿化硅对稻瘟病菌所起到的物理抗性作用.
1 材料与方法
1.1 供试水稻品种和培育
供试水稻为生育期相近的两类水稻:对稻瘟病有高抗病性的农大18号和高感病性的蒙古稻(稻种由吉林农业大学水稻研究所提供).种子经质量分数为50%多菌灵可湿性粉剂1000倍液浸种,在光照培养箱25~30℃下培养至二叶一心,然后移栽至具有塑料盖板的水桶中水培.水培营养液选用无硅的Kimura B 配方[12][(c/(mmol·L-1)]:(NH4)2SO40.37、KNO30.18、KH2PO40.21、Ca(NO3)20.37、Mg-SO40.55、EDTA-Fe 9.0 × 10-2、MnSO47.3 × 10-3、HBO39.3 × 10-3、(NH4)6Mo7O241.54 × 10-5、ZnSO41.5×10-4、CuSO41.6 ×10-4.第 1 周使用半浓度的Kimura B营养液,1周后再用全浓度营养液.以后每天通气1次,每2 d调1次pH至5.5,每隔1周换1次营养液.
1.2 纳米SiO2水溶胶的制备
在250 mL的烧瓶中加入1.5 mL的正硅酸乙酯(TEOS),2 mL质量分数为25%的氨水,1 mL的去离子水和50 mL的乙醇.混合后在室温下搅拌3 h后,补加1 mL正硅酸乙酯,继续反应1 h.所得样品用100 mL去离子水稀释.用减压蒸馏旋转蒸发除去乙醇后用去离子水渗析至pH=7为止[13],即合成了均相透明粒子直径为80 nm的SiO2水溶胶溶液(图1).
1.3 稻瘟病菌接种
供试稻瘟病菌(由吉林省农业科学院水稻研究所提供)为吉林省3个代表性生理小种(E1,E3,ZG1)混合接种.稻瘟病菌在燕麦培养基上,28℃黑暗培养7 d,用载玻片轻刮去表面菌丝,25℃全光照产孢2 d,用无菌水将孢子洗下,用双层纱布过滤,配成孢子悬浮液,浓度为10倍显微镜视野下20~30个孢子.
在水稻长至6叶初期,用孢子悬浮液喷雾接种.接种后用黑色塑料薄膜覆盖,保持黑暗24 h,同时室内用加湿器(亚都超声波加湿器YC-D205,北京亚都科技股份有限公司)保持湿度在85%以上.
1.4 试验设计和处理
试验设2个处理:不施硅接种(Si-R+)和施硅接种(Si+R+).每个处理重复8次.从水稻移栽开始施硅,不施硅和施硅是指营养液中纳米SiO2质量浓度分别为0和80 mg/L.
1.5 分析方法
扫描电镜分析:水稻接种96 h后,对施硅与不施硅处理的2个品种水稻叶片进行取样(取样部位为病健交界处的叶组织),每个处理样本数为5,将所取样本叶片用质量分数为2.5%戊二醛固定48 h,0.1 mol/L磷酸缓冲液浸洗,乙醇梯度脱水,乙酸异戊酯过渡,在液化CO2HCP-2临界点干燥,喷金,用日本Hitachi公司生产的S-4800扫描电镜观察水稻叶片表面结构,并拍片.
透射电镜分析:接种96 h后,对施硅处理的2个品种水稻叶片进行取样,每个处理样本数为5,将所取样本叶片浸入质量分数为2.5%的戊二醛中固定2 h,0.1 mol/L磷酸缓冲液清洗2次(每次1.5 h),然后将样品置于质量分数为1%锇酸溶液中固定1.5 h,用蒸馏水清洗,清洗后用乙醇逐级梯度脱水,最后用纯丙酮脱水2次,脱水后用812环氧树脂按体积比为 3∶1、3∶2、3∶3 梯度渗透,放置干燥 8 h,并用812环氧树脂包埋,聚合后切片染色,最后用日本电子公司JEM-2000EX型透射电镜观察分析.使用SPSS 16.0(Chicago,USA)统计软件进行统计分析.
2 结果与分析
2.1 水稻叶片扫描电镜分析
2个品种施硅与不施硅处理水稻各样本叶片扫描电镜图观察分析结果(图2)表明:在接种稻瘟病菌96 h后,2个品种水稻均发病.所有经过施硅处理的抗病品种叶片表面都只存在少数的稻瘟病菌丝,而不施硅处理的叶片表面侵染有大量的菌丝.对于感病品种,所有不施硅处理的叶片表面同样都存在大量的稻瘟病菌丝,其数量比施硅处理多得多.并且抗病品种叶表面的菌丝大小和数量比感病品种小而且少.说明施硅能有效抑制稻瘟病菌对水稻叶片的入侵.从图2A、2B中还可以发现,无论是抗病品种还是感病品种,在水稻叶表面菌丝纵横穿越硅化细胞,表明硅对稻瘟病菌没有毒性,从而说明硅在水稻体内不是通过直接作用于稻瘟病菌来增强水稻对稻瘟病的抗性.
2.2 水稻叶片透射电镜分析
图3是抗、感病水稻品种有代表性样本叶片表皮细胞、叶肉细胞和维管束鞘细胞的超微结构.对2个品种施硅处理的水稻各样本叶片透射电镜图观察分析结果表明:所有抗、感病品种的样本叶片中均有稻瘟病菌或菌丝.
图3a、3b是在接种稻瘟病菌96 h后抗病品种水稻代表性样本叶片表皮细胞和叶肉细胞的透射电镜图,从图上我们观察到其叶片各细胞中菌丝的周围存在大量的矿化硅,并且这些矿化硅紧紧地将菌丝包围着,甚至有的病菌中间被这些矿化硅物质掏空.感病品种水稻代表性样本叶片表皮细胞和叶肉细胞的透射电镜图中看到菌丝周围只有少量的矿化硅(晶体或非晶体)物质存在(图 3d、3e).图3c、3f分别是抗病品种与感病品种水稻代表性样本叶片的维管束鞘细胞,在这些细胞的间隙中也存在菌丝,同样被矿化硅包围着.
水稻在施用纳米SiO2后,经过生物矿化作用,在水稻体内形成了某种矿化硅(晶体或非晶体)物质,从而阻止稻瘟病菌对水稻叶片的进一步侵害,甚至将其清除,有效地抑制了稻瘟病菌对水稻的入侵,增强了水稻对稻瘟病菌的抗性,这与Rodrigues等[15]的研究一致.
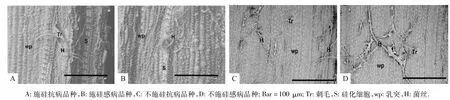
图2 接种稻瘟病菌后水稻叶片表面SEMFig.2 SEM map of rice leaves surface after inoculation

图3 接种稻瘟病菌后水稻叶片表面TEMFig.3 TEM map of rice leaves surface after inoculation
在进行透射电镜分析时,我们同时借助测微尺对2种水稻叶片中各细胞的细胞壁厚度进行了测量,结果见表1.从表1中数据可以看出,施硅的2种水稻叶片的表皮和维管束鞘细胞的细胞壁厚度均比不施硅处理的要大,但与不施硅处理无显著性差别,并且施硅与不施硅处理的水稻叶片叶肉细胞壁的厚度没有变化.
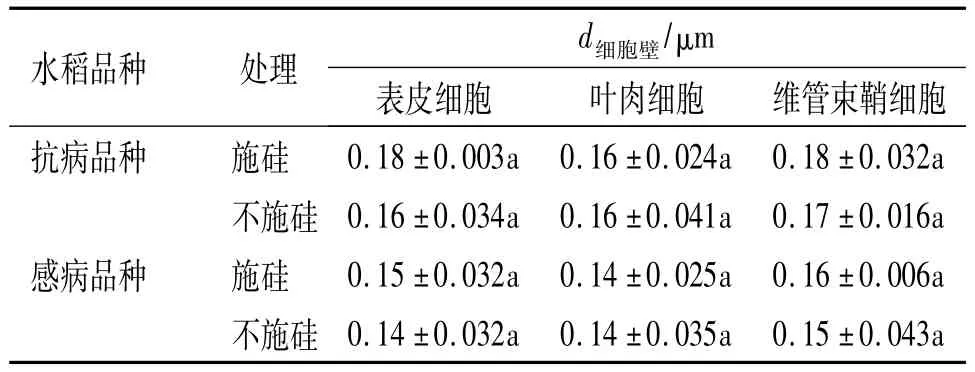
表1 水稻叶片各细胞的细胞壁厚度1)Tab.1 The cell wall thickness of each cell of rice leaves
3 讨论
通过对稻瘟病侵染后水稻叶片表面组织扫描电镜的观察分析,结果表明接种稻瘟病菌后,2个水稻品种均发病,但抗病品种的水稻叶片表面只存在少数的稻瘟病菌丝,而感病品种的叶片表面存在的菌丝大而多.张国良[14]在施硅增强水稻对纹枯病抗性的机制研究中表明,水稻在施硅后叶表面的纹枯病菌菌丝纵横交错,水稻叶片的硅化细胞表面菌丝很少,并且抗病品种的菌丝数目比感病品种的要少,与本研究结果相符.
Rodrigues等[15]在仅供硅条件下,研究了含有稻瘟病菌的水稻叶片的超微结构,研究者在一些表皮细胞中发现,有少量颗粒状的SiO2材料沉淀偶尔与真菌壁作用,并发现经过硅处理的水稻叶片,真菌菌丝被表皮细胞、维管束和叶肉细胞中致密的SiO2颗粒物质均匀包围.本试验对接种96 h后水稻叶片细胞结构的透射电镜观察结果也表明:纳米SiO2处理的抗病品种和感病品种在施硅后,叶片表皮细胞内形成的生物矿化二氧化硅材料不仅能阻止稻瘟病菌对水稻叶片的进一步侵害,甚至能将其清除.同时,试验研究还表明,无论施硅与否,对叶片内各细胞的细胞壁厚度影响不大.但张国良[14]研究认为,施硅处理抗病品种叶片厚壁细胞的细胞壁厚度没有变化,而感病品种叶片厚壁细胞的细胞壁厚度增加,是缺硅处理的2倍左右,与本研究不同.
综上所述,硅在水稻叶片表面和细胞中的积累,起到了物理屏障的作用,阻挡了菌丝入侵,从而增强了水稻对稻瘟病菌的结构抗性.
[1]SEEBOLD K W,KUCHAREK T A,DATNOFF L E,et al.The influence of silicon on components of resistance to blast in susceptible,partially resistant,and resistant cultivars of rice[J].Phytopathology,2001,91(1):63-69.
[2]HAYASAKA T,FUJII H,NAMAI T.Silicon content in rice seedlings to protect rice blast fungus at the nursery stage[J].J Gen Plant Pathol,2005,71(3):169-173.
[3]HAYASAKA T,FUJII H,ISHIGURO K.The role of silicon in preventing appressorial penetration by the rice blast fungus[J].Phytopathology,2008,98(9):1038-1044.
[4]KIM S G,KIM K W,PARK E W,et al.Silicon-induced cell wall fortification of rice leaves:A possible cellular mechanism of enhanced host resistance to blast[J].Phytopathology,2002,92(10):1095-1103.
[5]SAMUELS A L,GLASS A D M.Mobility and deposition of silicon in cucumber plants[J].Plant,Cell and Environment,1991,14:485-492.
[6]CHERIF M,MENZIES J G,BENHAMOU N,et al.Studies of silicon distribution in wounded and pythium ultimum infected cucumber plants[J].Physiological and Molecular Plant Pathology,1992,41(5):371-385.
[7]CHERIF M,BENHAMOU N,MENZIES J G,et al.Silicon induced resistance in cucumber plants against Pythium ultimum[J].Physiological and Molecular Plant Pathology,1992,41(6):411-425,
[8]YOSHIDA S.Chemical aspects of the role of silicon in physiology of the rice plant[J].Bull Natl Inst Agric Sci:B,1965,15:1-58.
[9]水茂兴,陈德福,秦遂初,等.水稻新嫩组织的硅质化及其与稻瘟病抗性的关系[J].植物营养与肥料学报,1995,5(4):352-358.
[10]曾玉悟.水稻硅素营养与硅肥施用[J].江西农业科技,1987(5):19-20.
[11]王思哲,温圣贤,邓文,等.硅肥在水稻上的应用研究进展[J].作物研究,2007,21(5):620-624.
[12]LIANG Yong-chao,HUA Hai-xia,ZHU Yong-guan,et al.Importance of plant species and external silicon concentration to active silicon uptake and transport[J].New Phytologist,2006,172(1):63-72.
[13]王荔军.在细胞壁上构筑的纳米结构SiO2赋予植物抗逆的作用机制[D].武汉:华中农业大学,2002.
[14]张国良.施硅增强水稻对纹枯病抗性的机制研究[D].扬州:扬州大学图书馆,2009.
[15]RODRIGUES F A,BENHAMOU N,DATNOFF L E,et al.Ultrastructural and crtochemical aspects of silicon-mediated rice blast resistance[J].Biochemistry and Cell Biology,2003,93(5):535-546.

